人参皂苷Rg1对冈田酸诱导的AD样脑片模型的影响*
2016-06-27李明李玺权乾坤袁海峰王娟徐阳
李明 李玺 权乾坤 袁海峰 王娟 徐阳
(1. 西安交通大学医学院第二附属医院, 陕西 西安 710004;2. 第四军医大学西京医院,陕西 西安 710032;3. 西安市第五医院,陕西 西安 710083)
·论著·
人参皂苷Rg1对冈田酸诱导的AD样脑片模型的影响*
李明1李玺1权乾坤1袁海峰1王娟2徐阳3
(1. 西安交通大学医学院第二附属医院, 陕西 西安 710004;2. 第四军医大学西京医院,陕西 西安 710032;3. 西安市第五医院,陕西 西安 710083)
【摘要】目的观察人参皂苷Rg1对阿尔茨海默病(AD)大鼠脑片模型中磷酸化Tau蛋白及蛋白磷酸酯酶2B(PP2B)的影响,探讨中药人参皂苷Rg1抑制AD模型大鼠脑片Tau蛋白磷酸化的作用机制。方法将通过冈田酸诱导SD大鼠脑片(含皮层和海马),造成Tau蛋白过度磷酸化的AD脑片模型,随机分为对照组、模型组和60、120、240μmol/L人参皂苷Rg1干预组,干预结束后采用免疫组织化学、western bolt、图像分析技术等方法检测各组大鼠脑片P-Tau、PP2B水平。结果模型组大鼠脑片P-Tau蛋白表达明显增加,PP2B蛋白表达明显减少;人参皂苷Rg1各浓度组P-Tau蛋白表达减少,PP2B蛋白表达增加,其中240μmol/L人参皂苷Rg1组P-Tau蛋白表达最少,PP2B蛋白表达最多,差异均有统计学意义(均P<0.05)。结论人参皂苷Rg1可能通过上调AD样Tau蛋白磷酸化大鼠脑片模型中PP2B的表达进而促进P-Tau的去磷酸化,以此途径抑制Tau蛋白磷酸化,从而减缓神经原纤维缠结形成。
【关键词】人参皂苷Rg1;阿尔茨海默病(AD);磷酸化Tau蛋白;蛋白磷酸酯酶2B(PP2B)
磷酸化微管相关蛋白(Protein Tau,P-Tau)存在于正常人的大脑中,但是Tau蛋白过度磷酸化参与了神经原纤维缠结(Neurofibrillary tangle,NFT)[1]形成,成为阿尔茨海默病(Alzheimer′s disease,AD)的核心病理变化。Tau蛋白异常过度磷酸化并形成PHF被认为是AD神经元退化的基础, 并且NFT的数目与AD病人的痴呆程度密切相关[2,3]。人参皂苷Rg1是从人参中提取的一类生物活性成分[4],有增强记忆和认知功能的作用,已成为研究中药抗老年痴呆的热点之一。研究表明,蛋白磷酸酯酶是Tau蛋白去磷酸化的重要调节酶,其活性的增强在AD的Tau蛋白去磷酸化中发挥了重要的作用。本实验参照国内外有关文献[5,6],采用冈田酸(Okadaicacid,OA)诱导的大鼠培养脑片方法,建立Tau蛋白过度磷酸化的AD模型,观察人参皂苷Rg1对磷酸化Tau蛋白、蛋白磷酸酯酶2B(PP2B)的调控作用,拟阐明人参皂苷Rg1是否通过上调PP2B蛋白表达途径以抑制Tau蛋白磷酸化,降低AD大鼠脑片模型中磷酸化Tau蛋白水平,现将结果报告如下。
1材料和方法
1.1实验动物健康6周龄SD雄性大鼠10只,体重120~130g,清洁级,购自西安交通大学医学院实验动物中心,合格证号为SCXK(陕)2009-001。实验中对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导意见》。每只鼠取400μm厚海马及皮层脑片5张,随机分为5组:空白对照组、模型组和人参皂苷Rg1大、中、小浓度组,每组10张脑片。
1.2药物与试剂人参皂苷Rg1购自吉林宏久生物科技股份有限公司,纯度98.99%,使用前溶于生理盐水配成浓度分别为60、120和240mg/ml的3种溶液。岗田酸购自美国ALEXIS生物制剂公司,纯度98%,使用前溶于10%二甲基亚砜(dimethysulphoxide,DMSO),配制成1mg/ml DMSO溶液待用;PP2B多克隆抗体、β-actin及PVDF膜为北京博奥森生物技术有限公司产品;P-Tau(Sere262) 多克隆抗体及SABC试剂盒、抗体稀释液均购自武汉博士德生物工程有限公司。Haws′S苏木素由西安交通大学医学实验中心提供。
1.3实验方法
1.3.1动物模型的制备[7]、分组及干预在6%水合氯醛麻醉下切开大鼠头皮,暴露颅骨,迅速断头,取脑,置于0~4℃的人工脑脊液冰水混合物中,洗净血液并降温后,行冠状切片,平均厚度400μm。挑选形态较好(含海马和皮层)的脑片置入盛有人工脑脊液(mmol/L, 150 NaCl,2 CaCl2,1.2 MgSO4,0.5 KH2PO4,1.5 K2HPO4,10 glucose,pH 7.4)的6孔板中孵育,整个过程中于人工脑脊液持续通入混合氧气(95%O2+5%CO2),保持温度(32.0±0.5)℃。脑片随机分为5组:对照组、模型组和人参皂苷Rg1低、中、高浓度组,每组10张脑片。ACSF孵育1小时,人参皂苷Rg1各组中加入人参皂苷Rg1致使其浓度分别为60、120、240μmol/L,预处理2小时后,模型组和人参皂苷Rg1各组ACSF中分别加入OA,使其浓度为1μmol/L,作用3小时,对照组不加任何处理因素。干预结束后,各组大鼠脑片经4%多聚甲醛固定4小时,然后转入30%蔗糖溶液浸泡至沉底,做冰冻切片,切片10μm厚,每张切片含皮层、海马、齿状回。
1.3.2免疫组化检测蛋白表达采用免疫组化染色(SABC法)分别检测各组脑片皮层和海马P-Tau、PP2B蛋白的表达情况。脑组织切片经正常山羊血清抗体封闭后,分别加入兔抗大鼠P-Tau、PP2B多克隆抗体(一抗浓度均为1∶1 000),4℃过夜,生物素标记的羊抗兔二抗孵育40 min,DAB显色剂显色,然后苏木精复染、脱水、透明、封固。实验中用磷酸盐缓冲液(PBS)替代一抗作为阴性对照。采用图象处理与分析系统对各组脑片阳性表达细胞的表达情况进行灰度分析,每张切片同一区域中随机选取6个视野,检测面积相同,采集6组数据,取其平均灰度值作为该切片目标区域的平均灰度值,灰度值越低,阳性表达量越高;反之灰度值越高,阳性表达量越低。
1.3.3Western blot 检测P-Tau、PP2B 蛋白水平干预结束后,将脑片取出匀浆,充分裂解,提取总蛋白。采用不连续SDS-PAGE法,将提取的总蛋白经电泳仪电泳进行蛋白分离,之后进行蛋白转膜,经多次封闭、漂洗后,分别用待测目的蛋白的一抗(P-Tau抗体浓度200μg/ml、PP2B抗体浓度200μg/ml)与PVDF膜上的蛋白相互作用,加入辣根酶标记的P-Tau、PP2B二抗。采用DAB法显色,用PBS做阴性对照。通过凝胶成像分析仪对各组蛋白条带表达情况进行扫描分析,测出灰度值。利用Image J 1.44p软件对图像进行灰度分析。目的蛋白的相对表达量分别以各自条带灰度值与β-actin灰度值之比表示,采集10组数据。
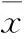
2结果
2.1免疫组化检测P-Tau、PP2B阳性细胞表达
2.1.1大鼠脑片阳性免疫反应细胞分析P-Tau的阳性免疫反应物质为棕黄色,主要分布于细胞的胞浆和突起,皮层主要分布在第Ⅱ、Ⅲ、Ⅴ层的颗粒细胞和椎体细胞,在海马主要分布于椎体细胞。PP2B的棕黄色阳性反应物质主要分布于细胞的胞膜、胞浆和突起,细胞核着色较淡或不着色。
2.1.2OA处理后脑片P-Tau、PP2B 阳性细胞表达的情况与对照组比较,模型组大鼠脑片P-Tau的阳性细胞表达明显增加(P<0.05),PP2B的阳性细胞表达明显减少(P<0.05),见表1。

表1 OA对大鼠培养脑片P-Tau、PP2B表达量变化的影响
注:与空白对照组比较, ①P<0.05
2.1.3人参皂苷Rg1干预后各组大鼠脑片P-Tau阳性细胞表达量的情况人参皂苷Rg1各浓度组与模型组比较,P-Tau阳性反应物质均有不同程度减少(均P<0.05);人参皂苷Rg1各组之间比较,人参皂苷Rg1大剂量组较人参皂苷Rg1中、小剂量组更能有效降低P-Tau的表达(均P<0.05),见表2、图1。
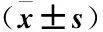
表2 人参皂苷Rg1对AD模型大鼠脑片P-Tau表达的影响
注:与空白对照组比较,①P<0.05;与模型组比较, ②P<0.05;与大剂量组比较,③P<0.05;与中剂量组比较,④P<0.05

图1人参皂苷Rg1对AD模型大鼠脑片P-Tau蛋白表达的影响(免疫组织化学,×400)
Figure 1Expression of P-Tau protein in different groups (immunohistochemical method,×400)
注:a.空白对照组; b.模型组; c.人参皂甙Rg1大剂量组
2.1.4人参皂苷Rg1干预后各组脑片PP2B阳性细胞表达量的情况与模型组比较,人参皂苷Rg1各组PP2B阳性反应物质表达明显增加(均P<0.05);人参皂苷Rg1各组间比较,在各脑区人参皂苷Rg1大剂量组PP2B蛋白的表达高于人参皂苷Rg1中、小剂量组(均P<0.05),中、低浓度组之间亦存在明显差异(P<0.05),见表3、图2。
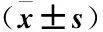
表3 人参皂苷Rg1对AD模型大鼠脑片PP2B表达的影响
注:与空白对照组比较,①P<0.05;与模型组比较, ②P<0.05;与大剂量组比较,③P<0.05;与中剂量组比较,④P<0.05

图2人参皂苷Rg1对AD模型大鼠脑片PP2B蛋白表达的影响(免疫组织化学,×400)
Figure 2Expression of PP2B protein in different groups(immunohistochemical method,×400)
注:.a.空白对照组; b.模型组; c.人参皂甙Rg1大剂量组
2.2Western blot 检测P-Tau、PP2B蛋白表达
2.2.1人参皂苷Rg1对AD模型大鼠脑片P-Tau表达的影响 与对照组比较,模型组P-Tau蛋白表达量明显增加(P<0.05);与模型组比较,人参皂苷 Rg1 各组P-Tau 蛋白表达量均显著减少(均P<0.05),其中以人参皂苷Rg1大剂量组P-Tau 蛋白表达减少最为显著,其次为人参皂苷Rg1中剂量组、小剂量组(均P<0均05 ),见图3。
图3Western blot检测各组大鼠海马P-Tau蛋白结果
Figure 3Expression of P-Tau protein in different groups (Western blot)
注:a.western blot;b.Expression level of P-Tau protein in different groups
2.2.2人参皂苷Rg1对AD模型大鼠脑片PP2B蛋白表达的影响与对照组比较,模型组大鼠脑片PP2B蛋白的表达显著减少(P<0.05 );人参皂苷 Rg1 各浓度组与模型组比较, PP2B蛋白表达均增高(均P<0.05 ),其中人参皂苷Rg1大剂量组PP2B蛋白表达增加更为显著,人参皂苷Rg1中剂量组较小剂量组表达亦增加(均P<0.05 ),见图4。
3讨论
NFT产生的原因是Tau蛋白的过度磷酸化[1,2]。正常生理条件下,大脑中Tau蛋白可促进微管蛋白聚集成微管并增强其稳定性,在轴突的通讯传导中起着至关重要的作用[8]。Tau过度磷酸化后,与管蛋白竞争结合正常Tau,抑制微管的聚集,则其促进微管组装和稳定微管的生物活性就会丧失,从而导致细胞骨架的结构异常,形成神经纤维缠结[9]。目前已发现Tau有45个磷酸化位点[10], 其中包括Ser 262 位点,而 Ser 262是唯一位于AD Tau蛋白微管结合域的磷酸化位点,这一位点的磷酸化能够显著地削弱Tau蛋白与微管的结合能力,在AD患者脑Tau蛋白检测有明显过度磷酸化改变。研究者在大鼠脑内注射冈田酸在Ser-198/Ser-199/Ser-262、 Ser-396/Ser-404位点可诱导Tau蛋白发生磷酸化[11]。冈田酸是蛋白磷酸酶的高效选择性抑制剂,被广泛应用于诱导Tau蛋白的过度磷酸化[12],如冈田酸作用于人神经母细胞瘤细胞导致细胞Tau蛋白过度磷酸化[13],与AD病人脑组织中的病理特征一致。本实验选用Ser 262位点磷酸化进行研究,免疫组化染色结果表明,模型组大鼠脑内P-Tau蛋白表达较对照组增加,推测冈田酸可能诱导了大鼠脑片Tau蛋白在Ser 262位点发生磷酸化。人参皂苷Rg1预处理可以逆转冈田酸这种作用。与模型组比较,人参皂苷Rg1各组P-Tau蛋白表达均明显降低,并以高浓度组效果最佳。
图4Western blot检测各组大鼠海马PP2B蛋白结果
Figure 4Expression of PP2B protein in different groups (Western blot)
a.Western blot; b.Expression level of PP2B protein in different groups
任何Tau蛋白磷酸化都由蛋白激酶和磷酸酶的作用决定,磷酸酶活性正常可维持细胞骨架的完整,磷酸酶活性降低将导致Tau蛋白过度磷酸化[14]。实验证实,许多蛋白激酶可促进Tau蛋白磷酸化,体外磷酸化的Tau蛋白去磷酸化则可以使NFT松解。AD脑组织中所有Tau蛋白的磷酸化位点都位于Ser/ Thr残基,所以Ser/Thr磷酸酶能催化Tau蛋白脱磷酸基。研究人员将PP2B的抑制剂处理培养的神经母细胞瘤细胞,可导致 Tau 蛋白几个特殊位点过度磷酸化[15]。PP2B是海马区最主要的P-Tau去磷酸化磷酸酶,且导致P-Tau去磷酸化的位点最多[16]。另外,人参皂苷Rg1是人参的主要活性成分之一,近年来关于其对Tau蛋白磷酸化的抑制作用研究,主要集中于降低糖原合成酶激酶-3β的活性[17],抑制周期依赖性蛋白激酶5的表达等[18]方面。本课题组前期研究也表明,人参皂苷Rg1可以通过下调蛋白激酶A的表达以抑制Tau蛋白磷酸化[19]。但是关于人参皂苷Rg1能否对PP2B的表达产生影响未做深入研究和报道。本实验利用人参皂苷Rg1对AD样Tau蛋白磷酸化大鼠脑片模型进行预处理,观察其对脑片模型中PP2B表达的影响,结果表明,与模型组比较,各人参皂苷Rg1组PP2B的表达增加;3个浓度人参皂苷Rg1组之间比较,差异亦有统计学意义,其中以240μmol/L人参皂苷Rg1组效果最佳。这表明人参皂苷Rg1能有效减轻岗田酸引起的Tau蛋白过度磷酸化,从而减轻NFT的形成。
4结论
本实验证实,以OA诱导大鼠培养脑片Tau蛋白过度磷酸化的阿尔茨海默病脑片模型,人参皂苷Rg1可能通过上调AD样Tau蛋白磷酸化大鼠脑片模型中PP2B的表达从而促进P-Tau的去磷酸化,以此途径抑制Tau蛋白磷酸化,从而减缓神经原纤维缠结形成,为人参皂甙Rg1治疗AD的研究提供了新靶点,新思路。
【参考文献】
[1]Liu YH, Wang JZ. Relationship between abnormal tau protein expression and Alzheimer,s disease[J]. Sheng Ming De Hua Xue,2006,26(2):108-110.
[2]Arriagada PV, Growdon JH, Hedley-Whyte ET,etal. Neurofibrillary tangles but not senile plaques parallel duration and severity of Alzheimers disease[J]. Neurology,1992, 42(3):631-639.
[3]Giannakopoulos P, Herrmann FR, Bussière T,etal. Tangle and neuron numbers,but not amyloid load,predict cognitive status in Alzheimers disease[J]. Neurology, 2003, 60(9): 1495-1500.
[4]刘颖,李玺,袁海峰.人参皂甙Rg1促进学习记忆作用研究进展[J].中国中西医结合杂志,2006,26(10):956-959.
[5]鲁远君,余昌胤.阿尔茨海默病中针对tau蛋白治疗的研究进展[J].中国神经免疫学和神经病学杂志,2008,15(3):211-213.
[6]李玺,刘颖,袁海峰,等.人参皂苷Rg1对冈田酸所致大鼠脑片tau蛋白磷酸化的影响[J].中国中西医结合杂志,2010,8(10):955-960.
[7]Gong CX, Lidsky T, Wegiel J,etal. Metabolically active rat brain slices as a model to study the regulation of protein phosphorylation in mammalian brain[J]. Brain Res Protoc,2001,6(3):134-140.
[8]吴琪.Alzheimer病神经原纤维缠结tau蛋白研究[J].中国神经精神疾病杂志,2000,26(1): 63-64.
[9]孙爱民,王海萍,沈玉君.Ser202/Thr205位点磷酸化tau在神经元中的定位[J].中国药理学通报,2011,27(1):41-45.
[10] Hanger DP, Anderton BH, NobleW. Tau phosphorylation: the therapeutic challenge for neurodegenerative disease[J]. Trends MolMed, 2009,15(3):112-119.
[11] 田青,张蕲,王群,等. OA诱导大鼠基底核Ach降低及T蛋白过度磷酸化[J]. 华中科技大学学报:自然科学版,2004,32(12): 94.
[12] 褚燕琦,张兰,李林,等.人参皂苷对蛋白磷酸酶抑制剂冈田酸拟阿尔采末病细胞模型的影响[J].中国药理学通报,2005, 24(7): 79-84.
[13] 许文芳,吴敏霞,谢捷明.冈田酸诱导SH-SY5Y细胞tau蛋白的过度磷酸化[J].福建医科大学学报,2006,40(4): 361-363.
[14] Song MJ, Dai XL, Jiang ZF. Tau protein phosphorylation and Alzheimer′s disease[J]. Chin Bull Life Sci, 2013,25(3): 315-319.
[15] Tanaka T, Iqbal K, T renkner E,etal. Abnomally phosphorylated tau in SY5Y human neuroblastoma cells[J]. FEBS Letters, 1995, 360(1): 5-9.
[16] Kayyali US,Zhang W,Yee AG,etal.Cytoskeletal change in the brains of mice lacking caleineurin A a [J]. J Neuroehem, 1997, 68(3): 1668-1678.
[17] 彭小松,陈晓春,黄俊山,等.人参皂苷Rg1对Aβ25-35诱导大鼠海马神经元tau蛋白异常磷酸化的影响[J].中国药理学通报,2005,21(3):299-305.
[18] 张静,黄天文,陈晓春,等.人参皂苷Rg1通过CDK5途径减轻Aβ25-35诱导的神经元tau蛋白磷酸化[J].福建医科大学学报,2008,42(1):9-11.
[19] 李玺,张欣,张智燕,等.人参皂苷Rg1对AD模型大鼠脑片P-Tau、PKA影响的实验研究[J].中国老年学杂志,2009,29(19):2468-2470.
Effects of ginsenoside Rg1 in rat brain slice model of Alzheimer′s disease induced by okadaic acid
LI Ming1, LI Xi1, QUAN Qiankun1,et al
(1.TheSecondAffiliatedHospital,Xi′anJiaotongUniversityCollegeofMedicine,Xi′an710004,China;2.DepartmentofLaboratoryMedicine,XijingHospital,TheForthMilitaryMedicalUniversity,Xi′an710032,China; 3.Xi′anNo. 5Hospital,Xi′an710083,China)
【Abstract】ObjectiveTo investigate the effect of ginsenoside Rg1 on the expressions of phosphorylated tau protein (P-tau) and protein phosphatase2B (PP2B) in rat brain slice model of Alzheimer’s disease (AD) induced by okadaic acid(OA) and explore the mechanism of gensenoside Rg1 in inhibiting tau phosphorylation.Methods400 μm thick brain slices cut from brains of 6-week-old SD rats were randomly divided into control, untreated, and low-dose, medium-dose and high-dose ginsenoside Rg1 group. Expressions of P-tau and PP2B proteins in brain slices were determined by immunohistochemical stain, western blot and the results were analyzed by image acquisition and analysis system.ResultsThe expression of P-tau protein was signifitly increased and the expression of PP2B protein was decreased in the untreated group. The expression of P-tau was signifitly decreased and the expression of PP2B protein was increased in the ginsenoside Rg1 groups. The expression of P-tau was less and the expression of PP2B protein was more in high-dose ginsenoside Rg1 group than the other ginsenoside Rg1 groups. The expression of P-tau was less and the expression of PP2B protein was more in medium-dose ginsenoside Rg1 group than low-dose ginsenoside Rg1 group.ConclusionGinsenoside Rg1 could inhibit tau phosphorylation by increasing protein phosphatase2B expression in rat brain slice model of Alzheimer′s disease.
【Key words】Gensenoside Rg1; Alzheimer’s disease; Phosphorylated tau protein; Protein phosphatase2B; Tau protein; SD rat
基金项目:陕西省科技攻关计划项目[2007K16-07(5)]; 陕西省中医药管理局基金项目(2005030)
通讯作者:李玺,博士,教授,硕士生导师,E-mail: lixi2100@sohu.com
【中图分类号】R-33;R 743
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.06.006
(收稿日期:2015-10-30; 修回日期: 2016-01-25; 编辑:母存培)
