吡格列酮通过抑制PKA表达抑制AD大鼠脑片模型海马神经元HVA钙通道电流*
2016-06-27权乾坤李玺袁海峰王娟王宁宁李明
权乾坤 李玺 袁海峰 王娟 王宁宁 李明
(1. 西安交通大学第二附属医院老年病科,陕西 西安 710004;2. 西安交通大学第二附属医院脑病科,陕西 西安 710004;3. 解放军第四军医大学西京医院检验中心,陕西 西安 710032)
·论著·
吡格列酮通过抑制PKA表达抑制AD大鼠脑片模型海马神经元HVA钙通道电流*
权乾坤1李玺1袁海峰2王娟3王宁宁1李明1
(1. 西安交通大学第二附属医院老年病科,陕西 西安 710004;2. 西安交通大学第二附属医院脑病科,陕西 西安 710004;3. 解放军第四军医大学西京医院检验中心,陕西 西安 710032)
【摘要】目的探讨PPARγ激动剂吡格列酮(pioglitazone, Pio)是否对Aβ致阿尔茨海默病(AD)大鼠脑片模型海马神经元高电压激活(high-voltage-activated,HVA)钙通道电流有抑制作用以及是否通过抑制蛋白激酶A(protein kinase A, PKA)表达途径而实现。方法采用Aβ25~35孵育大鼠脑片制备AD模型;采用全细胞膜片钳技术观察Pio干预后AD大鼠脑片模型海马神经元HVA钙通道在刺激电压下电流密度、Ⅰ~Ⅴ曲线、激活曲线及失活曲线的变化情况;采用免疫组织化学染色观察Pio干预后AD大鼠脑片模型PKA蛋白表达情况。结果Aβ孵育可以导致大鼠脑片海马神经元HVA钙通道电流增加,激活曲线半激活电压减低,斜率因子增大;失活曲线半失活电压增大,斜率因子减小。Pio干预后AD大鼠脑片模型海马神经元HVA钙通道在各激活电压下电流密度降低;激活曲线半激活电压增加,斜率因子减小,HVA钙通道激活对电压的敏感性降低,不易被激活;失活曲线半失活电压减小,斜率因子增大,HVA钙通道失活对电压的敏感性增加,更易失活;同时海马神经元PKA蛋白表达水平下降。结论Pio可能通过抑制PKA表达途径抑制AD大鼠脑片海马神经元HVA钙通道电流,从而减少细胞钙离子内流,降低细胞内钙离子水平,对抗Aβ的神经毒性。
【关键词】阿尔茨海默病(AD);PPARγ激动剂;高电压激活钙通道电流;蛋白激酶A
作为过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ, PPARγ)激动剂,噻唑烷二酮类药物(thiazolidinediones, TZDs)可以增加胰岛素敏感性,主要用于Ⅱ型糖尿病治疗。最近一些体内或体外研究还表明,TZDs对阿尔茨海默病(Alzheimer′s disease, AD)具有神经保护作用,如吡格列酮可以降低胰岛素抵抗大鼠模型脑内β淀粉样蛋白(beta-amyloid peptide, Aβ)水平[1];罗格列酮可以提高AD转基因小鼠的学习和记忆能力[2],并通过调节β分泌酶进而调节淀粉样前体蛋白(amyloid precursor protein, APP)的产生,影响Aβ形成[1,3,4];还可以通过增加低密度脂蛋白受体相关蛋白1(low density lipoprotein receptor-related protein 1, LRP1)的表达促进Aβ清除[5]。另外,有人给予AD患者每日4 mg罗格列酮口服,连用6个月后AD患者记忆能力明显改善[6]。然而目前关于TZDs对AD神经保护作用机制并不完全清楚。
神经元内钙离子平衡失调是AD的一个重要的病理改变,Aβ可以在细胞膜上形成新的离子通道或使细胞膜上原有的钙离子通道发生磷酸化,从而引起钙离子内流增加,导致钙超载,是形成AD发病的机制之一[7-9]。在Aβ导致的钙通道磷酸化及钙通道异常开放过程中,已有研究表明蛋白激酶A(protein kinase A, PKA)参与其中[10],引起细胞内钙离子水平异常。本实验拟探讨TZDs是否对Aβ致AD大鼠脑片模型海马神经元高电压激活(high-voltage-activated,HVA)钙通道电流有抑制作用以及是否通过抑制PKA表达途径而实现,现报告如下。
1材料和方法
1.1实验动物11天左右健康SD大鼠乳鼠(雌雄不分)购自西安交通大学医学院实验动物中心,动物生产许可证号:SCXK(陕)2007-001。实验中对动物的处理符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》,并得到西安交通大学第二附属医院伦理委员会批准。
1.2药物与试剂吡格列酮(pioglitazone, Pio)购自中国恒瑞医药股份有限公司;Aβ25~35(大鼠)购自美国Sigma-Aldrich 公司;多克隆兔抗大鼠PKA抗体、免疫组织化学染色试剂(SP法)及DAB显色试剂盒购自北京博奥森公司。
1.3AD脑片模型制备SD乳鼠经腹腔注射戊巴比妥钠麻醉后迅速断头,快速取出脑组织(<1 min),置于经混合气体(95 % O2+5 % CO2)饱和的0℃人工脑脊液中冷却30 s。使用震荡切片机对脑组织进行切片,切片厚度350 μm。整个切片过程<10 min。
1.4分组及给药干预将切好的脑片分为对照组、模型组和Pio组,每组14张脑片,分别按以下方案进行干预。对照组:ACSF(NaCl 126 mM,KCl 5 mM,MgSO4·7H2O 2 mM,CaCl22 mM,NaHCO325 mM,NaH2PO4·2H2O 1.5 mM,Glucose 10 mM,pH7.3~7.4);模型组:ACSF+Aβ25~35(10 μmM);Pio组:ACSF+Aβ25~35(10μmM)+Pio(10 μmM)[11],室温22℃~24℃,孵育时间2小时,孵育过程中持续通入混合气体(95% O2+5 % CO2)。干预结束后每组中7张脑片用于全细胞膜片钳记录,另外7张用于免疫组化染色。
1.5全细胞膜片钳记录干预结束后采用全细胞膜片钳记录各组大鼠脑片海马神经元HAV钙通道电流。为减少run down现象,本实验中以Ba2+代替Ca2+。玻璃微电极尖端阻抗4~8 MΩ。电极外液:TEA-Cl 140 mM,BaCl210 mM,CsCl 5 mM,MgCl21 mM, HEPES 10 mM, 用TEA-OH将pH值调至7.3~7.4。电极内液:CsCl 120 mM,MgCl23 mM,Na2ATP 5 mM,EGTA 10 mM,HEPES 5 mM,用CsOH将pH值调至7.3~7.4。先将电压钳制在-40mV(200 ms)使Na+通道充分失活,然后给予脉冲电压(-40 mV ~+40 mV,步阶5 mV,持续时间200 ms)刺激,记录相应电压下产生的电流。另外将电压钳制在-40mV(200 ms)使Na+通道充分失活后给予0 mV刺激电压(200 ms),记录最大激活电压下Ba2+电流。实验中通过加用钙通道阻滞剂CaCl2证实上述刺激方案得到的是钙通道电流。
1.6免疫组织化学染色将孵育后脑片取出,石蜡包埋后进行免疫组化染色,检测大鼠脑片PKA蛋白表达情况。标本切片后常规脱蜡,抗原热修复,正常山羊血清抗体封闭,加入兔抗大鼠PKA多克隆抗体(1∶ 750)4 ℃过夜,然后DAB显色剂显色,苏木素复染、脱水、透明、封片。采用图像处理与分析系统对切片进行灰度分析,蛋白表达水平越高,灰度值越小;反之,蛋白表达水平越低,灰度值越大。
1.7数据处理与分析采用Clampfit 10.0软件对数据进行采样后漏减、基线调整等处理,采用GraphPad Prism 5软件制作Ⅰ~Ⅴ曲线、激活曲线及失活曲线等;为消除差异,通道电流大小以电流密度表示,即电流大小与膜电容之比(pA/pF);激活曲线得到后采用Boltzmann方程:I/Imax= 1-1/{1+exp[(Vx-V1/2)/k]}进行拟合,失活曲线得到后采用Boltzmann方程:I/Imax = 1/{1+exp[(Vx-V1/2)/k]}进行拟合;各组间电流密度、半激活电压、半失活电压、斜率因子k值、PKA蛋白表达水平比较采用SPSS 16.0软件进行单因素方差分析,组间两两比较采用Post-hoc LSD-t检验,P<0.05为差异有统计学意义。
2结果
2.1Pio对AD大鼠脑片模型海马神经元HVA钙通Ⅰ~Ⅴ曲线及最大激活电位下Ba2+电流的影响由Ⅰ~Ⅴ曲线可以看出,在各刺激电压下,模型组大鼠脑片海马神经元HVA钙通道Ba2+电流密度较对照组增大(P<0.05);Pio组HVA钙通道Ba2+电流密度较模型组降低(P<0.05);3组间HVA钙通道Ⅰ~Ⅴ曲线形状、开始激活电压、反转电压、最大激活电压均无明显差异(均P>0.05),见图1A。最大激活电压下各组HVA钙通道Ba2+电流比较结果表明,大鼠脑片经Aβ孵育后海马神经元在最大激活电压下HVA钙通道Ba2+电流密度明显增加(模型组与对照组比较,P<0.05),Pio孵育可以降低最大激活电压下Ba2+电流密度(Pio组与模型组比较,P<0.05),见图1B。
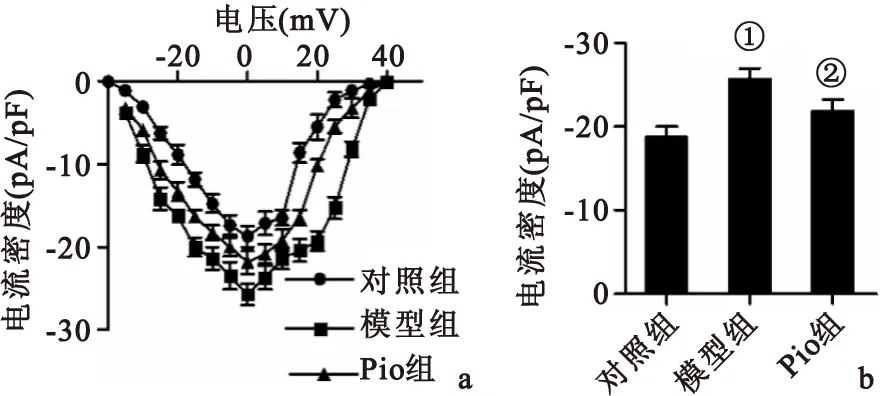
图1Pio干预后AD大鼠脑片模型海马神经元HVA钙通道在各刺激电压下IBa变化
Figure 1Ⅰ~Ⅴ curve of ICa, HVA and Peak ICa, HVA densities in hippocampal neurons in brain slices in different groups
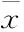
2.2Pio对AD大鼠脑片模型海马神经元HVA钙通道激活的影响激活曲线反应了离子通道开放的速度与难易程度。半激活电压V1/2反映了离子通道激活对电压的敏感性,激活曲线斜率因子k值反映了曲线上升的速率。对激活曲线拟合及分析后结果表明,模型组激活曲线较对照组左移,Pio组激活曲线虽位于对照组的左侧但较模型组右移,见图2A;模型组V1/2较对照组小(P<0.05),Pio组V1/2较模型组大(P<0.05),见图2B;与对照组比较,模型组k值较大(P<0.05),与模型组比较,Pio组k值较小(P<0.05),见图2C。这些结果表明Aβ增加了HVA钙通道激活对电压的敏感性,使通道更容易被激活,并且激活速率增快;而Pio可以有效地对抗Aβ这种作用,降低HVA钙通道对电压的敏感性,减慢激活速率。
2.3Pio对AD大鼠脑片模型海马神经元HVA钙通道失活的影响失活曲线反应了离子通道失活的速度与难易程度。半失活电压V1/2反映了离子通道失活对电压的敏感性,失活曲线斜率因子k值反应了曲线下降的速率。对失活曲线拟合后结果分析表明,模型组失活曲线较对照组明显右移,Pio组失活曲线较模型组左移,见图3A;与对照比较,模型组V1/2变大(P<0.05),k值变小(P<0.05);与模型组比较,Pio组V1/2变小(P<0.05),k值增大(P<0.05),见图3B、C。这些结果表明,Aβ降低了HVA钙通道失活对电压的敏感性而使通道不易失活,且失活速率减慢;Pio可以增加HVA钙通道失活对电压的敏感性而使通道更易失活,且失活速率增加。
2.4Pio对AD大鼠脑片模型PKA蛋白表达水平的影响因为PKA参与了Aβ导致的钙通道磷酸化及钙通道异常开放[10],从而引起细胞内钙离子水平增加。所以本实验观察了Pio干预后AD模型大鼠脑片PKA蛋白表达水平。免疫组化染色结果表明,与对照组比较,模型组大鼠脑片海马CA1区PKA蛋白表达水平增加(P<0.05);与模型组比较,Pio组大鼠脑片海马CA1区PKA蛋白表达水平下降(P<0.05),见图4。
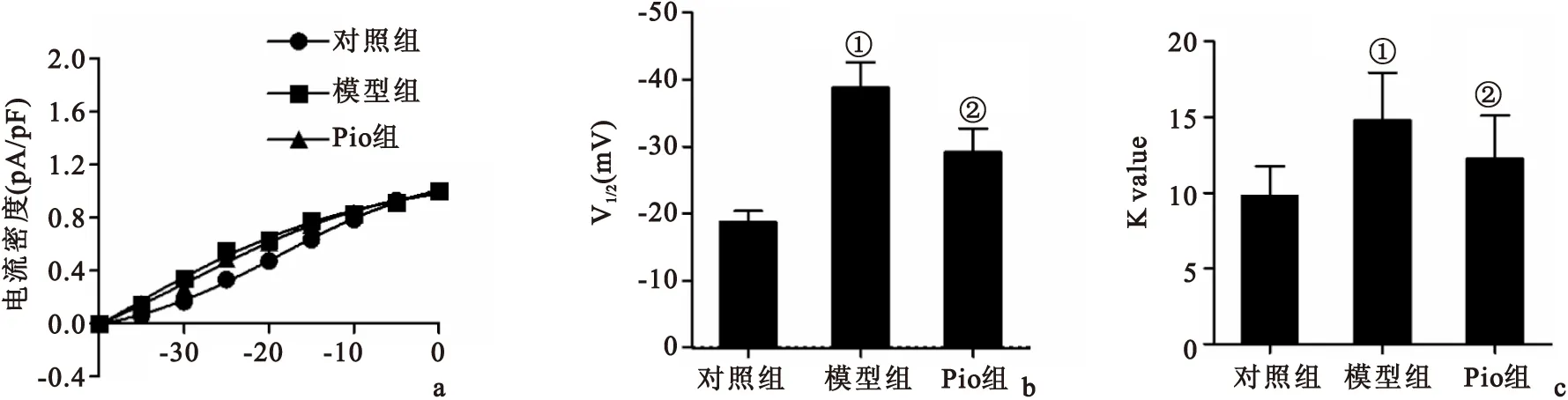
图2Pio干预后AD大鼠脑片模型海马神经元HVA钙通道激活变化
Figure 2Activation characteristics of HVA calcium channels in hippocampal neurons in brain slices in different groups
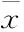
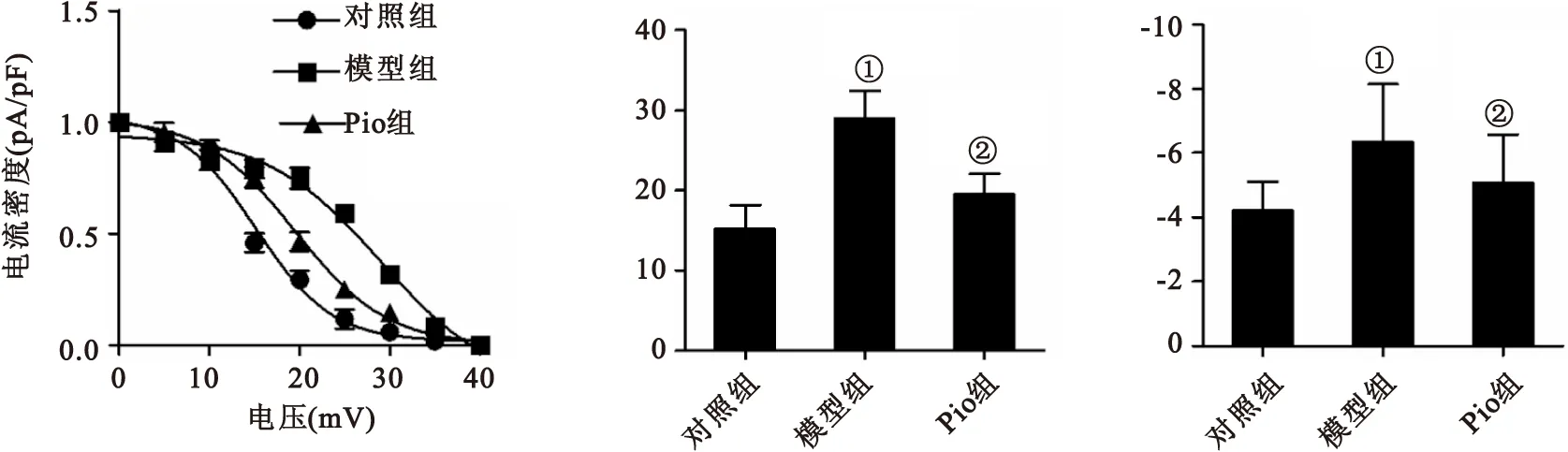
图3Pio干预后AD模型海马神经元HVA钙通道失活变化情况
Figure 3Inactivation characteristics of HVA calcium channels in hippocampal neurons in brain slices in different groups
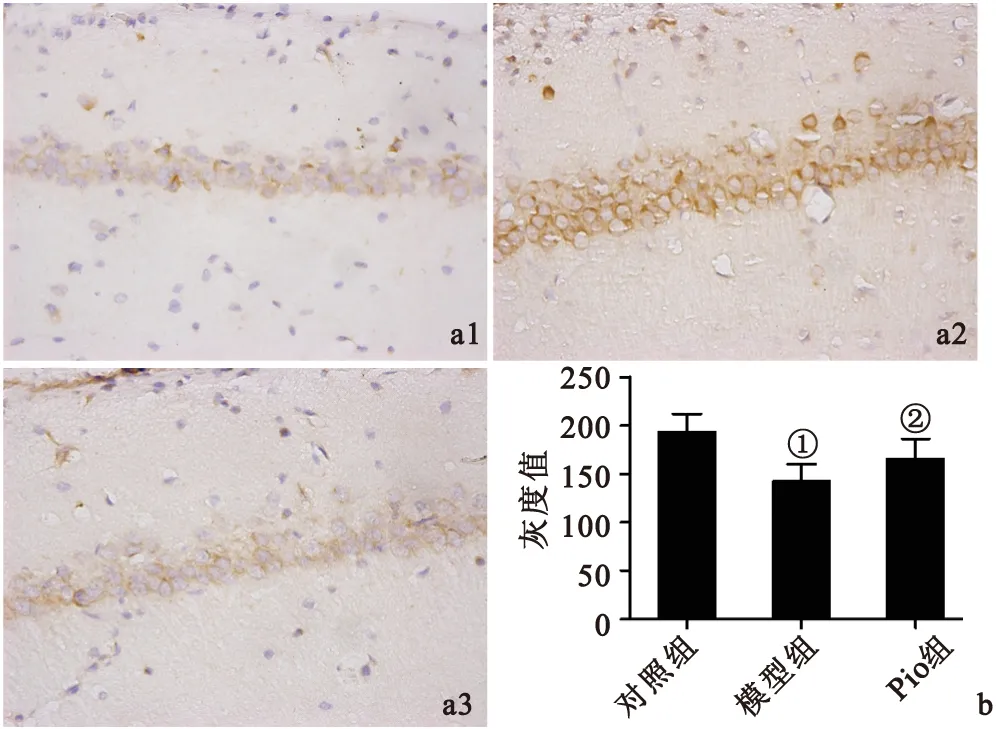
图4各组大鼠脑片海马CA1区PKA蛋白表达
Figure 4Expression of PKA in area CA1 of hippocampus in brain slices in different groups
3讨论
目前一些临床或实验研究将PPARγ激动剂TZDs用于AD治疗研究,并取得了一定进展,如降低AD动物模型脑内Aβ水平[1-5],改善AD患者或动物模型的学习记忆能力[2,6]等。PPARγ为配体激活的核转录因子,被配体激活后可以与靶基因启动子上特异性DNA反应元件(peroxisome proliferator responsive element,PPRE)结合,从而调控目的基因的表达[5],如PPARγ可以通过与Aβ起始生成关键酶β分泌酶1(β-amyloid cleavage enzyme 1, BACE1)启动子中PPRE结合从而抑制其表达,影响Aβ生成[4,12];PPARγ还可与Aβ降解酶--胰岛素降解酶(Insulin-degrading enzyme, IDE)启动子中PPRE结合调控IDE基因的转录,上调IDE蛋白表达[13],从而促进Aβ降解等。上述研究结果揭示了TZDs对AD神经保护作用的部分机制。
研究表明,细胞内钙离子超载是AD病理变化之一。细胞内钙离子水平紊乱可以对下游一系列的信号途径产生异常作用,包括神经元凋亡、突触结构超微结构损伤、突触可塑性改变、神经元代谢异常、酶系统的激活、信息传递异常等[14-16],与AD老年斑形成、早老素突变、tau缠结和突触功能障碍相关[17]。钙离子稳态失衡还可以影响胆碱能系统紊乱,影响学习记忆功能[17]。研究表明,AD神经元内钙离子异常与AD核心病理产物Aβ也密切相关,Aβ可以通过MAPK途径促进培养的皮层神经元L型钙离子通道的磷酸化,从而导致L型钙离子通道激活,钙离子的内流增加[18];Aβ还可在神经元细胞膜上形成新的通道,从而促进钙离子的内流[7-9]。另外,也有实验证实PKA抑制剂H-89可以抑制Aβ对神经元HVA钙通道电流的增加作用[10],这表明PKA也参与了Aβ对神经元HVA钙通道开放的促进作用。PKA是细胞内信号转导过程中关键的物质,由两个调节亚单位和两个催化亚单位组成,当PKA被激活后,调节亚单位与催化亚单位分离,游离的催化亚单位在Mg2+和ATP的参与下,使通道蛋白丝氨酸和苏氨酸磷酸化[19],改变蛋白质的构象和功能,最终控制通道的开关[20,21]。
本实验证实,Pio可以抑制Aβ致AD大鼠脑片模型中海马神经元HVA钙通道介导的电流,降低通道激活对电压的敏感性,增加通道失活对电压的敏感性,从而降低细胞内钙离子水平。鉴于已有实验证实PKA参与了Aβ对神经元HVA钙通道的开放作用,本实验观察了Pio干预后AD大鼠脑片模型中PKA的表达情况,结果证实PKA蛋白表达水平降低,这表明Pio可能通过抑制PKA表达途径抑制Aβ致AD大鼠脑片模型海马神经元 HVA钙通道开放。但是关于Pio是如何影响PKA蛋白表达还需要进一步证实。
钙离子通道分为电压门控钙离子通道(voltage-gated Ca2+channel, VGCC)、受体依赖性钙离子通道、第二信使激活的钙离子通道、机械性钙离子通道等,其中研究最多的是VGCC。VGCC根据对电压的依赖性分为高电压激活(HVA)钙通道和低电压激活(LVA)钙通道。HVA钙通道包括L型、N型、P型、Q型等亚型,LVA钙通道主要为T型钙通道。本实验中仅观察了Aβ及Pio对HVA钙通道电流的影响,未进一步观察对各亚型的影响,未来可进行此方面的研究。
4结论
本研究证实,Pio可以通过抑制PKA表达途径抑制Aβ所致AD大鼠脑片模型中海马神经元HVA钙通道电流,降低HVA钙通道激活对电压的敏感性,使通道不易激活,增加通道失活对电压的敏感性,使离子通道容易失活,从而减少细胞内钙离子内流,对抗Aβ神经毒性。
【参考文献】
[1]Luo DZ, Hou XY, Hou L,etal. Effect of pioglitazone on altered expression of A beta metabolism-associated molecules in the brain of fructose-drinking rats, a rodent model of insulin resistance [J]. European Journal of Pharmacology, 2011, 664(1~3): 14-19.
[2]Escribano L, Simon AM, Gimeno E,etal. Rosiglitazone rescues memory Impairment in Alzheimer′s transgenic mice: mechanisms involving a reduced amyloid and tau pathology [J]. Neuropsychopharmacology, 2010, 35(7): 1593-1604.
[3]Heneka MT, Sastre M, Dumitrescu-Ozimek L,etal. Acute treatment with the PPAR gamma agonist pioglitazone and ibuprofen reduces glial inflammation and A beta 1-42 levels in APPV717I transgenic mice [J]. Brain, 2005, 128: 1442-1453.
[4]Sastre M, Dewachter I, Landreth GE,etal. Nonsteroidal anti-inflammatory drugs and peroxisome proliferator-activated receptor-gamma agonists modulate immunostimulated processing of amyloid precursor protein through regulation of beta-secretase [J]. Journal of Neuroscience, 2003, 23(30): 9796-9804.
[5]Moon JH, Kim HJ, Yang AH,etal. The effect of rosiglitazone on LRP1 expression and amyloid beta uptake in human brain microvascular endothelial cells: a possible role of a low-dose thiazolidinedione for dementia treatment [J]. International Journal of Neuropsychopharmacology, 2012, 15(1): 135-142.
[6]Watson GS, Craft S. The role of insulin resistance in the pathogenesis of Alzheimer′s disease - Implications for treatment [J]. CNS Drugs, 2003, 17(1): 27-45.
[7]Dante S, Hauss T, Dencher NA. beta-amyloid 25 to 35 is intercalated in anionic and zwitterionic lipid membranes to different extents [J]. Biophysical Journal, 2002, 83(5): 2610-2616.
[8]Qi JS, Qiao JT. Amyloid beta-protein fragment 31-35 forms ion channels in membrane patches excised from rat hippocampal neurons [J]. Neuroscience, 2001, 105(4): 845-852.
[9]Arvanitakis Z, Wilson RS, Bienias JL,etal. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function [J]. Archives of Neurology, 2004, 61(5): 661-666.
[10] Jurgen H, Lei C, ChangJin LIU,etal. Action of beta-amyloid peptide1-40 on IHVA and its modulation by ginkgolide B [J]. Acta Physiologica Sinica, 2006, 58(1): 14-20.
[11] 金英, 张智娟, 刘婉珠, 等. 吡格列酮对淀粉样β蛋白片段25-35致大脑皮质神经元损伤的保护作用[J]. 中国药理学与毒理学杂志, 2011,(1): 34-39.
[12] Selkoe DJ. Alzheimer′s disease: Genes, proteins, and therapy[J]. Physiological Reviews, 2001, 81(2): 741-766.
[13] Du J, Zhang L, Liu SB,etal. PPAR gamma transcriptionally regulates the expression of insulin-degrading enzyme in primary neurons [J]. Biochemical and Biophysical Research Communications, 2009, 383(4): 485-490.
[14] 江红, 罗易宁, 史庭慧. 尼莫地平对阿尔茨海默病患者认知功能的影响[J]. 药物流行病学杂志, 2007,(6):846-849.
[15] Lin H, Bhatia R, Lal R. Amyloid beta protein forms ion channels: implications for Alzheimer′s disease pathophysiology [J]. Faseb Journal, 2002, 16(7):2433-2444.
[16] 徐晓虹. 钙离子对学习记忆的影响[J]. 浙江师范大学学报(自然科学版), 2002,(4):398-402.
[17] 林如意, 邓天翔, 张俊芳, 等. Ca2+失调与阿尔茨海默病发生发展关系的研究进展[J]. 生命科学, 2012,(3): 297-303.
[18] Ekinci FJ, Malik KU, Shea TB. Activation of the L voltage-sensitive calcium channel by mitogen-activated protein(MAP) kinase following exposure of neuronal cells to beta-amyloid - Map kinase mediates beta-amyloid-induced neurodegeneration [J]. Journal of Biological Chemistry, 1999, 274(42): 30322-30327.
[19] Kamp TJ, Hell JW. Regulation of cardiac L-type calcium channels by protein kinase A and protein kinase C [J]. Circulation Research, 2000, 87(12): 1095-1102.
[20] Hosey MM, Chien AJ, Puri TS. Structure and regulation of L-type calcium channels - A current assessment of the properties and roles of channel subunits [J]. Trends in Cardiovascular Medicine, 1996, 6(8): 265-273.
[21] McDonald TF, Pelzer S, Trautwein W,etal. Regulation and modulation of calcium channels in cardiac, skeletal, and smooth-muscle cells [J]. Physiological Reviews, 1994, 74(2): 365-507.
Pioglitazone inhibits HVA calcium channel currents via PKA in hippocampal neurons in rat brain slice model of AD
QUAN Qiankun, LI Xi, YUAN Haifeng,et al
(1.DepartmentofGeriatrics,TheSecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China; 2.DepartmentofEncephalopathy,TheSecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004,China; 3.ExaminationCenter,XijingHospital,TheFourthMedicalUniversityofPLA,Xi’an700032,China)
【Abstract】ObjectiveTo examine whether PPARγ agonist pioglitazone inhibits the high-voltage-activated calcium currents (ICa,HVA) via protein kinase A (PKA) in hippocampal neurons in rat brain slice model of AD. MethodsAn experimental Alzheimer disease (AD) model was prepared by exposure of rat brain slices to Aβ25-35. After treatment with pioglitazone, the ICa, HVA elicited in hippocampal neurons in these rat brain slices was recorded by whole-cell patch clamp to analyze the changes in the peak current density, Ⅰ~Ⅴ curve, activation-V curve, and inactivation-V curve. The expression of PKA protein in these slices was detected by immunohistochemistry staining. ResultsExposure of rat brain slices to Aβ led to increase in ICa, HVA, enhance the voltage sensitivity of channel activation, reduce the voltage sensitivity of channel inactivation and increase PKA protein level in hippocampal neurons in rat brain slice model of AD. Pioglitazone treatment significantly inhibited these changes. ConclusionPioglitazone can inhibit HVA calcium channel currents via PKA in hippocampal neurons in rat brain slice model of AD.
【Key words】Alzheimer disease; PPARγ agonist; High-voltage-activated calcium current; Protein kinase A
基金项目:陕西省科技攻关计划项目[2007K16-07(5)]; 西安交通大学第二附属医院院重点基金项目[YJ(ZD)201517]
通讯作者:李玺,教授,硕士生导师,研究方向:阿尔茨海默病临床与基础研究,E-mail: lixi2100@163.com
【中图分类号】R-33
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.06.009
(收稿日期:2016-01-15; 编辑: 母存培)
