地塞米松对哮喘小鼠CD4+ CD25+调节性T细胞及IL-4 TGF-β水平的影响*
2016-06-27马祥刘洪李群英梁宗安
马祥 刘洪 李群英 梁宗安
(1.成都市第一人民医院呼吸内科,四川 成都 610041;2.四川大学华西医院呼吸内科, 四川 成都 610041)
·论著·
地塞米松对哮喘小鼠CD4+CD25+调节性T细胞及IL-4 TGF-β水平的影响*
马祥1刘洪1李群英1梁宗安2
(1.成都市第一人民医院呼吸内科,四川 成都 610041;2.四川大学华西医院呼吸内科, 四川 成都 610041)
【摘要】目的探讨地塞米松对哮喘小鼠CD4+、CD25+调节性T细胞( regulatory T cells,Treg) 及IL-4、TGF-β水平的影响。方法30只雄性BALB/c小鼠随机分为正常对照组、哮喘组及地塞米松组3组各10只;利用鸡卵白蛋白腹腔注射、雾化吸入制备哮喘模型;使用流式细胞仪分别检测各组小鼠脾脏单个核细胞CD4+、CD25+Treg细胞占CD4+T细胞的百分比;使用Western Blot方法分析IL-4在小鼠肺组织中的表达情况;使用酶联免疫吸附试验方法检测各组小鼠血清中TGF-β的水平。结果哮喘组小鼠脾单个核细胞CD4+、CD25+Treg细胞百分比及TGF-β水平较正常对照组降低(均P<0.05),哮喘组IL-4水平较正常对照组增高(P<0.05),地塞米松组与正常对照组比较,差异无统计学意义(P>0.05)。 结论哮喘小鼠CD4+、CD25+Treg数量的减少,功能的下降,可能参与了哮喘的发病过程,地塞米松可能通过上调CD4+、CD25+Treg比例,调节T细胞亚群失衡来发挥抗炎作用。
【关键词】哮喘; CD4+、CD25+、调节性 T 细胞; IL-4; TGF-β; 小鼠
支气管哮喘是一种以慢性气道炎性为特点的变态反应性疾病,其发病过程由多种炎性细胞参与。目前研究认为,Th2细胞表达过度所致的Th1/Th2细胞失衡是哮喘发病的免疫学基础[1],机体的免疫功能紊乱导致炎性损伤,这类炎性损伤反复进行、发生,在哮喘的发病机制中发挥重要作用。近年来,随着关于哮喘发病机制的深入研究,研究者们发现,哮喘的临床表现和治疗反应并不能完全用Th1/Th2 平衡理论来解释。调节性T 细胞( regulatory T cell,Treg细胞) 是CD4+T细胞的一组亚型,主要对免疫功能起负调节作用,从而加强免疫耐受,以维持内环境的稳定。CD4+、CD25+Treg是CD4+调节性T细胞的一种类型,构成了大多数的Treg细胞群。研究显示,CD4+、CD25+Treg可能参与了哮喘的发病过程,关于其如何参与、介导哮喘的发生,是目前研究的热点。有研究认为,分泌抑制性细胞因子TGF-β、抑制Th2 细胞活化、抑制Th2类细胞因子的产生可能是CD4+、CD25+Treg抑制哮喘发生的主要方式[2]。本研究以哮喘小鼠为对象,分析哮喘小鼠体内CD4+、CD25+Treg、Th2类细胞因子IL-4、TGF-β的表达情况及地塞米松干预对其的影响。
1材料与方法
1.1实验动物健康雄性BALB/c小鼠(体重20g左右,8周龄,清洁级2级,四川大学华西临床医学院动物实验中心提供)30只,随机分成正常对照组、哮喘组及地塞米松组3组,每组分别10只。
1.2仪器与试剂主要实验仪器:低温高速离心机(德国Heraeus公司);超声雾化器(德国Boehringger Ingelhei);蛋白浓度分析仪(美国BIO-RAD公司);CYTOMICS- FC500流式细胞仪(美国 BACK MAN COULTER 公司)。主要实验试剂:鸡卵蛋白(美国 Sigma 公司); 氢氧化铝(天津三厂); 小鼠淋巴细胞分离液(天津TDB生物技术发展中心);Anti-Mouse CD4 PE-Cy5、Anti-Mouse CD25 PE及相应同型对照(美国eBioscience公司);山羊抗兔IgG(购于北京中杉金桥生物公司);兔抗大鼠IgG(武汉博士德生物工程有限公司)。
1.3动物模型制备 参照J.C. Kips[4]和Matthew E等[5]提出的方法并适当调整来制备哮喘模型。正常对照组:分别在第1、8、14天腹腔注射生理盐水0.5ml,第15天开始将小鼠置于密闭空间内,雾化吸入生理盐水,1天1次,1次30分钟,连续7天;哮喘组:分别在第1、8、14天腹腔注射预先制备的抗原液0.5 ml(含20μg 卵白蛋白、2.25 mg 氢氧化铝)以致敏,第15天开始将小鼠置于密闭空间内,予1%卵白蛋白(OVA)雾化吸入激发,连续7天。地塞米松组:同样使用腹腔注射抗原液使小鼠致敏,但在雾化吸入卵白蛋白前30分钟腹腔注射地塞米松(2.5mg/kg)。
1.4分离脾单个核细胞在最后一次激发结束后,通过引颈的方式处死小鼠,取出脾脏,将其剪成多个小块,放在细胞筛上进行研磨、过滤,制备脾单个核细胞悬液,并调节细胞浓度为106个细胞/ml,最后使用流式细胞仪检测各组CD4+、CD25+Treg占CD4+T细胞的百分率。
1.5肺病理切片的制备取出小鼠的左肺,使用10%中性甲醛固定24小时后,再进行常规脱水、透明、浸蜡、包埋、切片,在HE染色后使用显微镜观察各组小鼠肺组织形态、结构。
1.6Western Blot分析肺组织IL-4的表达采用Western Blot方法分析IL-4在小鼠肺组织中的表达及分布情况,蛋白条带的灰度使用Quantity One软件测定。
1.7血清TGF-β水平测定采用ELISA双抗体夹心法测定TGF-β,按照试剂盒操作说明书进行检测。
2结果
2.1各组小鼠肺组织病理检测结果正常对照组:小鼠肺组织支气管粘膜上皮、肌层完好,周围无炎性细胞浸润,支气管管腔规则,形态基本正常(图1);哮喘组:在小鼠肺组织血管及气管周围,有大量淋巴细胞、嗜酸性细胞等炎性细胞浸润,粘膜上皮存在不同程度的坏死、脱落(图2)。
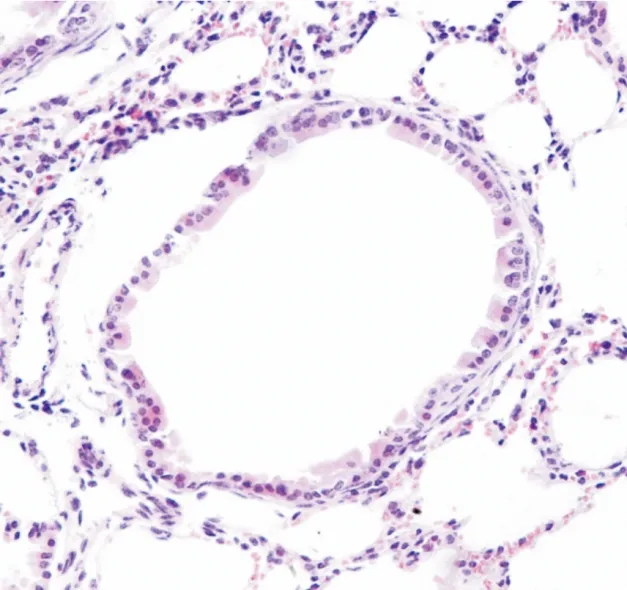
图1正常对照组肺组织病理切片 HE× 400
Figure 1Pathological section of lung tissue in Normal control group,HE× 400

图2哮喘组肺组织病理切片 HE×400
Figure 2Pathological section of lung tissue in asthma group HE× 400
2.2各组小鼠脾单个核细胞CD4+、CD25+Treg百分率比较哮喘组小鼠脾单个核细CD4+、CD25+Treg百分率较正常对照组、地塞米松组降低(均P<0.05);地塞米松组CD4+、CD25+Treg百分率较哮喘组升高(均P<0.05);地塞米松组CD4+、CD25+Treg百分率低于正常对照组,但组间差异无统计学意义(P>0.05,表1)。
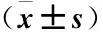
Table 1The percentage of CD4+and CD25+Treg in spleen mononuclear cells of mice

组别nCD4+、CD25+/CD4+(×10-2)正常对照组105.16±0.38①哮喘组102.06±0.52地塞米松组104.98±0.67①②
注:与哮喘组比较 ①P<0.05;与正常对照组比较, ②P>0.05
2.3Western Blot分析各组小鼠肺组织IL-4表达情况哮喘组小鼠IL-4表达强于正常对照组及地塞米松组(P<0.05),正常对照组与地塞米松组之间差异无统计学意义(P>0.05,表2,图3)。
表2 各组小鼠肺组织IL-4表达情况比较±s)
注:与哮喘组比较,①P<0.05
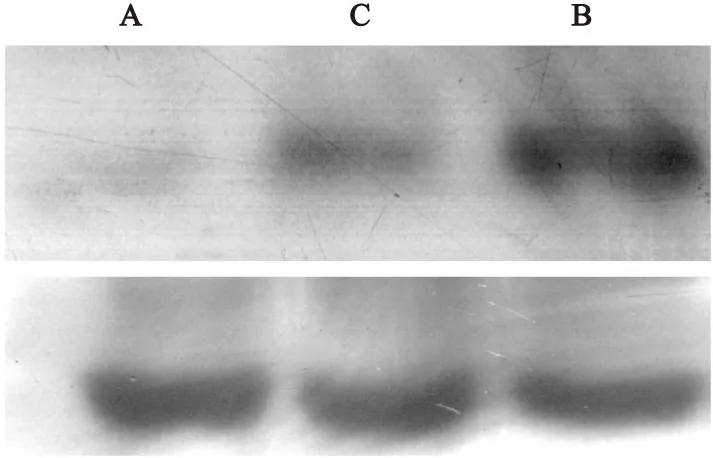
图3IL-4及β-actin的蛋白表达情况
Figure 3Expression of IL-4 and β-actin protein
注:A.正常对照组;B.哮喘组;C.地塞米松组
2.4血清TGF-β水平情况哮喘组TGF-β水平较正常对照组、地塞米松组减少(均P<0.05);地塞米松组TGF-β水平较正常对照组稍低,但组间差异无统计学意义(P>0.05)。
2.5相关性分析CD4+、CD25+/CD4+与血清TGF-β水平呈明显正相关(r为0.526,P<0.05);CD4+、CD25+/CD4+与IL-4水平呈负相关(r为-0.258,P<0.05);IL-4水平与TGF-β呈负相关(r为-0.316,P<0.05)。
3讨论
CD4+辅助性 T细胞(CD4 helper cells,Th)在机体适应性免疫应答中发挥着至关重要的作用,它是机体T细胞的重要功能群体。Th细胞分为Th1和Th2细胞两大类。Th1 细胞主要介导细胞免疫,分泌INF-γ、TNF-β和IL-2等细胞因子。Th2细胞可以分泌IL-4、IL-5、IL-13等细胞因子,诱导嗜酸性粒细胞募集和激活,并促进黏液的大量分泌、气道高反应( airway hyperreactivity,AHR),从而促使炎症发生发展。研究表明,Th1 细胞和 Th2 细胞都是重要的效应细胞,同时二者又相互抑制[5]。在关于哮喘的发病机制研究中,多年来的研究认为,在哮喘的发病过程中,Th1/Th2 功能失调扮演着重要角色。研究显示,在哮喘患者体内存在Th细胞亚群之间的失衡状态,表现为在哮喘急性发作期患者,其外周血中Th1 细胞数量显著降低,而同时Th2细胞数量显著增高,Th1/ Th2 比值明显下降。Th2细胞在哮喘发生中发挥重要作用,与其产生的细胞因子IL-4是密不可分的[6]。IL-4主要由Th2细胞产生,能刺激和活化B细胞,因此又称为B细胞刺激因子。IL-4 是具有多种功能的、强大的炎性介质,它在机体免疫反应中起着非常重要的作用。临床研究显示,IL-4对哮喘具有正向调节作用,可导致呼吸道炎症的发生,在儿童哮喘的发生中发挥重要作用。在本研究中,哮喘组小鼠肺组织中IL-4表达水平较正常对照组显著增加,该结果与国内外大多数研究结果相一致,支持在哮喘的发生过程中存在着Th2类细胞的增多、IL-4细胞因子的过度表达,从而促进炎症的发生。在糖皮质激素与IL-4的相关性研究中,研究发现糖皮质激素能降低外周T的活化及IL-4的表达[7];也有人认为糖皮质激素对IL-4的表达没有影响,甚至出现IL-4表达的增加[8]。在本研究中,地塞米松干预后的小鼠IL-4水平较哮喘组明显降低,提示地塞米松可能抑制Th2类细胞及其细胞因子的产生,从而实现抗炎的作用。
尽管多数研究认为,Th2细胞的增多、比例占优势与哮喘发生密切相关,但是也有研究显示,Th1 型免疫反应同样能诱导、加重哮喘,一些以Th2细胞反应为主的感染也并没有加重过敏性炎症,甚至呈现相反的作用。因此,研究者们推测,Th1/Th2 细胞失衡可能只是哮喘的表面现象,在其发生、发展的过程中可能还有其他机制参与进来。有研究发现,其它的CD4+T细胞(包括 Th1 细胞、Th17 细胞和调节性T细胞等)及其细胞因子,在哮喘发病中也发挥了重要作用。
Treg是一类以免疫无能性、免疫抑制性为主要特征[9]的T细胞亚群。Treg细胞对高水平的IL-2 单独刺激无反应,也不分泌IL-2,对抗CD3单抗、抗CD3 单抗和抗CD28 单抗的联合作用也呈现无应答的状态,表现为免疫无能性。同时CD4+、CD25+Treg一旦被激活以后,它可以抑制CD4+、CD25+T、CD8+T、Th1、Th2等细胞的增殖与活化,这种现象被定义为免疫抑制性。Treg细胞的免疫抑制活性是非特异性的,可通过多种方式实现:通过细胞之间直接接触产生抑制;通过分泌IL-10、TGF-β对局部免疫反应产生抑制。目前研究认为,Treg细胞能发挥其免疫抑制功能,与细胞因子IL-2、IL-10、TGF-β的产生密不可分;一方面,Treg细胞会分泌IL-10、TGF-β细胞因子,这些细胞因子是抑制性细胞因子,能帮助Treg细胞发挥其抑制功能;另一方面,Treg细胞的扩增、免疫抑制功能发挥,与TGF-β信号密切相关。有研究显示,如果用抗IL-10、抗TGF-β单抗去封闭IL-10、TGF-β,那么CD4+、CD25+Treg细胞的抑制功能将会明显降低[10]。
一些动物实验及临床研究显示,在一些严重的超敏反应、自身免疫疾病,如哮喘、过敏反应等[11],CD4+、CD25+Treg细胞数量的变化、功能的异常常常会参与其中,并且可能是导致疾病发生的重要原因。有研究表明[12],哮喘患者的支气管肺泡灌洗液、外周血单核细胞中,CD4+、CD25+Treg的比率明显低于对照组,从而认为,哮喘患者Treg受损。然而也有研究表示,哮喘等过敏性疾病患者体内CD4+、CD25+Treg的数量正常,甚至显著增加,但是这些Treg不能发挥其免疫抑制功能,存在功能缺陷。近年来的研究也发现,Treg可能会抑制Th2 反应,实现维持气道内的免疫耐受[13]。Taylor等[14]推测 Treg 细胞可能通过分泌IL-10及TGF-β,抑制 Th2 细胞产生IL- 4、IL-5和IL-13,抑制嗜酸性粒细胞、嗜碱性粒细胞以及肥大细胞的致炎作用,从而实现其免疫抑制性,抑制变态反应性疾病的发生、发展。随着对哮喘发病机制的深入研究,Treg 细胞和Th2细胞二者的关系成为了研究者们关注的热点。近年来有研究者发现,在哮喘发病过程中,可能存在着Treg/Th2比例失衡的机制[15,16]。一方面,在炎症反应中,Treg 细胞可以转化为Th2促炎症细胞;另一方面,在过敏性炎症中,大量活化增殖的Th2 细胞,竞争性地与IL-2结合,使得Treg 细胞不能与IL-2有效结合,从而诱导Treg 细胞的凋亡[17]。 在本研究中,哮喘组小鼠CD4+、CD25+Treg占CD4+百分率及TGF-β明显降低,提示哮喘组小鼠体内CD4+、CD25+Treg数量及其分泌的细胞因子减少,同时TGF-β的减少可能会减弱CD4+、CD25+Treg对Th2细胞抑制作用的减弱,致Th2类细胞因子IL-4表达的明显增加,导致Treg/Th2 比例失衡,从而促进炎症的发生,导致哮喘的发作。而地塞米松干预后,CD4+、CD25+Treg百分率及TGF-β增加、IL-4表达降低,促进Treg/Th2平衡,减轻炎症,提示地塞米松可能通过上调调节性T细胞、促进Treg/Th2平衡以实现其强大的抗炎作用。
4结论
哮喘小鼠CD4+、CD25+Treg数量及相关细胞因子TGF-β水平明显降低,TH2类细胞因子IL-4水平明显升高,提示CD4+、CD25+Treg及Treg/Th2可能参与了哮喘的发生、发展过程;地塞米松可能通过调节哮喘患者体内CD4+、CD25+Treg数量及调节Treg/Th2平衡发挥抗炎作用。但是CD4+、CD25+Treg介导哮喘发生的具体机制还需要进一步研究。随着对哮喘发病机制的深入研究,相信会有更多的细胞群和细胞因子被揭示,这将为哮喘的预防及治疗提供新的方向。
【参考文献】
[1]Larché M,Robinson DS,Kay AB. The role of T lymphocytes in the pathogenesis of asthm[J].Allergy Clin Immunol,2003,111( 3) : 450-464.
[2]Lloyd CM,Hawrylowicz CM. Regulatory T cells in asthma[J] . Immunity,2009,31( 3) : 438-449.
[3]Kips JC, Tournoy KG, Pauwels RA. New anti-asthma therapies: suppression of the effect of interleukin(IL)-4 and IL-5[J]. Eur Respir J, 2001, 17: 499-506.
[4]Matthew EP, Charles GI, Yvonne MW. Janssen-Heininger Rapid Activation of Nuclear Factor-κB in Airway Epithelium in a Murine Model of Allergic Airway Inflammation[J]. American Journal of Pathology, 2002, 160: 1325-1334.
[5]Van Oosterhout AJM, Motta AC. Th1/ Th2 paradigm:not seeing the forest for the trees[J]. Eur Respir J, 2005, 25 :591-593.
[6]Sang-Heon Cho, Luminita AS, Stephen TH,etal. Increased Interleukin-4, Interleukin-5, and Interferon- γ in Airway CD4+and CD8+T Cells in Atopic Asthma[J]. American Journal of Respiratory and Critical Care Medicine,2005,171: 224-230.
[7]Wu Z, Macphee IA, Oliveira DB. Reactive oxygen species in the initiation of IL-4 driven autoimmunity as a potential therapeutic target[J]. Curr Pharm Des, 2004, 10(8) :899-913.
[8]A Sahid El-Radhi, Claire L Hogg,etal. Effect of oral glucocorticoid treatment on serum inflammatory markers in acute asthma[J]. Arch Dis Child, 2000, 83:158-162.
[9]McGuik P,Higgins SC,Mills KH. The role of regulatory T cells in respiratory infections and allergy and asthma[J].Curr Allergy Asthma Rep,2010,10( 1):21-28.
[10] Langier S,Sade K,Kivity S. Regulatory T cells in allergic asthma [ J] . Isr Med Assoc J,2012, 14( 3) :180-183.
[11] Lin W, Truong N, Grossma WJ,etal. Allergic dysregulation and hyperimmunoglobulinemia E in Foxp3 mutant mice[J]. J Allergy Clin Immunol, 2005,116(5):1106-1115.
[12] Y Zu, CR Li, YJ Zheng,etal. The role of CD4+CD25+regulatory T cells in the pathogenesis of asthma in children. Zhonghua Yi Xue Za Zhi, 2006, 86(1):35-38.
[13] Choi IS. Immune tolerance by induced regulatory T cells in asthma [J] . Allergy Asthma Immunol Res,2012,4(3):113-115.
[14] Taylor PA,Noelle RJ,Blazar BR. CD4+CD25+immune regulatory Tcells are required for induction of tolerance to alloantigen via costimulatory blockade[J] . J Exp Med,2001,193( 11) : 1311-1318.
[15] Chapoval S,Dasgupta P,Dorsey NJ,etal. Regulation of the T helper cell type 2( Th2) /T regulatory cell( Treg) balance by IL-4 and STAT6[J].J Leukoc Biol,2010,87( 6) : 1011-1018.
[16] Hadeiba H, Locksley RM. Lung CD4+CD25+regulatory T cells suppress type 2 immune responses but not bronchial hyperreactivity[J] . J Immunol, 2003, 170(6):5502-5510.
[17] Pandiyan P,Zheng L,Ishihara S,etal. CD4+CD25+Foxp3+regulatory T cells induce cytokine deprivation mediated apoptosis of effector CD4+T cells[J] . Nat Immunol,2007,8( 12) : 1353-1362.
Effect of dexamethasone on CD4+CD25+regulatory T cells and the expression of IL-4 and TGF-βin asthmatic mice
MA Xiang1,LIU Hong1,LI Qun ying1,et al
(1.DepartmentofRespiratory,TheFirstPeople′sHospitalofChengdu,Chengdu610041,China; 2.DepartmentofRespiratorydiseases,WestChinaHospital,SichuanUniversity,Chengdu610041,China)
【Abstract】ObjectiveTo discuss the effect of dexamethasone on CD4+CD25+ regulatory T cells(Treg) and the expression of IL-4 and TGF-βin asthmatic mice. MethodsThirty male BALB/c mice were randomly assigned to the control group,the asthma group and the dexamethasone group.Tissues of left lung were obtained from mice to observe pathological changes.Flow cytometry was used to detect the percentage of CD4+CD25+Treg in CD4+T cells.The expression of IL-4 from lungs were detected by Western Blot. The levels of serum TGF-β were detected by ELISA. ResultsThe percentage of CD4+CD25+Treg and TGF-β in asthma group decreased significantly(P<0.05) .The expression of IL-4 in asthma group increased significantly(P<0.05). Difference was not significant be-tween the control group and the dexamethasone group(P>0.05) . ConclusionThe number of CD4+CD25+Treg in asthmatic mice reduced and the function also declined. They are involved in the pathogenesis of asthma. Dexamethasone may had anti-inflammatory effect through the up regulation of CD4+CD25+Treg and regulatory T cell subsets imbalance.
【Key words】Asthma; CD4+CD25+regulatory T cells; IL-4; TGF-β; Mice
基金项目:国家自然科学基金(30871119)
【中图分类号】R-33
【文献标志码】A
doi:10.3969/j.issn.1672-3511.2016.07.
(收稿日期:2015-12-02; 编辑: 母存培)
