HPLC法测定贝那普利氢氯噻嗪片的有关物质
2016-03-16杜小英马东卫宋愿智陕西方舟制药有限公司西安70075陕西省食品药品检验所西安70065
杜小英,马东卫,宋愿智(.陕西方舟制药有限公司,西安 70075;.陕西省食品药品检验所,西安 70065)
HPLC法测定贝那普利氢氯噻嗪片的有关物质
杜小英1,马东卫1,宋愿智2(1.陕西方舟制药有限公司,西安 710075;2.陕西省食品药品检验所,西安 710065)
摘要:目的建立高效液相色谱法测定贝那普利氢氯噻嗪片的有关物质。方法采用Ultimate AQ-C18色谱柱(250 mm×4.60 mm,5 μm);流动相:四氢呋喃-水-冰醋酸(250 mL+750 mL+4 mL,加入四丁基溴化铵1.0 g);流速:1.5 mL·min-1;检测波长:240和316 nm。结果杂质CGS14831的线性范围为3.74~28.08 μg·mL-1,相关系数r=0.999 6;杂质CGP42454A、CGS14829A的线性范围为1.63~12.19 μg·mL-1:相关系数r=0.999 5;杂质SU5683的线性范围为2.03~15.24 μg·mL-1,相关系数r=0.999 7。结论该方法重复性好,结果准确,能更好地控制贝那普利氢氯噻嗪片中有关物质的含量。
关键词:盐酸贝那普利;氢氯噻嗪;有关物质;高效液相色谱法
贝那普利氢氯噻嗪片是由血管紧张素转化酶抑制剂(ACEI)盐酸贝那普利和利尿剂氢氯噻嗪为主要成分组成的复方降压药,该两类药物合用后,对血压下降起到协同作用。规格为每片含盐酸贝那普利10 mg、氢氯噻嗪12.5 mg,剂型为薄膜衣片。为了有效控制本产品的质量,根据SFDA《药品注册管理办法》及相关技术指导原则[1-3],采用外标法和自身对照法相结合的方法,对盐酸贝那普利和氢氯噻嗪有关物质同时测定,可更好地用于本品的质量控制。
1仪器与试药
1.1仪器岛津 SPD-15C 紫外检测器;岛津SPD-M10A VP二极管阵列检测器;岛津 LC solution 15C色谱工作站;岛津 LC solution色谱工作站。
1.2试药盐酸贝那普利对照品(中国食品药品检定研究院,批号100768-201102);氢氯噻嗪对照品(中国食品药品检定研究院,批号100309-201103);杂质CGS14831、CGP42454A、CGS14829A对照品由USP ROCKVILLE MD提供;杂质SU5683对照品由德国LGC GmbH公司提供;贝那普利氢氯噻嗪片(陕西方舟制药有限公司提供);乙腈、冰醋酸、四氢呋喃为色谱纯;水为二次蒸馏水;其他试剂均为分析纯。
2方法与结果
2.1色谱条件色谱柱:Ultimate AQ-C18(250 mm×4.60 mm 5 μm);柱温:室温;流速:1.5 mL·min-1;检测器:UV检测器;检测波长:240和316 nm;运行时间:50 min;进样体积:20 μL。流动相:四氢呋喃-水-冰醋酸(250 mL+750 mL+4 mL,加入四丁基溴化铵1.0 g)。
2.2检测波长的选择取本品盐酸贝那普利归属下的特定杂质(CGS14831A和CGP42454A)、氢氯噻嗪归属下的特定杂质SU5683、氢氯噻嗪、盐酸贝那普利进行DAD全波长扫描,确定有关物质的检测波长。测得CGS14831A最大吸收波长为238 nm、CGP42454A最大吸收波长为236 nm 、SU5683最大吸收波长为312和239 nm、氢氯噻嗪最大吸收波长为242和317 nm、盐酸贝那普利最大吸收波长为238 nm。故确定有关物质的检测波长为240 nm,并同时对316 nm的波长进行检测,在316 nm波长条件下检测出的杂质均归属为氢氯噻嗪杂质。
2.3系统适用性要求理论板数按氢氯噻嗪峰计算应不低于2 000,CGS14831,SU5683与氢氯噻嗪峰的分离度应符合要求。
2.4对照品溶液取有关物质CGS14831对照品20 mg,精密称定,置于50 mL量瓶中,加溶剂使溶解并稀释至刻度,摇匀,作为杂质对照品储备液Ⅰ;取有关物质SU5683对照品适量,精密称定,加溶剂制成1 mL含0.25 mg的溶液,作为杂质对照品储备液Ⅱ;取有关物质CGS14829A对照品或有关物质CGP42454A对照品适量,精密称定,加溶剂制成1 mL含0.2 mg的溶液,作为杂质对照品储备液Ⅲ;精密量取杂质对照品储备液Ⅰ、Ⅱ、Ⅲ各2 mL,置于50 mL量瓶中,加溶剂溶解并稀释至刻度,摇匀,作为对照品溶液。
2.5供试品溶液取含量测定项下的细粉,精密称取适量(相当于盐酸贝那普利40 mg),置于50 mL量瓶中,加溶剂40 mL,超声处理10 min,振摇15 min,放冷至室温,用溶剂稀释至刻度(如有泡沫,可加入几滴乙腈),摇匀,用0.45 μm的滤膜过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。
2.6对照溶液精密量取供试品溶液1 mL,置于100 mL量瓶中,加溶剂稀释至刻度,摇匀,作为对照溶液。
2.7测定方法精密量取上述溶液各20 μL,分别注入液相色谱仪,记录色谱图,按照外标法以峰面积计算已知杂质含量,并对未知杂质用自身对照法进行计算。同时记录供试品溶液在316 nm波长处的色谱图,以确定未知杂质的归属。有关物质CGS14831的含量不得超过盐酸贝那普利标示量的3.0%;有关物质CGS14829A和CGP42454A的含量应不得超过盐酸贝那普利标示量的1.0%;有关物质SU5683的含量不得超过氢氯噻嗪标示量的1.0%。盐酸贝那普利中未知杂质的峰面积与对照溶液的峰面积比较,单个未知杂质峰面积不得大于对照溶液峰面积的0.5倍(0.5%);除有关物质CGS14831外,盐酸贝那普利中有关物质的总量不得超过2.0%;氢氯噻嗪中未知杂质的峰面积与对照溶液峰面积比较,单个未知杂质峰面积不得大于对照溶液峰面积的0.5倍(0.5%);氢氯噻嗪中有关物质的总量不得超过1.0%。
2.8干扰实验
2.8.1空白辅料溶液精密称取本品空白辅料870 mg,置于50 mL量瓶中,加溶剂40 mL,振摇,用溶剂稀释至刻度,摇匀,过滤,取续滤液作为空白辅料溶液,按照上述色谱条件测定,记录色谱图。
2.8.2系统适用性溶液取氢氯噻嗪对照品25 mg,盐酸贝那普利对照品20 mg,精密称定,置于25 mL量瓶中,分别加入CGS14831、SU5683、CGS14829A和CGP42454A混合杂质对照品储备液各1 mL,用溶剂稀释至刻度,摇匀,作为系统适用性溶液,按照上述色谱条件测定,记录色谱图。
2.8.3结果空白辅料、溶剂不干扰供试品有关物质检测,各杂质与主峰之间和各杂质之间的分离度均符合要求,结果表明,本方法专属性良好。见图1。
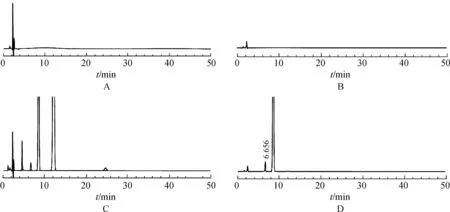
图1HPLC图
a.空白辅料240 nm;B.空白辅料316 nm;C.系统适用性240 nm;D.系统适用性316 nm
Fig.1 HPLC chromatograms
a.blank adjuvants at 240 nm;B.blank adjuvants at 316 nm;C.system suitability at 240 nm;D.system suitability at 316 nm
2.9专属性实验(破坏实验)将原料经酸、碱、热、光、氧强制降解后,进行二极管阵列检测器分析检测,确定杂质的归属,对供试品、空白辅料进行酸、碱、热、光、氧强制降解后,进行二极管阵列检测器分析检测,进一步考察有关物质检测色谱条件的专属性。
2.9.1实验操作
2.9.1.1盐酸贝那普利
(1)酸破坏供试品溶液取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,精密加入1 mol·L-1的盐酸溶液1 mL,放置24 h,再加入1 mol·L-1氢氧化钠溶液1 mL,并用溶剂稀释至刻度,摇匀,作为酸破坏供试品溶液。
(2)碱破坏供试品溶液取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,精密加入1 mol·L-1的氢氧化钠溶液1 mL,放置24 h,再加入1 mol·L-1的盐酸溶液1 mL,并用溶剂稀释至刻度,摇匀,作为碱破坏供试品溶液。
(3)热破坏供试品溶液取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,置于80 ℃水浴中加热8 h,取出,放冷至室温,用溶剂稀释至刻度,摇匀,作为热破坏供试品溶液。
(4)氧破坏供试品溶液取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL溶解,精密加入100 g·L-1过氧化氢溶液1 mL,混匀,室温放置12 h,用溶剂稀释至刻度,摇匀,作为氧破坏供试品溶液。
(5)光破坏供试品溶液取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂8 mL,溶解,在4 500±500 lx的条件下,放置48 h,用溶剂稀释至刻度,摇匀,作为光破坏供试品溶液。
2.9.1.2氢氯噻嗪
(1)酸破坏供试品溶液取氢氯噻嗪10 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,精密加入1 mol·L-1的盐酸溶液1 mL,放置24 h,再加入1 mol·L-1的氢氧化钠溶液1 mL,用溶剂稀释至刻度,摇匀,作为酸破坏供试品溶液。
(2)碱破坏供试品溶液取氢氯噻嗪10 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,精密加入1 mol·L-1的氢氧化钠溶液1 mL,放置24 h,再加入1 mol·L-1的盐酸溶液1 mL,用溶剂稀释至刻度,摇匀,作为碱破坏供试品溶液。
(3)热破坏供试品溶液取氢氯噻嗪10 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,置于80 ℃水浴中加热8 h,取出,放冷至室温,用溶剂稀释至刻度,摇匀,作为热破坏供试品溶液。
(4)氧破坏供试品溶液取氢氯噻嗪10 mg,置于10 mL量瓶中,加溶剂5 mL,溶解,精密加入100 g·L-1过氧化氢溶液1 mL,混匀,室温放置12 h,用溶剂稀释至刻度,摇匀,作为氧破坏供试品溶液。
(5)光破坏供试品溶液取氢氯噻嗪10 mg,置于10 mL量瓶中,加溶剂8 mL,溶解,在4 500±500 lx的条件下,放置48 h,用溶剂稀释至刻度,摇匀,作为光破坏供试品溶液。
2.9.1.3供试品及空白辅料破坏实验
(1)未破坏供试品溶液取本品细粉,精密称取适量盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂8 mL,用溶剂稀释至刻度,摇匀,过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得未破坏空白辅料溶液。
(2)酸破坏供试品溶液取本品细粉,精密称取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,超声处理10 min,振摇15 min,放冷至室温,加入1 mol·L-1的盐酸溶液1 mL,放置24 h,再加入1 mol·L-1氢氧化钠溶液1 mL,并用溶剂稀释至刻度,摇匀,用0.45 μm的滤膜过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得酸破坏空白辅料溶液。
(3)碱破坏供试品溶液取本品细粉,精密称取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,振摇,精密加入1 mol·L-1的氢氧化钠溶液1 mL,放置24 h,精密加入1 mol·L-1的盐酸溶液1 mL,用溶剂稀释至刻度,摇匀,过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得碱破坏空白辅料溶液。
(4)热破坏供试品溶液取本品细粉,精密称取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,振摇,置于80 ℃水浴中,加热8 h,取出,放冷至室温,并用溶剂稀释至刻度,摇匀,过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得热破坏空白辅料溶液。
(5)氧破坏供试品溶液取本品细粉,精密称取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂5 mL,振摇,精密加入100 g·L-1过氧化氢溶液1 mL,混匀,室温放置12 h,用溶剂稀释至刻度,摇匀,过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得氧化破坏空白辅料溶液。
(6)光破坏供试品溶液取本品细粉,精密称取盐酸贝那普利8 mg,置于10 mL量瓶中,加溶剂8 mL,振摇,在4 500±500 lx的条件下,放置48 h,用溶剂稀释至刻度,摇匀,过滤,弃去初滤液6 mL,取续滤液作为供试品溶液。取空白辅料190 mg,同法制得氧化破坏空白辅料溶液。
(7)测定方法精密量取上述供试品溶液各20 μL,注入液相色谱仪,记录色谱图。DAD三维图见图2,贝那普利氢氯噻嗪片原料破坏实验结果见表1,贝那普利氢氯噻嗪片样品破坏实验结果见表2。
表1贝那普利氢氯噻嗪片原料破坏实验结果
Tab.1 The destructive test results of API of Benazepril Hydrochloride and Hydrochlorothiazide Tablets
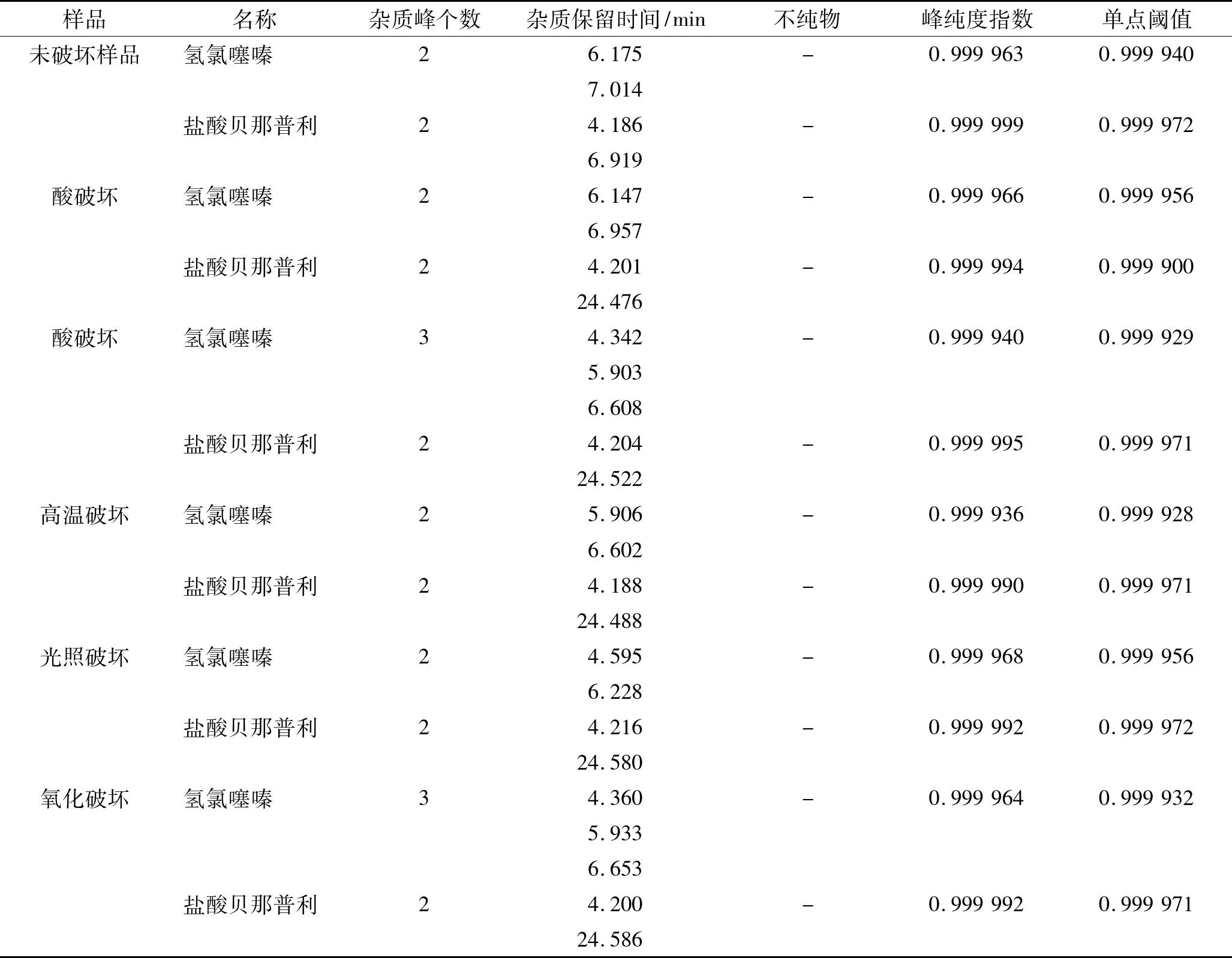
样品名称杂质峰个数杂质保留时间/min不纯物峰纯度指数单点阈值未破坏样品氢氯噻嗪26.175-0.9999630.9999407.014盐酸贝那普利24.186-0.9999990.9999726.919酸破坏氢氯噻嗪26.147-0.9999660.9999566.957盐酸贝那普利24.201-0.9999940.99990024.476酸破坏氢氯噻嗪34.342-0.9999400.9999295.9036.608盐酸贝那普利24.204-0.9999950.99997124.522高温破坏氢氯噻嗪25.906-0.9999360.9999286.602盐酸贝那普利24.188-0.9999900.99997124.488光照破坏氢氯噻嗪24.595-0.9999680.9999566.228盐酸贝那普利24.216-0.9999920.99997224.580氧化破坏氢氯噻嗪34.360-0.9999640.9999325.9336.653盐酸贝那普利24.200-0.9999920.99997124.586
注:-表示未检出。
表2贝那普利氢氯噻嗪片样品破坏实验结果
Tab.2 The destructive test results of samples of Benazepril Hydrochloride and Hydrochlorothiazide Tablets
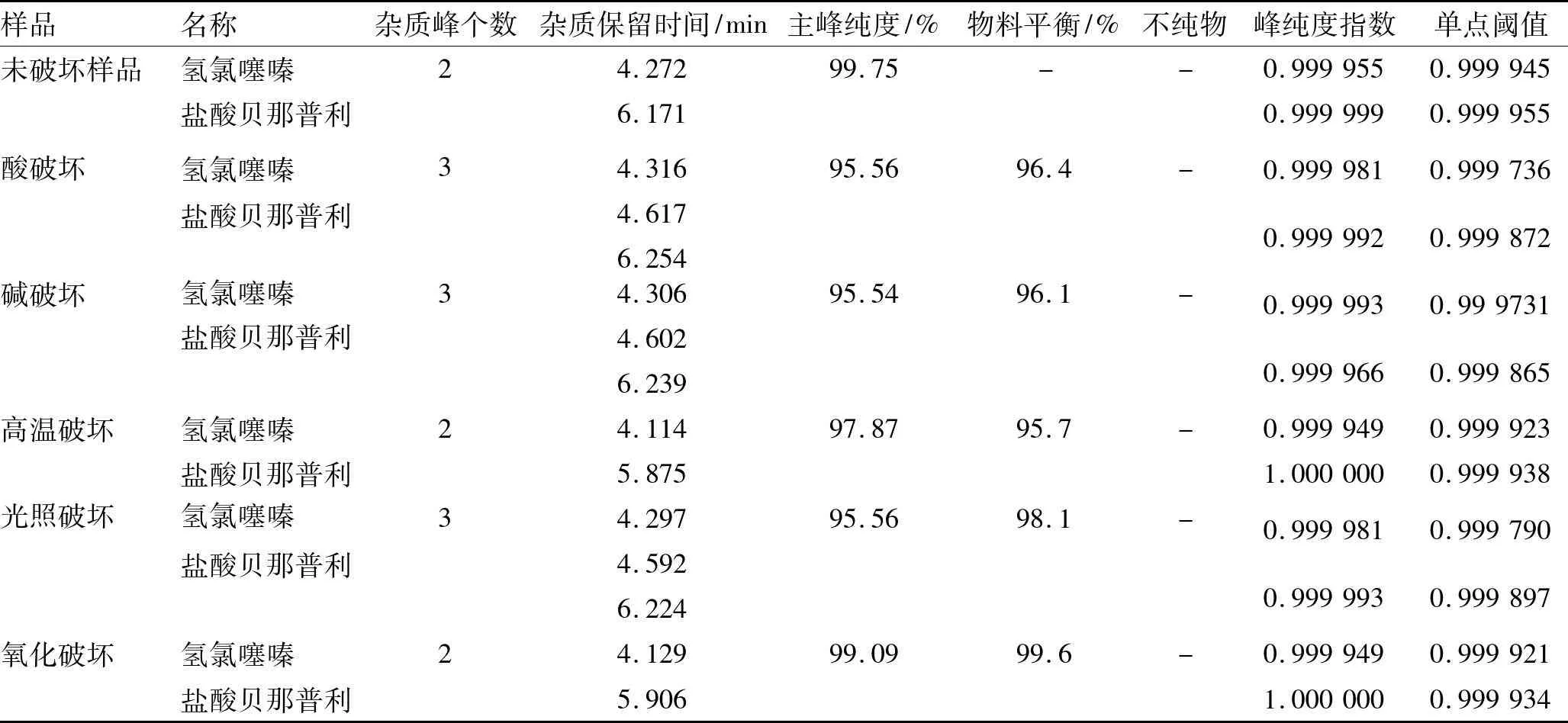
样品名称杂质峰个数杂质保留时间/min主峰纯度/%物料平衡/%不纯物峰纯度指数单点阈值未破坏样品氢氯噻嗪盐酸贝那普利24.2726.17199.75--0.9999550.9999450.9999990.999955酸破坏氢氯噻嗪盐酸贝那普利34.3164.6176.25495.5696.4-0.9999810.9997360.9999920.999872碱破坏氢氯噻嗪盐酸贝那普利34.3064.6026.23995.5496.1-0.9999930.9997310.9999660.999865高温破坏氢氯噻嗪盐酸贝那普利24.1145.87597.8795.7-0.9999490.9999231.0000000.999938光照破坏氢氯噻嗪盐酸贝那普利34.2974.5926.22495.5698.1-0.9999810.9997900.9999930.999897氧化破坏氢氯噻嗪盐酸贝那普利24.1295.90699.0999.6-0.9999490.9999211.0000000.999934
注:-表示未检出。
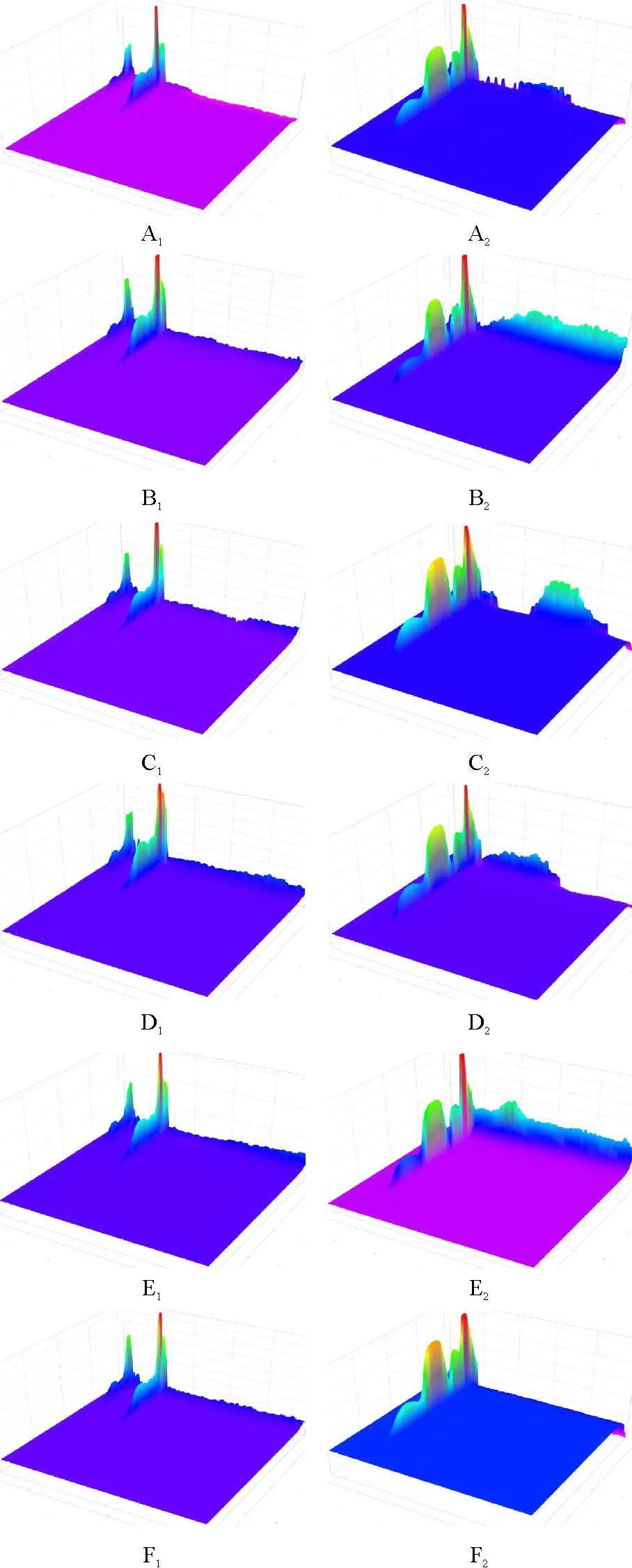
图2专属性实验DAD三维图
A1.盐酸贝那普利未破坏;A2.氢氯噻嗪未破坏;B1.盐酸贝那普利酸破坏;B2.氢氯噻嗪酸破坏;C1.盐酸贝那普利碱破坏;C2.氢氯噻嗪碱破坏;D1.盐酸贝那普利热破坏;D2.氢氯噻嗪热破坏;E1.盐酸贝那普利氧化破坏;E2.氢氯噻嗪氧化破坏;F1.盐酸贝那普利光破坏;F2.氢氯噻嗪光破坏
Fig.2 The three-dimensional figures of DAD of specificity test
A1.no damage of benazepril hydrochloride;A2.no damage of hydrochlorothiazide;B1.benazepril hydrochloride destroyed by acid;B2.hydrochlorothiazide destroyed by acid;C1.benazepril hydrochloride destroyed by alkali;C2.hydrochlorothiazide destroyed by alkali;D1.benazepril hydrochloride destroyed by heat;D2.hydrochlorothiazide destroyed by heat;E1.benazepril hydrochloride destroyed by oxidation;E2.hydrochlorothiazide destroyed by oxidation;F1.benazepril hydrochloride destroyed by light;F2.hydrochlorothiazide destroyed by light
A1.no damage of benazepril hydrochloride;A2.no damage of hydrochlorothiazide;B1.benazepril hydrochloride destroyed by acid;B2.hydrochlorothiazide destroyed by acid;C1.benazepril hydrochloride destroyed by alkali;C2.hydrochlorothiazide destroyed by alkali;D1.benazepril hydrochloride destroyed by heat;D2.hydrochlorothiazide destroyed by heat;E1.benazepril hydrochloride destroyed by oxidation;E2.hydrochlorothiazide destroyed by oxidation;F1.benazepril hydrochloride destroyed by light;F2.hydrochlorothiazide destroyed by light
A1.no damage of benazepril hydrochloride;A2.no damage of hydrochlorothiazide;B1.benazepril hydrochloride destroyed by acid;B2.hydrochlorothiazide destroyed by acid;C1.benazepril hydrochloride destroyed by alkali;C2.hydrochlorothiazide destroyed by alkali;D1.benazepril hydrochloride destroyed by heat;D2.hydrochlorothiazide destroyed by heat;E1.benazepril hydrochloride destroyed by oxidation;E2.hydrochlorothiazide destroyed by oxidation;F1.benazepril hydrochloride destroyed by light;F2.hydrochlorothiazide destroyed by light
2.9.2实验结果结果显示,有关物质CGS14831、CGS14829A和CGP42454A来源于盐酸贝那普利;SU5683来源于氢氯噻嗪;破坏后的样品降解出的杂质,与主峰均能有效分离,且各破坏条件下的主峰无不纯物,证明采用该色谱方法检测本品有关物质,具有较强的专属性。
2.10线性范围考察
2.10.1对照品线性在本品有关物质项下的杂质对照品溶液浓度的定量限至限度的200%范围内做线性实验,结果显示,本品在该范围内呈线性,回归方程分别为:CGS14831:Y=14 203X+29 662,相关系数r=0.999 6;CGP42454A和CGS14829A的混合对照:Y=7 178.4X+11 561,相关系数r=0.999 5;SU5683:Y=5 795X-7 262.8,相关系数r=0.999 7。
2.10.21%对照溶液线性在本品有关物质项下1%对照溶液的0.1%~4.0%范围内做线性实验,结果显示,本品在该范围内呈线性关系,盐酸贝那普利的回归方程:Y=14 949X+8 262.7,相关系数r=0.999 1;氢氯噻嗪的回归方程为Y=5 112.4X+7 506,相关系数r=0.999 4。
2.11准确度考察对本品已知3个杂质3个不同浓度进行回收率实验,结果显示,有关物质CGS14831的平均回收率为97.96%,RSD为1.08%;有关物质SU5683的平均回收率为98.70%,RSD为1.14%;有关物质CGP42454A和CGS14829A混合对照品的平均回收率为99.71%,RSD为0.97%;平均回收率均在80.0%~120.0%之间,RSD均小于10%,结果显示,本方法准确度良好。
2.12重复性考察取同一批供试品溶液6份,按上述方法处理,依法测定峰面积,对6个结果之间的精密度进行重复性实验。有关物质CGS14831的RSD为3.83%、有关物质SU5683的RSD为4.96%、有关物质CGP42454A和CGS14829A混合对照品的RSD为5.95%。结果表明,该方法重复性较好。
2.13样品检测采用上述的有关物质检测方法对本品3批市售品进行有关物质检查,自制3批样品检验结果符合规定,杂质个数及含量与参比制剂基本一致。结果见表3。
3讨论
贝那普利氢氯噻嗪片是由盐酸贝那普利和氢氯噻嗪为主要成分组成的复方降压药,该产品原质量标准(YBH04162009)有关物质检测方法为高效液相色谱法[4],采用原标准供试品浓度对有关物质进行分析,结果显示,杂质响应值太小,不易被检出,将浓度调整为原标准的4倍,杂质能准确检测到,故确定用4倍浓度进行本品有关物质的检测。
表3样品有关物质检测结果
Tab.3 Results of related substances determination

批号CGS14831/%SU5683/%CGP42454A/%贝那普利其他杂质/%氢氯噻嗪其他杂质/%贝那普利总杂/%氢氯噻嗪总杂/%201202010.050.06----0.06201202020.060.05----0.05201202030.070.05----0.05市售品0.130.28--0.070.070.28
注:-表示未检出。原标准采用316 nm作为检测波长,对盐酸贝那普利的杂质检测不够准确,现参考有关文献[5-7],根据实验结果确定有关物质的检测波长为240 nm,并同时以316 nm的波长进行检测。结果表明,该方法线性、准确度、重复性等均符合要求,可作为本品有关物质的控制方法。
参考文献:
[1]国家药典委员会.中国药典2010年版[S]. 二部,北京:中国医药科技出版社,2010:附录29-31.
[2]国家食品药品监督管理局.局令28号.药品注册管理办法[S]2007:7-10.
[3]国家食品药品监督管理局.药物研究技术指导原则(2005)[M].北京:中国医药科技出版社.2005:196.
[4]YBH04162009,中华人民共和国单页标准[S].
[5]陈小伟,刘阿利.缬沙坦氢氯噻嗪片有关物质测定方法研究[J].齐鲁药事,2012,31(4):214-216.
[6]陈凤菊,李燕,李建文,等.HPLC法测定氯沙坦钾-氢氯噻嗪复方分散片中药物及有关物质的含量[J].沈阳药科大学学报,2009,26(6):460-465.
[7]苏敏,章志强,邓玉清,等.RP-HPLC法测定贝那普利氢氯噻嗪片的含量[J].西北药学杂志,2014,29(6):583-586.
Determination of related substances in Benazepril Hydrochloride and Hydrochlorothiazide Tablets by HPLC
DU Xiaoying1,MA Dongwei1,SONG Yuanzhi2(1.Shaanxi Ark Pharmaceutical Limited Company,Xi′an 710075,China;2.Shaanxi Institute for Food and Drug Control, Xi′an 710065,China)
Abstract:Objective To establish a method for the determination of related substances in Benazepril Hydrochloride and Hydrochlorothiazide Tablets by HPLC. Method Ultimate AQ-C18column(250 mm×4.60 mm,5 μm) was used;the mobile phase consisted of tetrahydrofuran water-glacial acid(250 mL+750 mL+4 mL,add tetrabutylammonium bromide 1.0 g),with a flow rate of 1.5 mL·min-1. The detection wavelength was 240 and 316 nm. Results The calibration curve of impurities CGS14831 was linear in the range of 3.74-28.08 μg·mL-1,r=0.999 6;the calibration curve of impurities CGP42454A and CGS14829A were linear in the range of 1.63-12.19 μg·mL-1,r=0.999 5;the calibration curve of impurities SU5683 was linear in the range of 2.03-15.24 μg·mL-1,r=0.999 7. Conclusion The method is repeatable and accurate, and could be used for the quality control of Benazepril Hydrochloride and Hydrochlorothiazide Tablets.
Key words:benazepril hydrochloride;hydrochlorothiazide;related substances;HPLC
(收稿日期:2015-06-27)
中图分类号:R927.2
文献标志码:A
文章编号:1004-2407(2016)02-0149-06
doi:10.3969/j.issn.1004-2407.2016.02.012
