中老年高血压病患者血同型半胱氨酸水平增高对心脏结构的影响
2016-01-07刘春,殷子杰,曹志娜
中老年高血压病患者血同型半胱氨酸水平增高对心脏结构的影响
刘 春,殷子杰,曹志娜
摘要:目的 采用多普勒超声观察中老年原发性高血压患者血同型半胱氨酸(Hcy)水平增高对心脏结构的影响。方法 将122例符合纳入标准的原发性高血压患者根据Hcy水平分为Hcy正常组、Hcy增高组,所有对象均检测Hcy,并进行心脏超声检测。结果 Hcy与室间隔厚度(IVS)、室间隔厚度/左室后壁厚度(IVS/ PWT)值呈正相关(r值分别为0.267、0.266,P<0.01)。Hcy增高组IVS、IVS/ PWT值较Hcy正常组明显增大(P<0.05)。结论 血Hcy水平增高可能促使高血压患者左心室肥厚。
关键词:原发性高血压;血同型半胱氨酸;心脏结构
中图分类号:R544.1 R255.3
文献标识码:A
doi:10.3969/j.issn.1672-1349.2015.12.001
文章编号:1672-1349(2015)12-1361-03
基金项目:河南省教育厅项目(No.14A360001);河南中医学院博士科研 (No.BSJJ2009 45,BSJJ2009 46)
通讯作者:殷子杰,E mail:yzj78915@163.com
Abstract:Objective To observe the effects of elevated serum homocysteine(Hcy)level on cardiac structure in middl e old aged patients with hypertension.Methods One hundred and twent y two patients were enrolled and divided into the control group and hyperhomocysteinemia group by serum Hcy level .The parameters of the ultrasound cardiogram of the heart were detected.Results A significant positive correlation was observed between the Hcy and interventricular septal(IVS),IVS/posterior wall thickness(PWT)(r = 0.267 and 0.266,P<0.01).IVS and IVS/PWT in hyperhomocysteinemia group were higher than that in control group(P<0.05).Conclusion Elevated Hcy may be involved in the hypertrophy of the left ventricle of hypertension.
收稿日期:(2015 02 09)
作者单位:河南中医学院第三附属医院(郑州450008)
Influence of Elevated Serum Homocysteine Level on Cardiac Structure in Middl e old Aged Patients with Hypertension Liu Chun,Yin Zijie,Cao Zhina The Third Affiliated Hospital,Henan College of Traditional Chinese Medicine,Zhengzhou 450008,Henan,China Corresponding Author:Yin Zijie
Key words:hypertension;serum homocysteine;cardiac structure
研究表明血同型半胱氨酸(Hcy)水平增高损害心血管功能,高同型半胱氨酸血症是心血管事件独立的风险因子之一,可增加患者的全因死亡率及冠心病的病死率[1,2]。本研究对我院2012年2月—2013年9月收治的122例中老年高血压病患者血同型半胱氨酸水平及心脏多普勒超声进行检测,了解高同型半胱氨酸血症对高血压患者心脏结构和功能的影响。
1 资料与方法
1.1 临床资料 选择我院2012年2月—2013年9月收治的中老年高血压患者122例,男56例,女66例,年龄45岁~89岁(63.76±10.56岁);病程12.40年± 8.73年;发病时收缩压176.30 mmHg±22.35 mmHg,舒张压100.10 mmHg±12.76 mmHg;合并冠心病69例,合并糖尿病25例,合并脑血管意外31例。并根据Hcy水平分为Hcy正常组(Hcy<15μmol/L)、Hcy增高组(Hcy≥15μmol/L)[3]。Hcy正常组68例,男31 例,女37例;年龄45岁~80岁(62.81岁±10.92岁);病程11.40年±8.54年;发病时收缩压173.63 mmHg± 25.10 mmHg,舒张压99.54 mmHg±11.63 mmHg;合并冠心病38例,合并糖尿病14例,合并脑血管意外17例。Hcy增高组54例,男25例,女29例;年龄45岁~81 岁(64.96岁±10.35岁);病程13.67年±8.89年;发病时收缩压179.65 mmHg±17.76 mmHg,舒张压101.79 mmHg±10.10 mmHg;合并冠心病31例,合并糖尿病11例,合并脑血管意外14例。两组血压水平及一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 所有病例符合2010修订版《中国高血压病防治指南》诊断标准,年龄大于45岁。
1.3 排除标准 年龄小于45岁,合并肝肾功能障碍及恶性肿瘤者。
1.4 观察指标
1.4.1 血Hcy检测 所有患者均采集空腹静脉血2 mL分离血清上机,使用仪器为日本奥林帕斯公司生产的800DXC全自动生化分析仪。
1.4.2 心脏超声检测 所有患者常规检查前准备,仪器为美国通用公司生产VIVID 9e彩色多普勒超声诊断仪,参照文献[4]记录室间隔厚度(IVS)、左室后壁厚度(PWT)、IVS/PWT值、左室舒张末内径(LVEDD)、左室收缩末内径(LVESD)、舒张早期血液充盈峰值流速(E)、舒张晚期血液充盈峰值流速(A)、E/A值、左室舒张末容积(EDV)、左室收缩末容积(ESV)、左房舒张末内径(LAD)、每搏输出量(SV)、射血分数(EF)、短轴收缩率(FS)、每分钟心输出量(CO)。
1.5 统计学处理 采用SPSS13.0软件包进行统计学处理,计量资料两组间比较采用单因素方差分析,单因素相关检验采用Pearson相关分析。以P <0.05为差异有统计学意义。
2 结 果
2.1 相关性分析 Hcy与IVS、IVS/PWT呈正相关(r = 0.267,P <0.01;r = 0.266,P <0.01)。Hcy与PWT、LVEDD、LVESD、EDV、ESV、LAD、E、A、E/A、SV、EF、FS、CO无明显相关性(r值分别为0.075、0.066、0.042、0.046、0.019、0.128、0.035、-0.085、0.091、0.087、0.010、-0.017、0.087,P>0.05)。
2.2 两组各项超声指标比较(见表1、表2)Hcy增高组IVS、IVS/ PWT值较Hcy正常组明显增加,提示Hcy水平增高有促使室间隔增厚的趋势,两组其他各项指标比较差异无统计学意义,提示Hcy水平增高对其他心脏结构及功能性指标可能无明显影响。
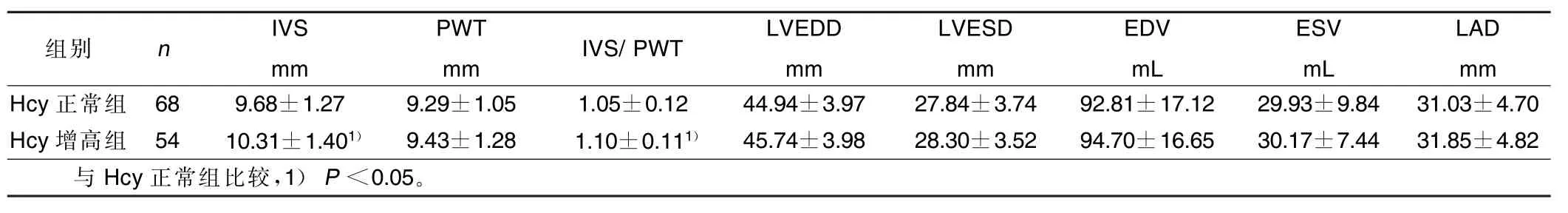
表1 两组心脏结构指标比较(x±s)
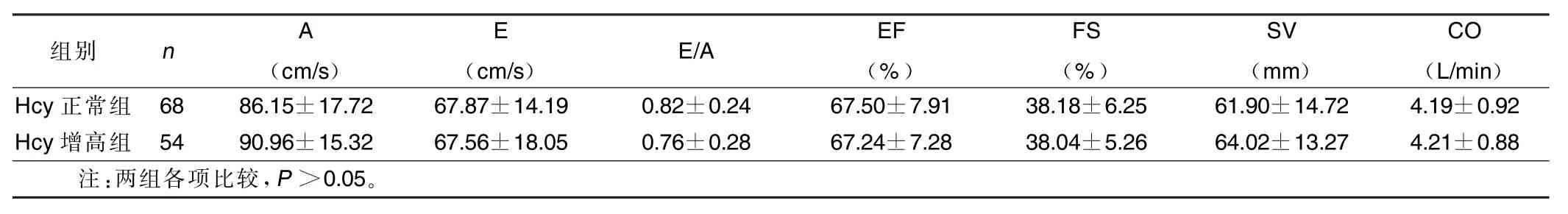
表2 两组心脏功能指标比较(x±s)
3 讨 论
左心室肥厚是高血压病最常见的靶器官损害,约20%轻度和50%重度高血压患者发生左心室肥厚,增加高血压患者发生心肌梗死、心脏性猝死、中风的风险[5]。由于逆转高血压患者的左心室肥厚可以改善其预后。因此,阻止或逆转高血压患者的左心室肥厚是高血压病治疗的主要目标[6]。
高血压左心室肥厚有离心性肥厚和向心性肥厚,离心性肥厚与心脏的前负荷有关,前负荷的持续性增加导致心肌纤维的伸长以维持正常的心功能;向心性肥厚是由于后负荷的增加导致心肌纤维直径增加,后负荷增加的原因为收缩压增高和主动脉狭窄。向心性肥厚早期可维持正常的心功能和射血分数,最终由于舒张末压的增高导致离心性肥厚。在同一个体,心室可同时发生离心性肥厚和向心性肥厚。高血压患者发生左心室肥厚主要原因有:血压的水平和年龄;神经内分泌因子,如去甲肾上腺素、血管紧张素Ⅱ、内皮素、一氧化氮(NO);基因的易感性,氧化应激等[7]。其中心肌细胞氧化应激反应增强是高血压心肌肥大的一个重要机制,丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK)通路被激活,通过核转位调节核内转录因子,引起心肌细胞增殖和生长反应。一氧化氮合酶(NOS)通常主要在心血管内皮细胞、心肌细胞及神经节表达,催化左旋精氨酸氧化合成NO,NO通过NO/环磷酸鸟苷(cGMP)/PKG通路负向调控由压力过载、去甲肾上腺素、血管紧张素Ⅱ、内皮素导致的心肌细胞肥大。抑制MAPK/ERK信号通路,减少导致心肌肥大的基因转录。减少L型钙通道的钙离子内流,抑制肌浆网钙离子释放,阻断磷脂酶C的作用,抑制细胞膜IP3受体。NO还具有抑制细胞凋亡的作用。因此,NO能够抑制心肌细胞肥大[8]。另外,成纤维细胞增生,胶原纤维和其他细胞外基质成分合成,增强间质金属蛋白酶表达,抑制金属蛋白酶组织抑制剂的表达来促使心肌细胞发生间质纤维化也是高血压心肌肥大的重要机制之一[9]。
血同型半胱氨酸水平与多基因遗传、代谢及环境
因素有关,上述单一或联合因素的影响可使同型半胱氨酸水平显著增高。导致高同型半胱氨酸血症的原因主要有以下几个因素:①富含甲硫氨酸饮食;②维生素缺乏,如维生素B12、维生素B1及叶酸缺乏;③基因异常,如甲硫氨酸合成酶、胱硫醚合成酶β及亚甲基四氢叶酸还原酶基因异常;④肾功能减退等。已知血同型半胱氨酸在体内产生病理反应的主要机制有:通过氧化应激机制,增加活性氧簇产生,通过超氧阴离子的作用影响金属基质蛋白酶及其抑制物的功能;影响血管内皮功能,影响NOS蛋白质表达,降低NO合成及生物利用度[10];增加金属基质蛋白酶的表达,增加心肌胶原蛋白合成,促使心肌纤维化和细胞外基质重构[11]。因此,血同型半胱氨酸增加活性氧簇产生,影响NOS蛋白质表达,降低NO合成及生物利用度,增加心肌胶原蛋白合成,是其促使心肌肥大的可能机制。
本研究结果表明,伴有血同型半胱氨酸水平增高的高血压患者室间隔厚度明显增加,提示血同型半胱氨酸具有促使左心室肥大的作用,结果与文献报道一致[12]。临床和实验研究表明,补充叶酸和维生素B12可有效降低血同型半胱氨酸水平,降低金属基质蛋白酶活性,降低胶原合成,增加转化生长因子β1的表达,改善内皮功能,增加血NO及NOS水平,改善左心室肥厚,改善心功能[13 15]。
参考文献:
[1] 关秀萍,黎明丽,杨柳.多普勒超声在评价高血压患者左心室舒张功能中效果的系统评价[J].中国循证心血管医学杂志,2010,2(4):219 227.
[2] Waŝkiewicz A,Sygnowska E,Broda G.Homocysteine concentration and the risk of death in the adult Polish population[J].Kard-i ol Pol,2012,70(9):897 902.
[3] He L,Zeng H,Li F,et al .Homocysteine impairs coronary artery endothelial function by inhibiting tetrahydrobiopterin in patients with hyperhomocysteinemia[J].Am J Physiol Endocrinol Metab, 2010,299(6):1061 1065.
[4] Bogdanski P,Miller Kasprzak E,PupekMusialik D,et al . Plasma total homocysteine is a determinant of carotid intima media thickness and circulating endothelial progenitor cells in patients with newly diagnosed hypertension[J].Clin Chem Lab Med,2012,50(6):1107 1113.
[5] Ruilope LM,Schmieder RE.Left ventricular hypertrophy and clin-i cal outcomes in hypertensive patients[J].Am J Hypertens,2008, 21(5):500 508.
[6] Komatsu H,Yamada S,Iwano H,et al .AngiotensinⅡreceptor blocker,valsartan,increases myocardial blood volume and regresses hypertrophy in hypertensive patients[J].Circ J,2009,73(11):2098 2103.
[7] Izzo JL Jr,Gradman AH.Mechanisms and management of hypertensive heart disease:From left ventricular hypertrophy to heart failure[J].Med Clin N Am,2004,88(5):1257 1271.
[8] Garcia JA,Incerpi EK.Factors and mechanisms involved in left ventricular hypertrophy and the anti hypertrophic role of nitric oxide[J].Arq Bras Cardiol,2008,90(6):409 416.
[9]Agabiti Rosei E,Muiesan ML.Hypertensive left ventricular hypertrophy:Pathophysiological and clinical issues [J ]. Blood Press,2001,10(5 6):288 298.
[10] Steed MM,Tyagi SC.Mechanisms of cardiovascular remodeling in hyperhomocysteinemia [J]. Antioxid Redox Signal,2011,15(7):1927 1943.
[11] Vacek TP,Vacek JC,Tyagi SC.Mitochondrial mitophagic mechanisms of myocardial matrix metabolism and remodeling[J].Arch Physiol Biochem,2012,118(1):3142.
[12] Wocial B,Berent H,Kostrubiec M,et al .Homocysteine,adrenergic activity and left ventricular mass in patients with essential hypertension[J].Blood Press,2002,11(4):201 205.
[13] Miller A,Mujumdar V,Palmer L,et al .Reversal of endocardial endothelial dysfunction by folic acid in homocysteinemic hypertensive rats[J].Am J Hypertens,2002,15(2 Pt 1):157 163.
[14] Carroll JF,Tyagi SC.Extracellular matrix remodeling in the heart of the homocysteinemic obese rabbit[J].Am J Hypertens,2005, 18(5 Pt 1):692 698.
[15] Wu CJ,Wang L,Li X,Wang CX,et al .Impact of adding folic acid,vitamin B(12)and probucol to standard antihypertensive medication on plasma homocysteine and asymmetric dimethy-l arginine levels of essential hypertension patients[J].Chin J Cardiol,2012,40(12):1003 1008.
(本文编辑郭怀印)
