远隔缺血预适应对大鼠心肌缺血再灌注的保护作用
2016-01-07王洪志,张一娜,武小薇
远隔缺血预适应对大鼠心肌缺血再灌注的保护作用
王洪志,张一娜,武小薇
摘要:目的 探讨远隔缺血预适应(RIPC)对心肌细胞缺血再灌注(IR)损伤的保护作用,深入研究硫氧还蛋白(Trx)在RIPC信号通路中的作用。方法 选择Wistar雄性大鼠72只随机分为6组,分别为对照组、IR组、RIPC+IR组、Trx拮抗剂组、PI3K抑制剂组、单纯RIPC组。制作RIPC和IR模型,采用称重法检测心肌梗死范围、TUNEL法检测细胞凋亡,光镜观察病理形态学改变,免疫组化法检测Trx的表达。结果 对照组和单纯RIPC组细胞结构、形态正常;IR组、Trx拮抗剂组和PI3K抑制剂组心肌纤维排列紊乱,心肌细胞呈大片状坏死;RIPC+IR组心肌结构相对完整,局灶性心外膜下变性坏死,保护了心肌。与对照组和单纯RIPC组比较,其他各组心肌凋亡率和梗死范围显著增加;IR组、Trx拮抗剂组、PI3K抑制剂组差异无统计学意义;与RIPC+IR组比较,IR组、PI3K抑制剂组和Trx拮抗剂组细胞凋亡率明显增加(P<0.05)。免疫组化,Trx在对照组低表达,在IR组中度表达,在RIPC+IR组、Trx拮抗剂组、PI3K抑制剂组和单纯RIPC组高表达。结论 RIPC的心肌缺血再灌注保护作用可能通过升高Trx表达,激活PI3K通路实现。
关键词:心肌缺血再灌注;远隔缺血预适应;硫氧还蛋白;细胞凋亡
中图分类号:R542.2 R256.2
文献标识码:A
doi:10.3969/j.issn.1672-1349.2015.12.007
文章编号:1672-1349(2015)12-1378-03
基金项目:黑龙江省青年科学基金项目(No.C类QC2009C34);黑龙江省教育厅科学技术研究项目(No.11541160)
通讯作者:武小薇,E mail:wuxw75@163.com
收稿日期:(2015 02 19)
作者单位:哈尔滨医科大学附属第二医院(哈尔滨150086)
心肌缺血再灌注(IR)损伤广泛存在于临床,严重威胁着人类的身体健康。1986年,Murry等[1]首先报道心肌缺血预适应(IPC)有心脏保护作用,之后又发现远隔缺血预适应(RIPC)也有类似的心肌保护作用。RIPC可以减少细胞凋亡、梗死范围和再灌注心律失常等,有保护心肌缺血再灌注作用[2,3]。RIPC是通过何种机制发挥心肌保护作用的呢?研究发现RIPC可以上调心肌保护性基因、蛋白水平[4,5]。随着研究的深入,硫氧还蛋白(Trx)进入了人们的视线。肿瘤学研究发现Trx有调节氧化还原平衡、促进生长、抗凋亡和调节炎症反应等多种生物学功能[6,7]。而抗氧化应激、抑制凋亡和减弱炎症反应的调节恰恰是防治再灌注损伤的重要切入点。本研究进一步探讨RIPC对心肌细胞IR损伤的保护作用,深入研究Trx在RIPC中作用。
1 材料与方法
1.1 主要试剂及仪器 HX 300动物呼吸机,成都泰盟科技有限公司;RM6240B型多道生物信号采集处理系统,成都仪器厂;LY294002(PI3K抑制剂),碧云天生物技术研究所;PX 12(Trx拮抗剂),英国Tocris公司;SP Mouse HRP Kit鼠Streptavidi n HRP试剂盒、DAB Kit(DAB显色试剂盒),北京康为世纪生物技术有限公司;Trx小鼠抗大鼠多克隆抗体,Santa公司;HRP标记兔抗山羊IgG(H+L)、HRP标记山羊抗小鼠IgG(H+L)、HRP标记抗小鼠二抗、HRP标记抗山羊二抗,中衫金桥公司;凯基TUNEL细胞凋亡原位检测试剂盒(BIOTIN标记POD法),凯基生物。
1.2 心肌I/R损伤模型 大鼠以10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,连续监测Ⅱ导心电图(ECG),气管插管呼吸机辅助呼吸。沿胸骨左缘分离肋骨,暴露心脏,于左心耳下3 mm~4 mm略靠近动脉圆锥处结扎前降支。缺血45 min后剪开结扎线,再灌注180 min,为心肌I/R损伤模型。
1.3 RIPC模型 大鼠以10%水合氯醛(3.5 mL/kg)腹腔注射麻醉,选择一侧下肢小心分离出股动脉,动脉下穿线小心提拉5 min使血流中断,放松10 min使血流恢复,反复进行3次后缝合皮肤,单独饲养24 h后进行后续试验。
1.4 实验分组 将72只Wistar雄性大鼠随机分为6 组,每组12只,其中4只检测梗死范围。对照组:建立RIPC模型,IR模型假手术;IR组:RIPC模型假手术,建立IR模型;RIPC+IR组:建立RIPC和IR模型;Trx拮抗剂组:建立RIPC和IR模型,再灌注前10 min注入Trx拮抗剂;PI3K抑制剂组:建立RIPC和IR模型,再灌注前10 min注入PI3K抑制剂;单纯RIPC组:建立RIPC模型,IR模型假手术。Trx拮抗剂和PI3K抑制剂组在再灌注前10 min尾静脉注药,其余各组灌注生理盐水。
1.5 观察指标
1.5.1 梗死面积 再灌注结束后伊文思蓝溶液2 mL充分染色,冲洗后取下心脏漂洗干净,吸干后剪取左心室,吸干后保鲜膜包裹,-20℃冷冻30 min均匀切成1 mm等厚的薄片,可见血供正常区着蓝色,缺血危险区不着色;分离并分别称重;然后将缺血危险区置于2,3,5氯化三苯基四氮唑(TTC)磷酸盐缓冲液中,37℃孵育20 min,10%中性甲醛溶液固定24 h。染成红色为存活心肌,被甲醛漂成灰白色为坏死心肌。再次分离并分别称重。以梗死区重量占缺血危险区重量的百分比来表示心肌梗死范围的大小。公式为:心肌梗死面积=梗死心肌/缺血危险区×100%
1.5.2 病理观察 取距前降支结扎线远端约2 mm处左心室前壁组织,常规制作心肌标本切片,光镜下观察大鼠心肌组织病理形态学改变。
1.5.3 细胞凋亡的检测 采用TUNEL试剂盒检测各组心肌细胞的凋亡。凋亡的心肌细胞核染成棕黄色,而未凋亡的显深蓝色。每张切片随机选取5个视野(×400倍),每个视野至少100个细胞,以凋亡阳性细胞个数/所有细胞个数求阳性百分率,计算平均阳性细胞率来反映各组心肌细胞凋亡的情况。
1.5.4 免疫组化 半定量分析心肌Trx阳性细胞百分比。在低倍镜下随机选择5个(×400)视野,分别计算这5个不同视野着色细胞的百分比及胞浆、胞核的着色程度,得分取其均值。基本不黄染定为0分,着色淡为1分,较深染色为2分;着色细胞百分比:≤5%计为0分,6%~25%计为1分,26%~50%计为2分,≥51%计为3分,最终得分计作每张切片染色细胞百分比得分×黄染程度得分。
1.6 统计学处理 采用SPSS 17.0统计软件进行分析,数据以均数±标准差(x±s)表示,多组均数及组间两两比较分别采用单因素方差分析,以P <0.05为差异有统计学意义。
2 结 果
2.1 心肌组织病理形态学改变 对照组和单纯RIPC组心肌纤维呈束状整齐分布,结构完整,均匀着色,细胞形态正常。IR组、Trx拮抗剂组和PI3K抑制剂组心肌纤维排列紊乱,着色不均,心肌纤维少量断裂,可见大片状心肌坏死,细胞核有浓缩、破裂、溶解、消失现象,可见心肌间质大量炎性细胞浸润。RIPC+IR组心肌纤维排列相对整齐,结构相对完整,着色较均匀;细胞核有轻度的浓缩、溶解现象,心肌间质轻度水肿、少量炎性细胞浸润。
2.2 梗死范围 与对照组和单纯RIPC组比较,其他组梗死范围显著增大(P <0.05);与RIPC+IR组比较,IR组、PI3K抑制剂组和Trx拮抗剂组梗死范围明显增大(P<0.05);IR组、PI3K抑制剂组和Trx拮抗剂组3组间比较差异无统计学意义(P>0.05)。详见表1。
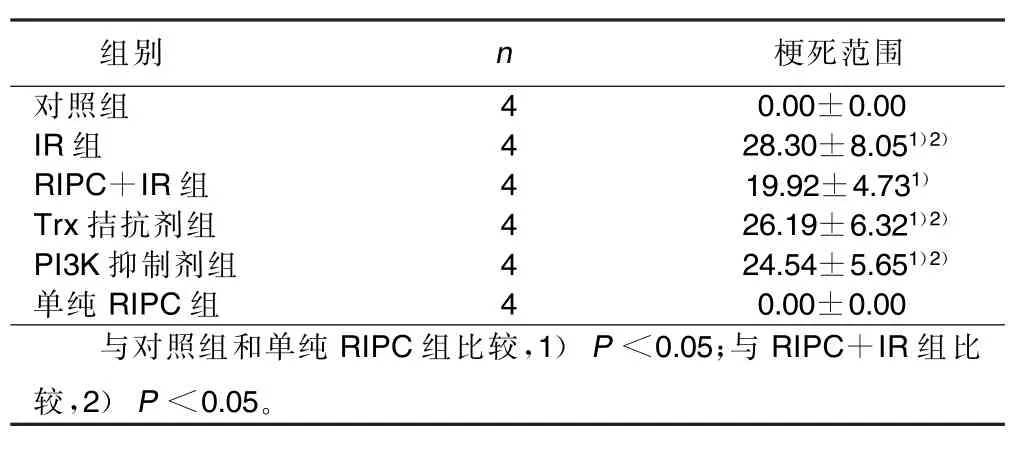
表1 各组心肌梗死范围比较(x±s) %
2.3 心肌细胞凋亡 对照组和单纯RIPC组仅可见少量散在TUNEL阳性细胞核,两组间差异无统计学意义(P>0.05)。IR组、Trx拮抗剂组和PI3K抑制剂组均可见到典型TUNEL阳性凋亡细胞核,心肌细胞凋亡明显,成群分布,3组间差异无统计学意义(P> 0.05)。与对照组和单纯RIPC组比较,其他组细胞凋亡率显著升高(P <0.05);与RIPC+IR组比较,IR组、PI3K抑制剂组和Trx拮抗剂组细胞凋亡率明显升高(P<0.05)。详见表2。

表2 各组心肌细胞凋亡率比较(x±s) %
2.4 免疫组化 与对照组比较,其他组Trx表达显著增加(P<0.05);与IR组比较,RIPC+IR组、Trx拮抗剂组、PI3K抑制剂组和单纯RIPC组Trx表达明显增加(P<0.05),RIPC+IR组、Trx拮抗剂组、PI3K抑制剂组和单纯RIPC组Trx表达差异无统计学意义(P>0.05)。详见表3。

表3 各组Trx表达比较(x±s)
3 讨 论
研究证实,Trx作为一种氧化还原调节蛋白,广泛存在于原核和真核细胞中,在多个方面起到保护心肌缺血再灌注的作用:①调节氧化还原平衡:可以清除ROS,降低氧自由基的破坏;②与各种蛋白质相互作用发挥抗凋亡促生长作用,通过蛋白间的互动,Trx改变酶的活性或接触蛋白如核因子κB(NF κB)的亚细胞定位,从而影响各种细胞功能[8];③调节炎症反应:类趋化因子活性抑制白细胞聚集,发挥调节免疫作用[9]。作为机体对氧化应激的防御反应,Trx可分泌到细胞外,发挥抗凋亡、抗炎作用保护细胞,以及作为自分泌/旁分泌因子促进增长,影响到邻近的细胞,并可能防止损伤扩展[8]。RIPC保护心肌缺血再灌注途径中,Trx发挥何种作用尚不完全明了。本实验证实RIPC保护心肌缺血再灌注作用与Trx密切相关。
本实验发现IR组缺血区心肌细胞大片状坏死,伴广泛的心肌细胞凋亡;大量细胞核浓缩、破裂、溶解、消失,心肌间质大量炎性细胞浸润。而RIPC+IR组梗死范围、凋亡明显减少,结构相对完整,证实RIPC起到了心肌保护作用,许多类似的实验也证明这种心肌保护作用[10,11]。同时,本实验发现RIPC+IR组Trx高表达,接着对RIPC大鼠注入Trx拮抗剂PX12抑制Trx功能,发现Trx拮抗剂组大鼠出现类似缺血再灌注样改变。证实Trx参与了RIPC延迟相的心肌保护作用,抑制Trx的功能可以削弱RIPC对心肌IR的保护作用。
本实验发现RIPC可以防止心肌缺血再灌注损伤,而在给予特异性PI3K信号通路阻断剂LY294002 后,细胞凋亡率和心肌梗死面积增加,抑制了RIPC的心肌保护作用。PI3K抑制剂可以抑制RIPC保护心肌的作用,提示PI3K信号通路在RIPC中发挥重要作用。PI3K/Akt信号通路与细胞生存密切相关,研究表明,缺氧诱导的心肌细胞凋亡能够被高表达PI3K或Akt抑制[12]。PI3K可以激活Akt,激活后的Akt主要通过底物水平磷酸化,改变凋亡基因表达水平发挥抗凋亡、促细胞生存功能。激活的PI3K/Akt能够阻断许多刺激因子所诱导的细胞凋亡[13,14]。有研究发现外源性Trx通过调控细胞外信号调节激酶和对PI3K的激活保护肺泡Ⅱ型上皮细胞免受高氧症诱导的细胞损伤[15]。
研究发现Trx和PI3K在肿瘤生成中存在上下游关系,这些提示在RIPC保护作用中,可能也存在这种上下游的关系。本实验发现Trx和PI3K都与RIPC保护作用密切相关,抑制PI3K或拮抗Trx的功能,都可以显著削弱心肌保护作用;而PI3K抑制剂组Trx同样高表达,除外Trx位于PI3K下游的可能。推论RIPC延迟相的心肌保护作用可能通过升高Trx表达,激活PI3K信号通路完成。
同时,本实验发现RIPC还可以减轻细胞间质的炎性细胞浸润。有研究表明Trx有减轻炎症的作用[9],将进一步探讨细胞凋亡与炎症的相关性,以及Trx在其中的作用。
参考文献:
[1] Murry CG,Jennings RB,Reimer RA,et al .Preconditioning with ischemia:A delay of lethal cell injury in ischemic myocardium [J].Circulation,1986,74:1124.
[2] Loukogeorgakis SP,Panagiotidou AT,Broadhead MW,et al .Remote ischemic preconditioning provides early and late protection against endothelial ischemiareperfusion injury in humans: Role of the autonomic nervous system[J].J Am Coll Cardiol, 2005,46(3):450 456.
[3] Konstantinov IE,Li J,Cheung MM,et al .Remote ischemic preconditioning of the recipient reduces myocardial ischemia reperfusion injury of the denervated donor heart via a Katp channel dependent mechanism[J].Transplantation,2005,79(12): 1691 1695.
[4] Lazaris AM,Maheras AN,Vasdekis SN,et al .Protective effect of remote ischemic preconditioning in renal ischemia/reperfusion injury,in a model of thoracoabdominal aorta approach[J].J Surg Res,2009,154(2):267 273.
[5] 吴立春,陈国桢,方中良.超速起搏预适应的延迟保护与热休克蛋白27的表达[J].心血管康复医学杂志,2012,21(1):3437.
[6] Baker A,Payne CM,Briehl MM,et al .Thioredoxin,a gene found overexpressed in human cancer,inhibits apoptosis in vitro and in vivo[J].Cancer Res,1997,57(22):5162 5167.
[7] Pramanik KC,Srivastava SK.Apoptosis signal regulating kinase 1thioredoxin complex dissociation by capsaicin causes pancreatic tumor growth suppression by inducing apoptosis[J].Ntioxid Redox Signal,2012,17(10):1417 1432.
[8] Ago T,Sadoshima J.Thioredoxin and ventricular remodeling[J]. J Mol Cell Cardiol,2006,41(5):762 773.
[9] Liu W,Nakamura H,Shioji K,et al .Thioredoxin 1 ameliorates myosin induced autoimmune myocarditis by suppressing chemokine expressions and leukocyte chemotaxis in mice[J].Circulation,2004,110(10):1276 1283.
[10] 武小薇,张一娜,滕宗艳,等.人重组硫氧还蛋白对大鼠心肌缺血再灌注梗塞范围和心肌凋亡的影响[J].心血管康复医学杂志, 2009,18(1):2629.
[11] 陈宏伟.心肌缺血预适应及冠脉侧支循环对急性心肌梗塞患者的保护[J].心血管康复医学杂志,2011,20(1):2225.
[12] Elsherif L,Wang X,Grachoff M,et al .Cardiac specific expression of the tetracycline transactivator confers increased heart function and survival following ischemia reperfusion injury[J]. PLoS One,2012,7(1):e30129.
[13] Xu J,Tian W,Ma X,et al .The molecular mechanism underlying morphine induced Akt activation:Roles of protein phosphatases and reactive oxygen species[J].Cell Biochem Biophys,2011,61(2):303 311.
[14] Kunuthur SP,Mocanu MM,Hemmings BA,et al .The Akt1 isoform is an essential mediator of ischemic preconditioning[J].J Cell Mol Med,2012,16(8):1739 1749.
[15] Chen Y,Chang L,Li W,et al .Thioredoxin protects fetal typeⅡepithelial cells from hyperoxiainduced injury[J].Pediatr Pu-l monol,2010,45(12):1192 1200.
(本文编辑郭怀印)
