人类卵子改良程序化冷冻和玻璃化冷冻比较研究
2015-05-24金良
金良
人类卵子改良程序化冷冻和玻璃化冷冻比较研究
金良
程序化冷冻;玻璃化冷冻;复苏率;优质胚胎率;人类卵子
程序化冷冻曾广泛应用于辅助生殖临床,但因需依赖程序化冷冻仪,操作过程耗时较长等原因,目前正逐渐被玻璃化冷冻所取代。一般认为,相比于常规程序化冷冻,玻璃化冷冻操作简便,具有更稳定的冷冻复苏效率。相比卵裂期胚胎和囊胚,卵母细胞体积较大、含水比例高、细胞膜的渗透性低,冷冻过程中的冰晶形成更易对卵子产生损伤[1]。同时,卵母细胞纺锤体对温度改变敏感,冷冻过程可影响染色体的重排。迄今为止,无论是常规程序化冷冻,还是玻璃化冷冻,卵母细胞的冷冻复苏率仍然明显低于胚胎的同项指标,其受精胚胎移植后的着床率和新生儿出生率更是十分低下。探索改善卵子冷冻复苏技术仍然是辅助生殖工作者的一项重要任务,故此,本中心通过改良冷冻保护剂,尝试开展了改良程序化冷冻法进行卵子冷冻复苏工作,比较其与玻璃化冷冻法对卵母细胞复苏率、受精率、卵裂率及囊胚形成率的差异,分析其对卵子潜能发展的影响。
1 材料与方法
1.1 卵子来源 收集2013年8月—2014年5月本中心接受常规体外受精-胚胎移植(IVF-ET)患者未受精卵子(MII期,day1),或卵母细胞胞浆内单精子显微注射(ICSI)患者取卵日(day0)未成熟卵子(GV、MI),经体外培养成熟(MII)发育为MII卵母细胞共278个,其中152个采用程序化冷冻,另126个采用玻璃化冷冻,所有患者均签署知情同意书,患者年龄24~36岁,平均(31.56±2.37)岁。患者不孕病因,主要是男方因素、女方输卵管因素及排卵障碍,排除子宫内膜异位症、子宫肌瘤、多囊卵巢综合征和其他可能影响卵子质量的病例。
1.2 研究方法
1.2.1 卵子程序化冷冻与解冻 ①程序化卵子冷冻:采用 FreezeKitTM Cleave试剂盒(Vitrolife公司),包含ES(equilibration solution,mHTF+12%sss)和FS(freezing solution,1.5M PROH+0.35M蔗糖),4℃保存,使用前取出室温(25℃)平衡,将待冷冻卵子转入溶液ES中平衡10min,再移入FS中平衡,卵子以2~3个/管装入冷冻麦管,放入PLANER程序降温仪(英国Planer公司,规格型号Kryo 360~1.7),10min后启动慢速冷冻程序,起始温度20℃,以-2℃/min逐步降温至-6℃,于-6℃稳定2min后进行植冰,停留8min后以-0.3℃/min缓慢降温至-30℃,再予-50℃/ min迅速降温至-150℃,取出麦管迅速投入液氮中保存。②程序化卵子解冻:采用ThawKitTM Cleave试剂盒(Vitrolife公司),包含TS1(thawing solution 1,0.5M 蔗糖)、TS2(thawing solution 2,0.25M 蔗糖)和ES(equilibration solution,mHTF+12%sss)。将麦管从液氮中取出后,室温下放置30s后放入30℃水浴45s,剪开麦管,将卵子打入TS1中5min后,转入TS2中5min,再转入ES中5min,转移至G-1培养液(G-1TM;Vitrolife)放入37℃、6%CO2培养箱后继续培养3~4h。1.2.2 卵子玻璃化冷冻与解冻 ①玻璃化卵子冷冻:采用EmbryoVitri System-Cooling试剂盒(Origio公司),冷冻液分为BS(base solution,mHTF+12mg/ mL HSA)、ES(equilibration solution,7.5%(v/v)DMSO +7.5%(v/v)EG)和VS(vitrification solution,15%(v/v)DMSO+15%(v/v)EG+0.58M蔗糖),4℃保存,使用前取出室温(25℃)平衡。将待冷冻卵子转入BS中平衡1min后,转入ES中4min-10min,观察卵子自然下沉,出现皱缩再回复,当卵子膨大到最大程度时,迅速转移至VS中,在3个不同的位置用吸管进行吸放,充分平衡,时间不超过60s,将卵子以最小液滴体积2~3个/管转移至玻璃化冷冻载体片上,迅速置入液氮中,小心地封上套管,标记保存。②玻璃化卵子解冻:采用EmbryoVitri System-Warming试剂盒(Origio公司),解冻液(4℃保存)分为WS1(warming solution1,1M蔗糖)、WS2(warming solution2,0.5M蔗糖)、WS3(warming solution3,0.25M蔗糖)、WS4(warming solution1,mHTF+12mg/ml HSA)。使用前,WS1在37℃平衡15~30min,其他解冻液室温(25℃)平衡。将载体Crytop从液氮中取出,迅速将前端载体片浸入WS1中,轻轻摇晃时卵子脱落到WS1中1min后,将卵子转移至WS2内,放置3min,卵子部分恢复至冷冻前形态,随后转移至WS3中3min,观察卵子形态继续恢复,但仍未恢复至冷冻前形态,再将卵子依次置于两孔WS4中各3min,转移至G-1培养液(G-1TM,Vitrolife)放入37℃、6%CO2饱和湿度培养箱后继续培养2h。
1.3 受精和胚胎培养 将复苏后存活卵子培养一段时间(程序化解冻3~4h,玻璃化解冻2h)后,选择优质成熟卵子(其标准为见明显的第一极体,胞浆均质,折光好,胞膜连续平滑)行卵母细胞单精子显微注射(ICSI),所用精子来源为女方输卵管因素不孕接受常规体外受精-胚胎移植(IVF-ET)患者的正常密度活力精子,排除因男性精子因素影响受精率的影响。
两组不同方法复苏后的卵子经ICSI后转移至G-1培养液(G-1TM,Vitrolife)放回37℃、6%CO2饱和湿度培养箱后继续培养,于受精后第1天(16~ 18h)观察可见明显双原核者为正常受精,记录受精个数;于受精后第3天(66~68h)观察胚胎分裂情况,根据伊斯坦布尔共识进行胚胎评级,标准如下:
Ⅰ级胚胎:细胞数7~9个,大小均匀,碎片<10%,无多核现象;Ⅱ级胚胎:细胞数6~9个,大小基本均匀,碎片10%~25%,无多核现象;Ⅲ级胚胎:细胞数<6个或>9个,碎片>25%,或有多核现象。其中Ⅰ级、Ⅱ级胚胎定义为优质胚胎。
记录分裂情况后将胚胎分别转入G-2培养液(G-2TM,Vitrolife)继续培养至Day5,观察囊胚形成情况,分为6个时期:早期囊胚、囊胚、完全囊胚、扩张囊胚、正在孵出的囊胚和孵出囊胚。
1.4 统计学方法 使用SPSS13.0软件进行统计分析。采用χ2检验,P<0.05表示差异有统计学意义。
2 结果
改良程序化冷冻组卵子的复苏率(108/ 152,71.05%)显著低于玻璃化冷冻组(103/126,81.75%)(P<0.05);两组方法行ICSI后的第1天受精率(56/108,51.85%vs 53/103,51.46%)及第3天卵裂率(45/56,80.36%vs 43/53,81.13%)差异无统计学意义(P>0.05);程序化冷冻组第3天优质胚胎率(23/ 56,41.07%)明显高于玻璃化冷冻组(13/53,30.23%),差异有统计学意义(P<0.05);比较第5天囊胚形成率,程序化冷冻组(6/45,13.33%)虽高于玻璃化冷冻组(3/43,6.98%),但差异无统计学意义(P>0.05)。见表1。
3 讨论
本研究比较了改良程序化冷冻和玻璃化冷冻卵子的结局,发现玻璃化冷冻卵子可以获得较高的复苏率,但使用改良的程序化冷冻试剂盒冻融卵子,可以较玻璃化冷冻获得更好发育潜能。
关于卵子冷冻技术,一直是辅助生殖领域的难点之一。如何提高卵子冻融后的存活率是首要问题,玻璃化冷冻过程中高浓度保护剂的固化,形成无结构的玻璃态,有效地避免了细胞内冰晶形成而造成的机械性损伤[2],相比程序化冷冻在减少卵子损伤上更具优势,本研究结果中玻璃化冷冻组在复苏率上也显著高于程序化冷冻组。关于慢速冷冻方法冷冻护荆中的蔗糖的浓度,多方文献报道从0.10~0.3M不等[3],李莉等[4]通过比较两组不同浓度(A组0.2M VS B组0.3M)蔗糖含量的冷冻保护剂进行程序化冷冻卵子发现,B组卵子获得了更高的存活率,从而认为适当提高蔗糖浓度有利于卵子的冻存。本研究在以前试验的基础上采用改良程序化冷冻保护剂,相比传统冷冻保护剂0.1M的蔗糖浓度,进一步提高冷冻液中蔗糖的浓度至0.35M,目的为了产生更高的跨细胞膜渗透压梯度,减少细胞损伤,在复苏过程中较高浓度蔗糖也可保护卵膜变硬程度,减少对卵子受精和胚胎发育的影响,另外,李莉等[4]还统计了复苏后卵子ICSI前培养时间对受精率及胚胎发育的影响,得出复苏培养后3~4h有助于卵子结构的恢复,提高受精率和发育潜能,其原因是卵子冷冻过程中可能引起纺锤体解体,复苏后虽然能够自我修复,但玻璃化冷冻后较程序化冷冻有更快的修复速度和修复比例,故本研究程序化冷冻的卵子相比玻璃化冷冻组在复苏后复延长了培养时间,是为了将卵子冻融后对受精情况的影响降至最低,结果显示改良程序化冷冻组与玻璃化冷冻组在受精率和卵裂率上相比差异无统计学意义。
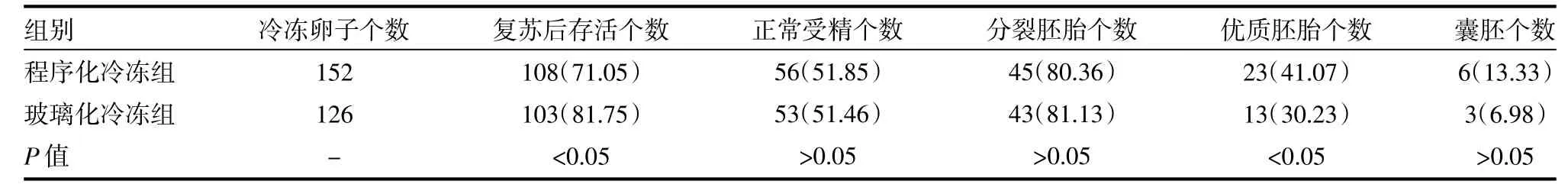
表1 程序化冷冻与玻璃化冷冻卵子的复苏率、受精率、卵裂率、优质胚胎率及囊胚形成率比较[个(%)]
近年来,玻璃化冷冻卵子以其独特的优势,其临床应用价值已被众多文献证实。Cobo等[5]对2005-2009年5个随机对照试验共4283个玻璃化冷冻卵子、3524个新鲜卵子和361个慢速程序化冷冻卵子的复苏率和临床结局进行Meta分析结果显示,玻璃化冷冻和新鲜卵子在受精率、胚胎卵裂率、优质胚胎率和妊娠率差异无统计学意义;与慢速化冷冻相比,玻璃化冷冻卵子的存活率、受精率更有优势,优质胚胎率(22.4%vs8.0%)、胚胎卵裂率(D2:64.6%vs47.7%,D3:53.0%vs33.3%)均优于慢速程序化冷冻。Cao等[6]也报道玻璃化冷冻卵子的存活率(91.8%vs61.0%)、卵裂率(78%vs54.4%)、优质胚胎率(42.3%vs24.0%)、囊胚形成率(33.1%vs12.0%)均高于慢速程序化冷冻。本研究中程序化冷冻组优质胚胎率(41.07% vs30.23%,P<0.05)和囊胚形成率(13.33%vs6.98%)均高于玻璃化冷冻组。可能的原因:①不同生殖中心程序化冷冻复苏率和妊娠结局相差较大,本中心多年来一直以程序化冷冻作为胚胎冷冻的主要方法,技术稳定,本研究采用改良的冷冻试剂盒,已应用于临床胚胎冻融,其效果优于玻璃化冷冻胚胎,故开始研究其对卵子冻融后的效果,结果符合预期,预示程序化冷冻卵子有较好的发育潜能。②玻璃化冷融卵子时,暴露于最后的冷冻保护剂的时间长短,围绕卵子的冷冻保护剂剂量的不同,操作的熟练程度等因素存在更多不稳定性,更有文献报道,玻璃化冷冻保护剂中高浓度的DMSO可损坏卵膜上的微绒毛,以及引起微丝数量减少、解聚和变短,从而影响卵子的受精和发育潜能[7],使得研究结果与上述文献结果差异较大。我们已开始进行更大样本量的试验,以验证本研究结果,为改善卵子冷冻方法并应用于临床做准备。
[1]高明,章志国,曹云霞.人类卵子冷冻技术的进展[J].国际生殖健康/计划生育杂志,2013,32(6):475-478.
[2]王长华,朱元,伍琼芳,等.卵子玻璃化冷冻技术在IVFET中的应用[允].江西医药,2013,48(3):205-207.
[3]杜娟,周从容.高浓度玻璃化冷冻剂对卵子冷冻复苏及发育潜能的影响[J].贵阳医学院学报,2011,36(6):579-581.
[4]李莉,丛林,曹云霞等.蔗糖浓度及ICSI前培养时间对人卵母细胞慢速冷冻影响的初步研究[J].生殖与避孕,2007,27(9):585-588.
[5]Cobo A,Diaz C.Clinical application of oocyte vitrification:a systematic review and meta-analysis of randomized controlled trials[J].Fertil Steril,2011,96(2):277-285.
[6]Cao YX,Xing Q,Li L.Comparison of survival and embryonic development in human oocytes cryopreserved by slow freezing and vitrification[J].Fertil Steril,2009,92(4):1306-1311.
[7]李梅,陈子江.不同成熟期人卵冷冻保存研究中的争议问题[允].中国计划生育和妇产科,2013,5(2):13-16.
(收稿:2015-01-20 修回:2015-03-17)
浙江大学医学院附属妇产科医院(杭州 310000)
