上调miRNA145对肝癌细胞的作用及其机制研究*
2015-03-30王寰昱王亚峰张昆松张朝晖张梓健黄陕州彭宝岗中山大学附属第一医院肝胆外科广东广州50080河南省人民医院肝胆外科河南郑州450000
王寰昱,王亚峰,张昆松,张朝晖,张梓健,黄陕州,吴 健,彭宝岗,陈 东△,周 奇△(中山大学附属第一医院肝胆外科,广东广州50080;河南省人民医院肝胆外科,河南郑州450000)
上调miRNA145对肝癌细胞的作用及其机制研究*
王寰昱1▲,王亚峰2▲,张昆松1,张朝晖1,张梓健1,
黄陕州1,吴健1,彭宝岗1,陈东1△,周奇1△
(1中山大学附属第一医院肝胆外科,广东广州510080;2河南省人民医院肝胆外科,河南郑州450000)
[摘要]目的:探讨微小RNA145 (miRNA145)对肝癌细胞生长、凋亡及侵袭转移的影响。方法:实验将HepG2细胞随机设置为3组:空白对照组、空质粒组及转染组,转染后real-time PCR法检测验证各组细胞miRNA145及N-钙黏蛋白(N-cadherin) mRNA的表达,并用Western blot检测miRNA145目标蛋白N-钙黏蛋白的表达,MTS增殖实验检测各组细胞的生长情况,流式细胞术检测细胞周期及细胞凋亡率,Transwell法检测各组细胞的侵袭转移能力。结果: Real-time PCR结果证实转染组细胞miRNA145表达比空质粒组和空白对照组细胞明显增多(P<0.05),同时N-钙黏蛋白的表达在转染组细胞中显著减少(P<0.05) ;经Western blot结果证实,转染组细胞中N-钙黏蛋白表达比空质粒组和空白对照组细胞明显减少(P<0.05) ;转染组细胞活性在转染后第2天、第3天均明显下降,70.04%的细胞周期停止在G1期,转染后HepG2细胞凋亡率明显增高,细胞的侵袭转移能力下降,差异均有统计学意义。结论:上调miRNA145表达能有效抑制肝癌细胞的细胞周期进展和侵袭转移,促进细胞凋亡。
[关键词]微小RNA145;肝细胞癌;细胞增殖;细胞凋亡;细胞侵袭
[修回日期]2015-05-04
▲并列第1作者
Role of up-regulated microRNA145 in viability,apoptosis,invasion and metastasis of hepatoma cells
WANG Huan-yu1,WANG Ya-feng2,ZHANG Kun-song1,ZHANG Chao-hui1,ZHANG Zijian1,HUANG Shan-zhou1,WU Jian1,PENG Bao-gang1,CHEN Dong1,ZHOU Qi1
(1Department of Hepatobiliary Surgery,The First Affiliated Hospital of Sun Yat-sen University,Guangzhou 510080,China;2Department of Hepatobiliary Surgery,Henan Provincial People’s Hospital,Zhengzhou 450000,China.E-mail: hnzhouqi @163.com; gzbobsums@ gmail.com)
[ABSTRACT]AIM: To investigate the effects of microRNA145 (miRNA145) on the viability,apoptosis,invasion and metastasis of hepatoma HepG2 cells.METHODS: HepG2 cells were randomly allocated into 3 groups: blank control group,empty mimic transfected group and miRNA145 mimic transfected group.Under the induction of LipofectamineTM2000,the recombinant was transfected into HepG2 cells.After transfection,the expression level of miRNA145 was detected by real-time PCR.The protein level of N-cadherin and the mRNA expression levels of miRNA145 and N-cadherin were detected by Western blot and real-time PCR.The cell viability was detected by MTS assay.The cell cycle and apoptosis were analyzed by flow cytometry.Invasion and metastasis were detected by Transwell assay.RESULTS: Compared with negative control,miRNA145 expression was up-regulated significantly,while the expression of N-cadherin was down-regulated significantly.Meanwhile,the cell viability,cell cycle,apoptosis,invasion and metastasis of hepatoma HepG2 cells were all significantly inhibited (P<0.05).CONCLUSION: miRNA145 dramatically inhibits viability,apoptosis,invasion and metastasis of hepatoma cells.
[KEY WORDS]MicroRNA145; Hepatocellular carcinoma; Cell proliferation; Apoptosis; Cell invasion
肝细胞癌(hepatocellular carcinoma,HCC)是癌症中致死率较高的一种,尽管在过去的几十年中,肝癌的各治疗手段取得了显著的进步,但患者的5年生存率仍然较低[1],这与HCC具有较高的增殖侵袭迁移能力有关。微小RNA (mircroRNA,miRNA)是近年来新发现的、广泛存在于真核生物体内的一类保守的非编码单链小分子RNA,长度约22个核苷酸,主要通过与靶mRNA的3’UTR完全或不完全碱基配对,引起靶mRNA降解或者抑制其翻译,从而调控靶基因的表达,调控个体发育、细胞凋亡、增殖及分化[2]。严斌等[3]研究发现,miRNA145在肝癌细胞及肝癌组织中的低表达,可能与HCC的发生发展密切相关。近年来随着研究的不断深入,miRNA145在多种恶性肿瘤中,如直肠癌、膀胱癌[4-6]等,通过对各目标蛋白的控制来调节肿瘤的生长、增殖、凋亡和侵袭能力。本实验就miRNA145对人肝癌HepG2细胞增殖、凋亡、侵袭和转移的影响做初步探讨。
材料和方法
1主要材料
人肝癌细胞株HepG2由中山大学附属第一医院外科实验室提供。
细胞培养基DMEM和胎牛血清购自HyClone; miR145模拟物购自广州锐博生物科技有限公司; LipofectamineTMRNAiMAX转染试剂购于Invitrogen; Opti-MEM培养基购于Gibco;单溶液细胞增殖检测试剂购于Promega;细胞凋亡检测试剂盒和细胞周期检测试剂盒购于KeyGEN; N-钙黏蛋白(N-cadherin)兔抗人多克隆抗体购于CST; II抗用武汉博士德生物工程有限公司的过氧化物酶标记羊抗兔IgG。
2主要方法
2.1细胞培养和转染HepG2细胞在含10%胎牛血清的DMEM培养基中,37℃、5% CO2、饱和湿度条件下培养,1~2 d换液1次。取对数生长期细胞接种于6孔板,设置空白对照组(control)、空模拟物转染组即阴性对照组(negative control-miRNA145,NC-miRNA145)和miRNA145模拟物(miRNA145-mimic)转染组。基因转染步骤按LipofectamineTMRNAiMAX转染试剂盒说明书进行,转染后24 h荧光显微镜下根据荧光蛋白的表达观察转染效率。
2.2 Real-time PCR检测细胞miRNA145及N-钙黏蛋白的表达转染后36 h收集各组细胞,按TRIzol法提取细胞总RNA,用分光光度计和琼脂糖凝胶检测总RNA纯度和完整性。总RNA用逆转录反应合成cDNA后,用SYBR Green qPCR Super Mix和SYBR Green microRNA Assay Kit检测样本中的miR NA145含量。采用的miRNA145正向引物为5’-AC ACTCCAGCTGGGGTCCAGTTTTCCCAGGAA-3’,反向引物为5’-CTCAACTGGTGTCGTGGA-3’; N-cadherin的正向引物为5’-TCAGGCGTCTGTAGAGGCTT-3’,反向引物为5’-ATGCACATCCTTCGATAAGACTG-3’;内参照U6的正向引物为5’- CTCGCTTCG GCAGCACA-3’,反向引物为5’-AACGCTTCA-CGAA TTTGCGT-3’。反应条件50℃2 min;95℃2 min;95 ℃15 s,60℃32 s,40循环。反应结束后得到各个标本和内参照U6的基本循环数(Ct值)。根据公式计算目的基因相对含量(RQ值),即为RNA相对含量,实验重复3次。
2.3 Western blot验证N-钙黏蛋白的表达各组细胞用PBS洗涤后低速离心后弃去上清,加入细胞裂解液及蛋白酶抑制剂,冰上充分裂解细胞30 min离心后,取上清到新的EP管中。用BCA蛋白定量试剂盒分别测定各组细胞提取的总蛋白浓度后行SDSPAGE,180 mA恒流转移蛋白至醋酸纤维素膜上,5%脱脂奶粉封闭后,加入I抗,4℃摇床孵育过夜,封闭液洗涤3次分别加入HRP标记II抗,室温下温育1 h,发光试剂作用后,暗室曝光,经显影、定影处理后,以GAPDH作为内参照。用ImageJ软件分析各蛋白区带的灰度值,并用各组细胞所得的灰度值与GAPDH蛋白对应区带的灰度值比较分析蛋白的表达量。
2.4 MTS实验检测细胞活力以每孔1×104个接种于96孔板,转染后收集各组细胞,每组分为0、12、24、48和72 h 5个时点,每个时点设置3个复孔。细胞贴壁后,每孔加入10 μL MTS孵育4 h,酶标仪读板,MTS检测读取490 nm波长处吸光度(A)值,检测3组细胞不同时间存活情况,绘制细胞存活曲线。
2.5流式细胞仪检测细胞周期及细胞凋亡率转染后收集各组细胞,制成单细胞悬液,PBS洗涤2次,70%的乙醇固定过夜。按试剂盒操作说明书指导加相应试剂,4℃避光放置30 min,流式细胞仪检测各组细胞周期;同样方法收集、洗涤细胞,无须乙醇固定,按操作说明采用Annexin V/PI双染,避光放置10 min,流式细胞仪检测各组细胞凋亡率。实验重复3次。
2.6 Transwell法检测细胞的侵袭转移能力转染后收集各组细胞,无血清DMEM培养基制成单细胞悬液(1×105)加入Transwell小室上室,在下室加入600 μL完全培养基。37℃、5% CO2孵育24、48 h分别取出小室,4%多聚甲醛固定15 min,结晶紫染色10 min,检测细胞是否穿过小孔,若细胞穿过,则立即终止所有实验组,拍照并统计。同样方法收集单细胞悬液,加入到预先用Matrigel凝固过的Transwell小室中,37℃、5% CO2孵育48 h后取出小室,多聚甲醛固定染色,拍照统计。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 17.0统计软件进行t检验及单因素方差分析,以P<0.05为差异有统计学意义。
结果
1荧光显微镜下观察转染率
miRNA145-mimic组、NC-miRNA145组经转染24 h后,于倒置荧光显微镜下观测各组细胞荧光表达,转染效率均在70%以上,而control组未见荧光表达,见图1。
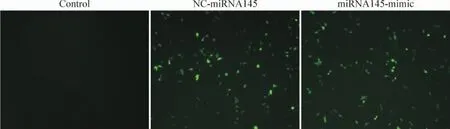
Figure 1.Observation of transfection efficiency under the fluorescence microscope (×200).图1荧光显微镜下观察转染效率
2 Real-time PCR转染后miRNA145的表达情况
分别提取miRNA145-mimic、NC-miRNA145和control组的HepG2细胞的总RNA,检测总RNA纯度和完整性,可见5S rRNA、18S rRNA和28S rRNA的条带明亮、清晰、边缘锐利,且28S的亮度大约是18S的2倍以上,说明所提取的总RNA有较好的完整性,见图2。对RNA样品进行紫外分光光度分析(A260/A280=1.9),表明RNA具有较高的纯度。后通过逆转录得到相应cDNA,以其作为模板对miRNA145和N-钙黏蛋白进行扩增,在mRNA水平分别检测各组miRNA145和N-钙黏蛋白表达情况的差异。结果发现,转染miRNA145模拟物的HepG2细胞的miRNA145表达比转染NC-miRNA145和未转染的HepG2细胞明显增多,差异有统计学意义(P<0.05)。N-钙黏蛋白基因在转染miRNA145模拟物的HepG2细胞的表达比转染NC-miRNA145和未转染的HepG2细胞明显减少,差异有统计学意义(P<0.05),见图3。
3 Western blot法验证转染后N-钙黏蛋白的表达情况
分别提取3组HepG2细胞的总蛋白,用Western blot比较3组miRNA145蛋白表达水平的差异,结果显示,转染miRNA145模拟物的HepG2细胞,其N-钙黏蛋白表达水平比转染空模拟物组和未转染组的HepG2细胞明显减少(P<0.05),结果与PCR结果一致,见图4。
4转染miRNA145对肝癌细胞活力的抑制作用
细胞在490 nm处吸光度越高,表明其细胞活性越高。如表1所示,在第2、3天时转染组A值显著低于对照组(P<0.05)。通过MTS实验,将各组A值的均值绘制成曲线,反映各个时点细胞的活性情况,发现在第2、3天时,转染组细胞活性显著低于空白对照组和空载体转染组(P<0.05),见图5。
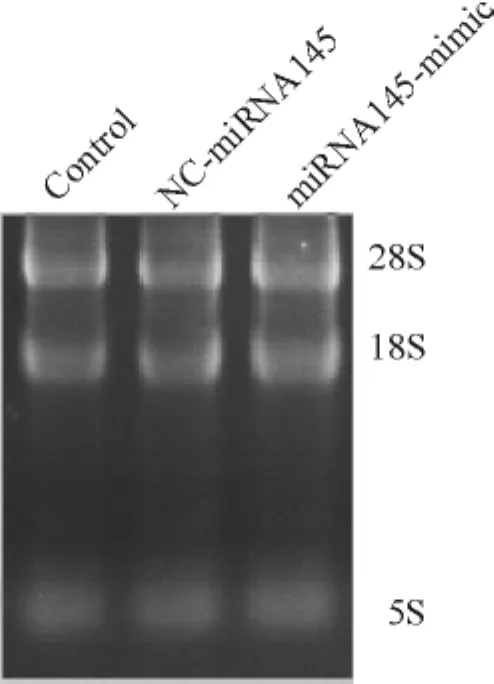
Figure 2.Result of the total RNA electrophoresis.图2各组细胞的总RNA琼脂糖凝胶电泳图
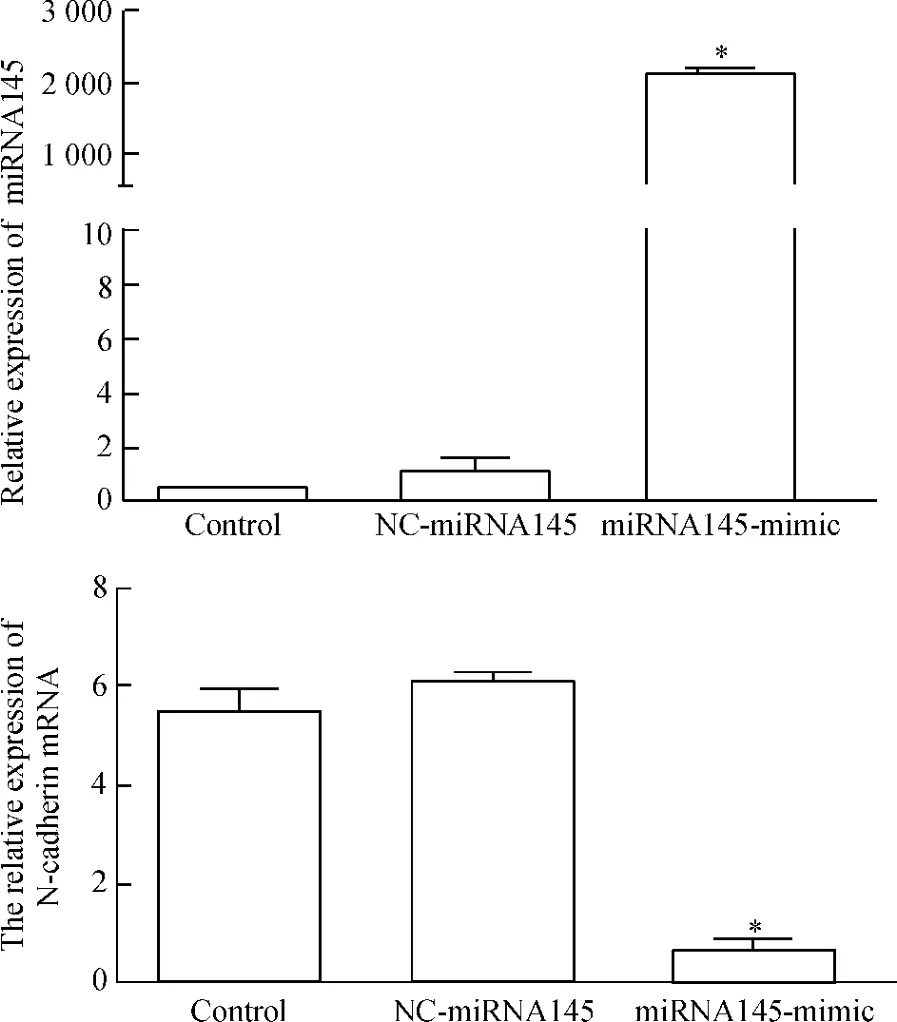
Figure 3.Real-time PCR analysis of miRNA145 and N-cadherin expression 36 h after transfection.Mean±SD.n=3.*P<0.05 vs control.图3 Real-time PCR定量分析miRNA145及N-cadherin在各组细胞中的表达
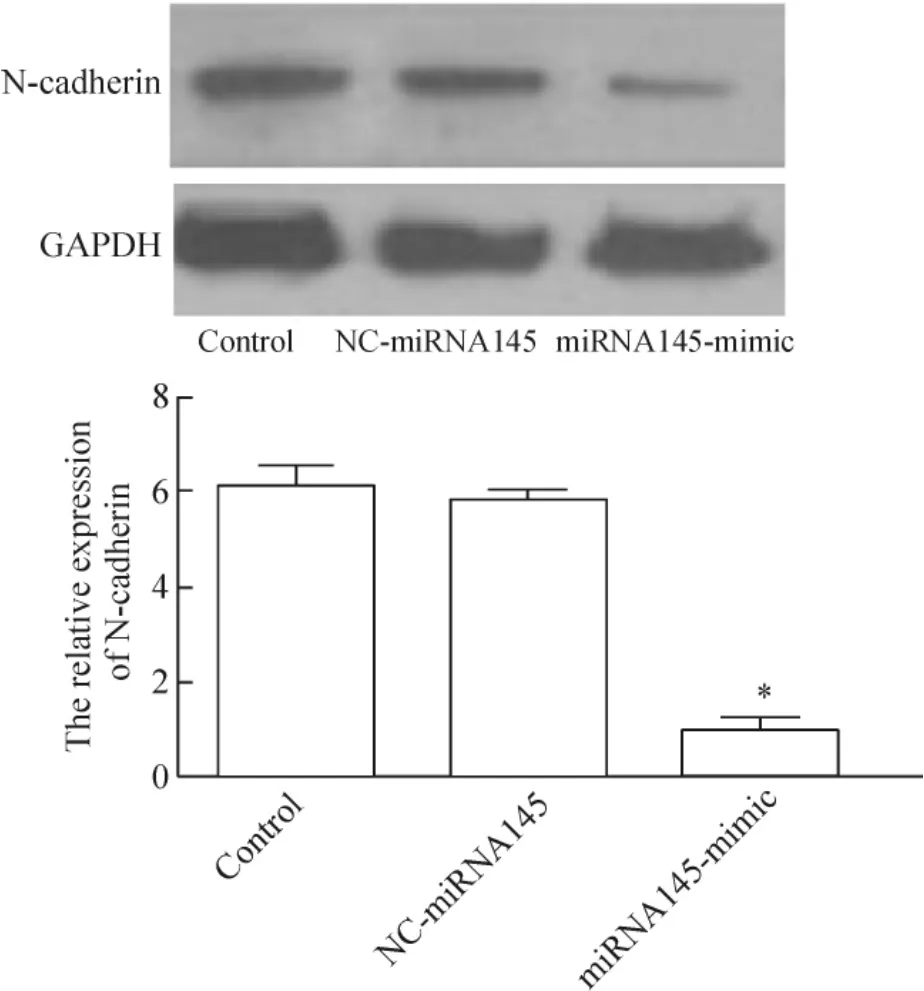
Figure 4.Western blot analysis of N-cadherin expression 36 h after transfection.Mean±SD.n=3.*P<0.05 vs control.图4 Western blot分析各组N-钙黏蛋白的表达情况
5转染后各组细胞的细胞周期及凋亡率的变化
空白对照组、空载体转染组和miRNA145质粒转染组G1期峰细胞比例分别为64.75%、65.93%和 70.04%,miRNA145质粒转染组G1期的细胞数目明显增加(P<0.05),见图6;3组细胞的总凋亡率分别为3.22%、3.31%和4.78%,miRNA145质粒转染组与空白对照组和空载体转染组相比较细胞凋亡率增加(P<0.05),见图7。

Figure 5.The effect of miRNA145 on the viability of hepatoma cells.Mean±SD.n=3.*P<0.05 vs control.图5 MTS实验分析miRNA145对人肝癌细胞活力的影响
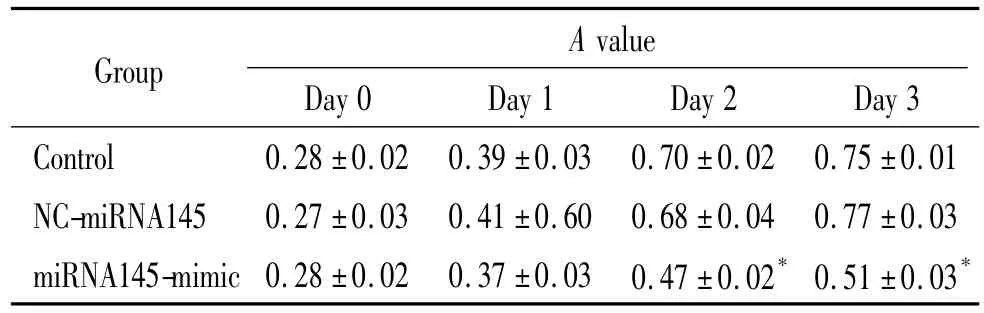
表1 miRNA145对肝癌细胞不同时点细胞活力的作用Table 1.The effect of miRNA145 on the viability of hepatoma cells at different time points (Mean±SD.n=3)
6转染后细胞的侵袭转移能力
Transwell体外迁移实验结果,显微镜下计下室细胞个数并拍照,每种细胞每次随机选取10个视野计数后取平均值绘制条形图,转染miRNA145的HepG2穿膜细胞数较转染空模拟物的HepG2穿膜细胞数明显减少(P<0.05),见图8。
Transwell体外侵袭实验结果,显微镜下计穿出细胞个数并拍照,每种细胞每次随机选取10个视野计数后取平均值绘制条形图,转染miRNA145的HepG2穿膜细胞数较转染空模拟物的HepG2穿膜细胞数明显减少(P<0.05),见图9。
讨论

Figure 6.The cell cycle of the HepG2 cells in each group after transfection.Mean±SD.n=3.*P<0.05 vs control.图6流式细胞仪检测转染后3组细胞的G1期峰细胞比例情况
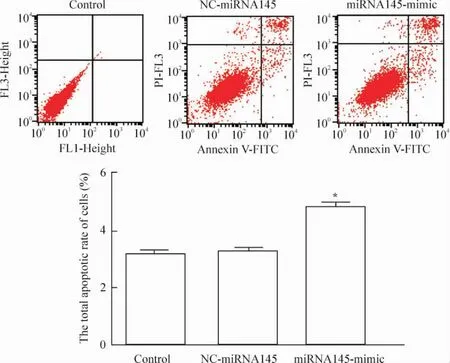
Figure 7.The apoptotic rate of the HepG2 cells in each group after transfection.Mean±SD.n=3.*P<0.05 vs control.图7流式细胞术检测转染后各组细胞凋亡率的变化
HCC恶性程度高,预后差,即使采用手术联合化疗的治疗方案,治疗效果仍不佳,术后HCC高复发率和转移是影响患者治疗效果和预后的关键因素,迫切需要寻求新的有效的治疗靶点。miRNA具有广泛的基因调节功能,能对基因活动的各个环节进行调节,参与一系列的生物学进程如胚胎的发育、细胞增殖、细胞凋亡和能量代谢等[7]。已有学者证实miRNA在肝癌的发生、发展过程中发挥癌基因或抑癌基因样的作用(如miRNA-181b)[8];另肝癌的生物学行为和一些miRNA家族成员(如miRNA-155、miRNA-101)有密切的关系[9]。
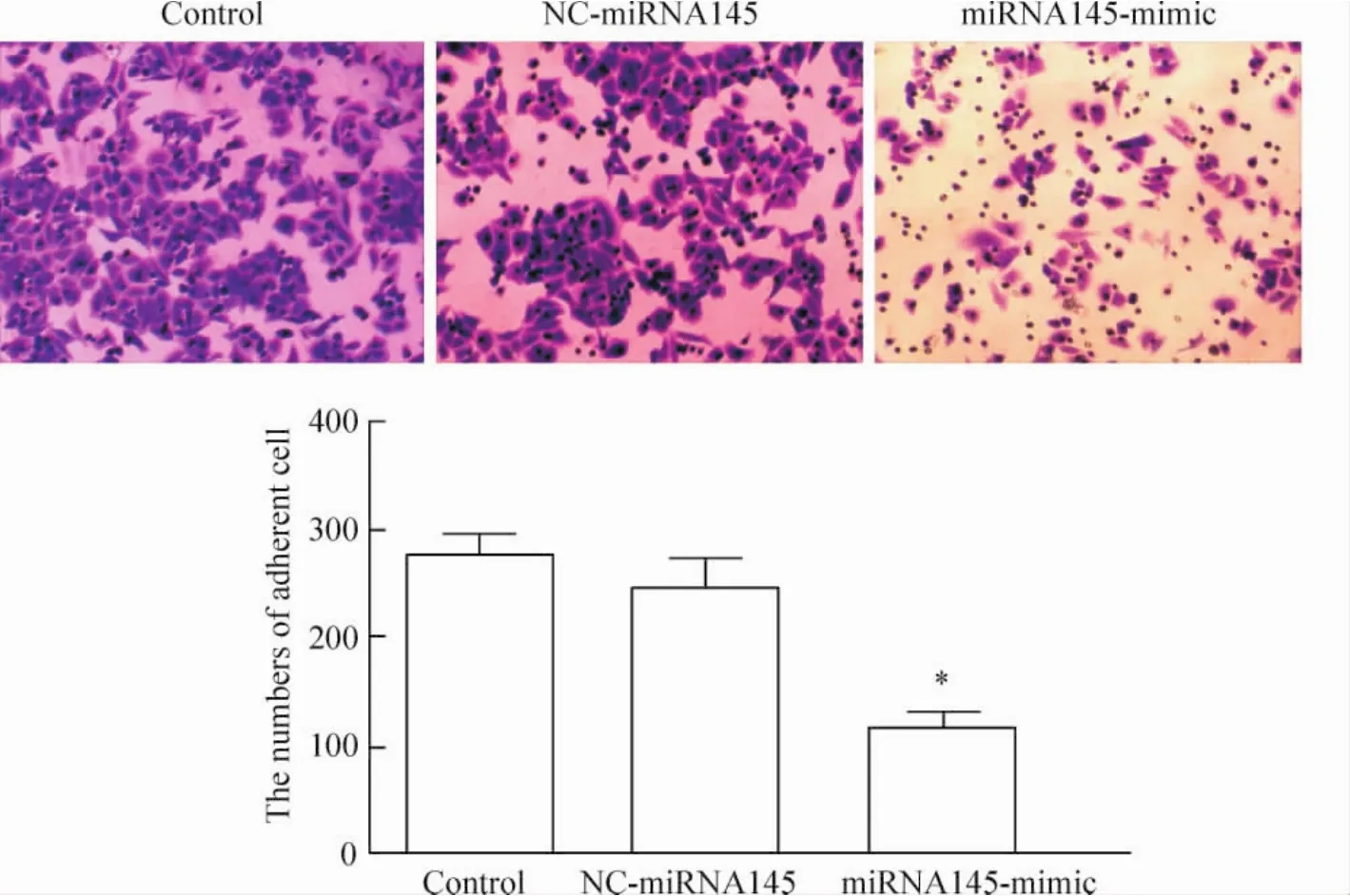
Figure 8.The results of Transwell metastatic test showed the metastatic ability of HepG2 cells (×200).Mean±SD.n=3.*P<0.05 vs control.图8 Transwell体外迁移实验
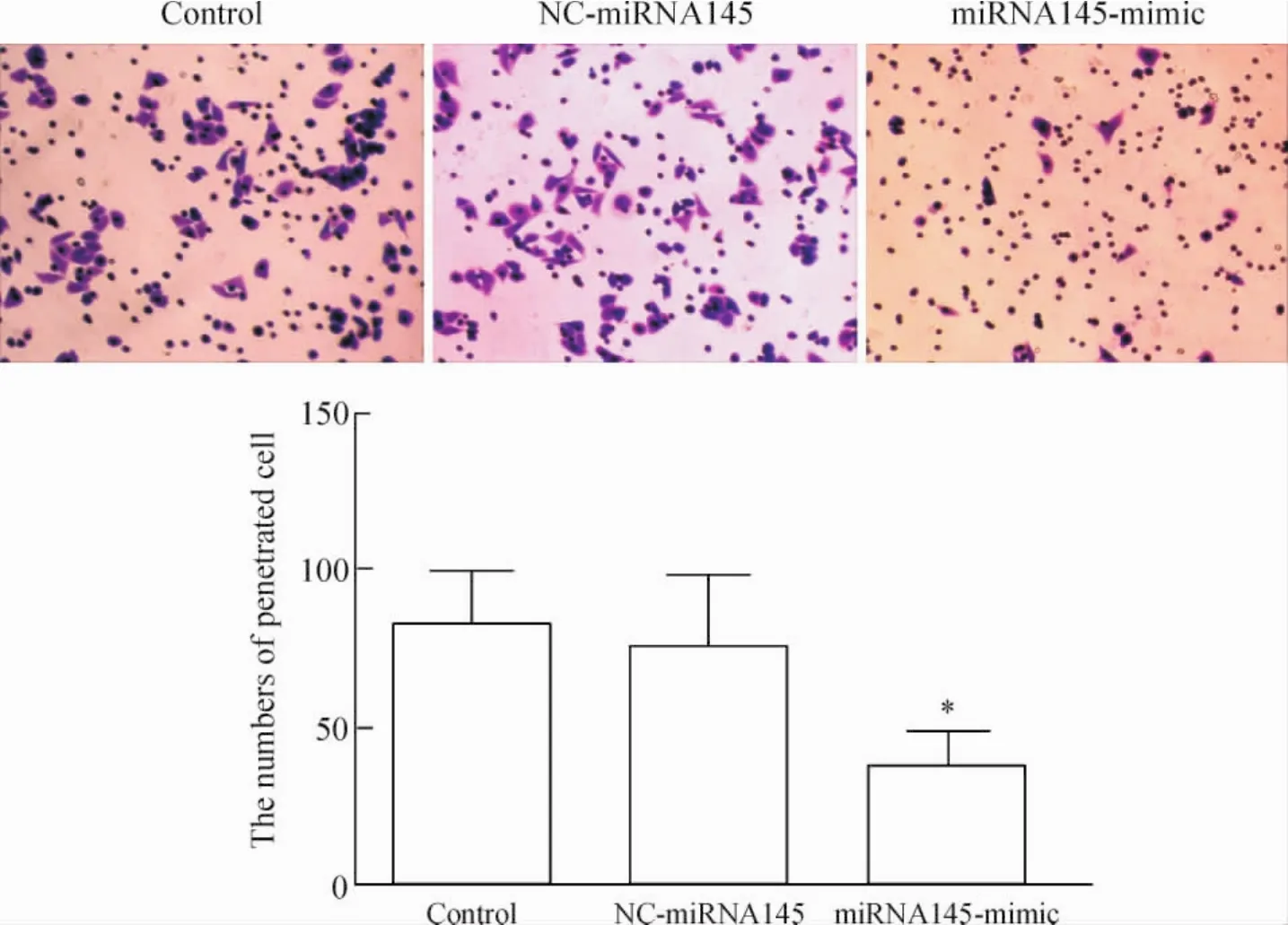
Figure 9.The results of Transwell invasion test showed the invasive ability of HepG2 cells (×200).Mean±SD.n=3.*P<0.05 vs control.图9 Transwell侵袭实验结果
miRNA145是近年来新发现的一类具有肿瘤抑制作用的microRNA,可在多种组织中广泛表达。2003年Michael等[10]首先在人结肠肿瘤中发现miRNA145低表达,认为其可能与肿瘤发生密切相关。miRNA145定位于5号染色体(5q32-33),其附近的5q31是一个非常重要的脆性位点。脆性位点通常在体细胞中稳定,但在许多肿瘤细胞中经常发生缺失或重排。位于脆性位点附近的miRNA145已被证实在多种肿瘤组织中低表达。研究发现在膀胱癌及直肠癌中,miRNA145目标作用于N-钙黏蛋白、波形蛋白(vimentin)等可抑制恶性肿瘤细胞的上皮间质转化[6,11]。Sachdeva等[12]研究发现miRNA145除具有肿瘤生长抑制作用外,而且对肿瘤细胞的侵袭转移能力有明显的抑制作用。目前越来越多研究结果显示miRNA145具有调控多个靶基因,尤其是N-cadherin、vimentin等肿瘤细胞上皮间质转化基因,可以通过调节这些靶基因从而影响细胞的间质转化,抑制其侵袭转移[11]。
严斌等[3]研究发现通过对临床标本的检测发现miRNA145在肝癌中的表达显著低于正常组织及癌周组织,这与Varnholt等[13]的研究结果一致,提示该小分子RNA在肝细胞癌的发生发展过程中起着负调控的作用。
为了探索miRNA145在肝细胞癌中的作用机制,在本研究中,我们通过转染技术在HepG2细胞中高表达miRNA145,首次发现在肝细胞癌中miRNA145作用于N-cadherin基因,并通过real-time PCR 及Western blot验证其发挥抑制N-cadherin表达作用。随后在Transwell侵袭转移实验中,我们发现转染组细胞的侵袭迁移能力明显减弱,穿膜细胞下降。这些结果提示miRNA145可以通过改变肿瘤细胞表面的黏附分子表达(如调控上皮间质转化过程)而抑制肝癌细胞的迁移侵袭。于此同时,在MTS实验中,我们发现转染组的存活细胞显著少于空白对照组,随后通过流式细胞仪对各组细胞的周期和凋亡率进行分析,发现miRNA145表达增高可以使细胞周期停止在G1期;且转染组细胞的凋亡数目及凋亡率均显著增高。由此,我们认为miRNA145能够抑制肝细胞癌的细胞周期进展、迁移侵袭,最终导致肿瘤细胞凋亡的增加。那么miRNA145可以靶向作用于N-cadherin,是否也能作用于其它黏附分子基因呢? miRNA145是通过什么具体作用机制抑制肝细胞癌的周期进展呢?这些都尚待进一步的研究。目前对肝癌仍采取以手术切除为主的治疗方法,而术后出现复发和转移是患者治疗失败和死亡的主要原因。miRNA介导肿瘤分子治疗将可能成为根治肿瘤的重要发展方向。鉴于miRNA145在肿瘤中的抑癌基因作用,可通过上调miRNA145表达,抑制肿瘤细胞上皮间质转化的能力,从而减少肿瘤耐药,实现抑制肿瘤生长和侵袭转移的治疗目的。但这个设想离临床应用尚远,仍需进一步探索肝癌中miRNA145的生物学意义,miRNA145与靶基因相互作用机制miRNA安全性问题的研究。
综上所述,上调miRNA145能明显降低人肝癌细胞的生长、侵袭转移能力,促进细胞凋亡。随着人们对靶向治疗肝细胞癌的需求不断提高,miRNA145调控肝细胞癌的临床价值令人充满期待。
[参考文献]
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2) : 69-90.
[2]Volk N,Shomron N.Versatility of microRNA biogenesis [J].PLoS One,2011,6(5) : e19391.
[3]严斌,李艳兵,吕兴,等.Mir-145在肝癌细胞及肝癌组织中的表达及其意义[J].中华实验外科杂志,2011,28(5) : 707-709.
[4]Chen X,Gong J,Zeng H,et al.MicroRNA145 targets BNIP3 and suppresses prostate cancer progression[J].Cancer Res,2010,70(7) : 2728-2738.
[5]Shi B,Sepp-Lorenzino L,Prisco M,et al.Micro RNA 145 targets the insulin receptor substrate-1 and inhibits the growth of colon cancer cells[J].J Biol Chem,2007,282 (45) : 32582-32590.
[6]Singh N,Liu G,Chakrabarty S.Isolation and characterization of calcium sensing receptor null cells: a highly malignant and drug resistant phenotype of colon cancer [J].Int J Cancer,2013,132(9) : 1996-2005.
[7]Esquela-Kerscher A,Slack FJ.Oncomirs-microRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(4) : 259-269.
[8]赵文健,杨亮,李坚,等.miR-181b对肝癌HepG2细胞增殖以及Bcl-2和SP1蛋白表达的影响[J].中国病理生理杂志,2010,26(11) : 2106-2111.
[9]Xu LB,Beckebaum S,Iacob S,et al.MicroRNA-101 inhibits human hepatocellular carcinoma progression through EZH2 downregulation and increased cytostatic drug sensitivity[J].J Hepatol,2014,60(3) : 590-598.
[10]Michael MZ,Sm OC,Van Holst Pellekaan NG,et al.Reduced accumulation of specific microRNAs in colorectal neoplasia[J].Mol Cancer Res,2003,1(12) : 882-891.
[11]Ren D,Wang M,Guo W,et al.Wild-type p53 suppresses the epithelial-mesenchymal transition and stemness in PC-3 prostate cancer cells by modulating miR145[J].Int J Oncol,2013,42(4) : 1473-1481.
[12]Sachdeva M,Mo YY.MicroRNA-145 suppresses cell invasion and metastasis by directly targeting mucin 1[J].Cancer Res,2010,70(1) : 378-387.
[13]Varnholt H,Drebber U,Schulze F,et al.MicroRNA gene expression profile of hepatitis C virus-associated hepatocellular carcinoma[J].Hepatology,2008,47(4) : 1223-1232.
通讯作者△Tel: 020-87755766;周奇E-mail: hnzhouqi@163.com;陈东E-mail: gzbobsums@ gmail.com
*[基金项目]国家自然科学基金资助项目(No.81402504) ;广东省科技计划(No.2012B061700090) ;广州市科技计划(No.201300000187) ;大亚湾科技计划(No.2013A01016; No.2014A01012)
[收稿日期]2015-03-30
[文章编号]1000-4718(2015)06-1019-07
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.010
