钙网蛋白介导线粒体损伤在高糖诱导心肌细胞凋亡中的作用*
2015-03-30刁佳宇朱延河谭武红
闫 蕊,单 虎,林 琳,刁佳宇,张 明,朱延河,谭武红,魏 瑾△
(西安交通大学第二附属医院1心血管内科,2地方病科,3呼吸内科,陕西西安710004;4西安交通大学环境与疾病相关基因教育部重点实验室,微量元素与地方病卫生部重点实验室,陕西西安710061)
钙网蛋白介导线粒体损伤在高糖诱导心肌细胞凋亡中的作用*
闫蕊1,2,单虎1,2,林琳1,2,刁佳宇1,2,张明3,朱延河4,谭武红4,魏瑾1,2△
(西安交通大学第二附属医院1心血管内科,2地方病科,3呼吸内科,陕西西安710004;
4西安交通大学环境与疾病相关基因教育部重点实验室,微量元素与地方病卫生部重点实验室,陕西西安710061)
[摘要]目的:观察高糖培养对心肌细胞钙网蛋白(calreticulin,CRT)表达的变化、线粒体功能和细胞凋亡的影响。方法:将培养的AC-16人心肌细胞随机分为正常糖浓度组、高糖组、高糖+ CRT siRNA(small interfering RNA)组及等渗组,分别测定各组心肌细胞凋亡率、细胞内活性氧水平、线粒体功能和CRT表达水平的变化。结果:与正常糖浓度培养的心肌细胞相比,高糖组心肌细胞凋亡率增加,活性氧生成增多,线粒体膜电位及呼吸链酶活性降低,同时CRT表达升高; CRT siRNA可以减轻高糖组心肌细胞线粒体损伤,但细胞内活性氧的生成与高糖组相比未见显著差异。结论: CRT介导的线粒体损伤可能参与高糖时心肌细胞凋亡的增加。
[关键词]高糖;钙网蛋白;线粒体损伤;细胞凋亡
[修回日期]2015-03-24
Role of calreticulin-induced mitochondrial damage in high glucose-induced apoptosis of myocardial cells
YAN Rui1,2,SHAN Hu1,2,LIN Lin1,2,DIAO Jia-yu1,2,ZHANG Ming3,ZHU Yan-he4,TAN Wu-hong4,WEI Jin1,2
(1Department of Cardiology,2Department of Endemic Disease,3Department of Respiratory Medicine,Second Affiliated Hospital,Xi’an Jiaotong University School of Medicine,Xi’an 710004,China;4Key Laboratory of Environment and Genes Related to Diseases of Ministry of Education,Key Laboratory of Trace Elements and Endemic Disease of Ministry of Health,Xi’an Jiaotong University,Xi’an 710061,China.E-mail: weijin@ mail.xjtu.edu.cn)
[ABSTRACT]AIM: To observe the effect of high glucose on the protein expression of calreticulin (CRT) and its association with cell apoptosis and mitochondrial dysfunction in the cardiomyocytes.METHODS: AC-16 cardiomyocytes were randomly divided into normal glucose group,high glucose group,high glucose+ CRT siRNA group and isotonic control group.The cell apoptotic rate,reactive oxygen species (ROS),mitochondrial membrane potential level,respiratory enzyme activity,and protein expression of CRT were observed.RESULTS: Compared with the cardiomyocytes in normal glucose group,the apoptotic rate and ROS production of cardiomyocytes increased in high glucose group,accompanying with the decreases in the mitochondrial membrane potential level and enzyme activitiy of the respiratory chain.The protein expression of CRT was significantly increased in high glucose group.However,compared with high glucose group,high glucose+ CRT siRNA decreased the expression of CRT and attenuated the damage of mitochondria,but CRT siRNA did not reduce the ROS level in cardiomyocytes.CONCLUSION: High glucose brings about CRT over-expression to induce mitochondrial injury,thus increasing myocardial apoptosis.
[KEY WORDS]High glucose; Calreticulin; Mitochondrial injury; Apoptosis
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病患者中存在的特异性心肌病变[1],随着糖尿病发病率的逐年增高,DCM已逐渐成为慢性心力衰竭发生的重要原因[2-4]。心肌细胞的凋亡被认为是DCM发生的重要病理生理机制,而线粒体是介导细胞凋亡的重要细胞器,在糖尿病患者及动物模型中可观察到心肌细胞线粒体结构、功能及动力学等的异常,提示DCM的发生、发展与心肌细胞线粒体损伤密切相关[5]。高血糖诱导线粒体损伤的机制目前尚不明确,可能与细胞氧化应激损伤及Ca2+超载相关。钙网蛋白(calreticulin,CRT)是主要分布于内质网中的钙结合蛋白,胚胎期高表达,参与维持细胞内Ca2+稳态、细胞黏附、蛋白折叠及细胞凋亡等[6],另外CRT还参与调节线粒体膜电位及钙离子稳态的功能[7]。但CRT介导的线粒体损伤是否参与高糖诱导的心肌细胞凋亡尚不清楚。本研究通过高糖培养心肌细胞观察CRT表达的变化对线粒体功能及细胞凋亡的影响。
材料和方法
1材料
AC-16人心肌细胞由西安交通大学医学院地方病研究所谭武红老师课题组惠赠; DMEM/F12培养基和DMEM低糖培养基(HyClone) ;四季青胎牛血清(浙江天杭) ; CRT单克隆抗体(Abcam) ; DCFHDA活性氧检测探针和JC-1试剂盒(上海碧云天) ; Annexin V-PI凋亡检测试剂盒(BD) ;酶活性检测试剂盒(南京建成) ; CRT siRNA (上海吉玛基因,序列参照文献设计[8])序列为5’-GCAGACAAGCCAGGAUGCACGCUUU-3’,5’-AAAGCGUGCAUCCUGG CUUGUCUGC-3’;倒置相差显微镜(Olympus) ;电泳仪、转膜仪(Bio-Rad) ;分光光度仪(上海天普) ;流式细胞仪(BD)。常规试剂均为国产分析纯。
2方法
2.1细胞培养与分组在含10%胎牛血清及1%青霉素、链霉素溶液的完全培养基中培养AC-16细胞至培养板的50%~60%,为减少血清对细胞生长的影响,给予无血清培养基培养24 h后,将培养细胞分为4组,正常糖(normal glucose,NG)组:培养基葡萄糖浓度为5.5 mmol/L;高糖(high glucose,HG) 组:培养基葡萄糖浓度为33 mmol/L; HG+ CRT siRNA组及等渗对照(isotonic control,IC)组: 5.5 mmol/L葡萄糖联合27.5 mmol/L D-甘露醇培养基,继续培养细胞48 h。
2.2流式细胞术检测细胞凋亡将贴壁的AC-16细胞用0.25%胰酶消化,预冷的PBS溶液洗涤2遍,binding buffer重悬,制成单细胞悬液,调整细胞浓度为1×109/L,取100 μL细胞加入5 μL FITC-Annexin V及5 μL PI工作液,避光室温孵育15 min,应用流式细胞仪检测。
2.3细胞内活性氧簇(reactive oxygen species,ROS)水平的检测按照1∶1 000浓度用无血清培养基稀释DCFH-DA,将贴壁的AC-16细胞用0.25%胰酶消化,PBS洗涤细胞后用DCFH-DA溶液重悬细胞,37℃孵育20 min,无血清培养基洗涤细胞3遍,以除去未进入细胞的DCFH-DA,应用流式细胞仪检测。
2.4线粒体膜电位检测将贴壁的AC-16细胞用0.25%胰酶消化,PBS洗涤细胞,培养基重悬细胞,调整细胞浓度为1×109/L,取0.5 mL单细胞悬液,加入0.5 mL JC-1染色工作液,细胞培养箱中37℃孵育20 min,用JC-1染色缓冲液洗涤2次,再用适量JC-1染色缓冲液重悬后,用流式细胞仪检测,线粒体膜电位较高时呈现红色荧光,线粒体膜电位较低时呈现绿色荧光。
2.5线粒体呼吸酶活性测定按照细胞色素C氧化酶(cytochrome C oxidase,COX)和琥珀酸脱氢酶(succinate dehydrogenase,SDH)活性检测试剂盒说明书操作,选择550 nm和600 nm波长于分光光度计分别检测COX和SDH的活性。
2.6免疫细胞化学观察CRT在心肌细胞的表达将洁净的盖玻片置于24孔板,按每孔1×104接种细胞。各组干预48 h后弃去培养液,PBS溶液洗涤细胞2遍,4%多聚甲醛固定后转移盖玻片至载玻片上。滴加0.5% Triton打孔,3% H2O2消除过氧化物酶。正常山羊血清封闭37℃15 min后,将CRT单克隆抗体以1∶230稀释,4℃孵育过夜;滴加生物素标记的山羊抗兔IgG和辣根酶标记的链酶亲和素,孵育条件均为37℃20min。DAB显色,苏木素复染,中性树胶封片。阴性对照用PBS代替Ⅰ抗。用图像分析软件Image-Pro Plus 6.0及光学显微镜进行图片分析。以细胞质内出现棕黄色颗粒为阳性判断标准。每张切片观察3个高倍视野,每个视野连续数50个细胞,其中阳性细胞数与总细胞百分比即为阳性细胞指数。
2.7免疫蛋白印迹测定细胞CRT含量使用RIPA裂解液提取细胞总蛋白,NanoDrop 2000测定蛋白质浓度,计算50 μg蛋白量进行SDS-PAGE电泳,继而转印到PVDF膜,脱脂奶粉封闭后分别用CRT单克隆抗体(1∶3 000)及β-actin单克隆抗体(1∶3 000) 4℃孵育过夜,PBST洗涤后以相应Ⅱ抗室温孵育2 h,ECL法显影并用CCD相机拍照,采用UVP Software软件分析。以β-actin作为内参照。
3统计学处理
采用SPSS 17.0统计软件分析,数据以均数±标准差(mean±SD)表示,组间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结果
1高糖对心肌细胞凋亡的影响
通过Annexin V-PI双染法检测心肌细胞凋亡可观察到高糖组心肌细胞凋亡率较正常组明显增加(P<0.05) ;与高糖组相比,CRT siRNA可明显减少高糖引起的心肌细胞凋亡增加(P<0.05) ;与对照组相比,高渗组心肌细胞凋亡率无明显增加,见图1。

Figure 1.The apoptosis of AC-16 cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NG group.图1各组心肌细胞的凋亡率
2高糖对心肌细胞ROS产生的影响
应用流式细胞术检测活性氧探针DCFH-DA荧光强度,高糖使细胞内ROS水平增加,荧光强度较正常糖浓度组升高(P<0.05) ;而与高糖组相比,HG+ CRT siRNA组ROS水平有所降低,但差异不存在统计学意义;与对照组相比,高渗组心肌细胞内ROS水平无明显增加(P>0.05),见图2。

Figure 2.The ROS production of AC-16 cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NG group.图2各组心肌细胞内的活性氧荧光强度
3高糖对心肌细胞线粒体膜电位的影响
应用流式细胞术检测线粒体膜电位,高糖组中线粒体膜电位下降的细胞较线粒体膜电位正常的细胞明显增多,相对于正常糖浓度组及等渗对照组差异显著(P<0.05) ;同时与高糖组相比,HG+ CRT siRNA组可以明显降低线粒体膜电位下降心肌细胞的比例(P<0.05),见图3。

Figure 3.The mitochondrial membrane potential (MMP) level of AC-16 cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NG group.图3心肌细胞线粒体膜电位的变化
4高糖对心肌细胞呼吸酶活性的影响
与正常糖浓度组及等渗对照组相比,高糖组线粒体膜COX及SDH的活性明显降低(P<0.05) ; HG+ CRT siRNA可以显著改善高糖引起的线粒体呼吸酶活性的下降(P<0.05),见图4。

Figure 4.The COX and SDH activity of AC-16 cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NG group.图4各组心肌细胞COX及SDH的活性
5高糖诱导心肌细胞CRT表达
正常糖浓度培养基培养心肌细胞仅见少量CRT表达,高糖诱导心肌细胞CRT表达升高,高糖组阳性细胞指数明显高于正常糖组(P<0.05) ;与高糖组及对照组相比,HG+ CRT siRNA组中CRT表达明显降低(P<0.05) ;与对照组相比,高渗条件仅引起CRT表达轻度升高,差异无统计学意义,见图5。
6高糖对心肌细胞CRT表达水平的影响
为量化心肌细胞内CRT表达水平,对提取的心肌细胞总蛋白进行蛋白免疫印迹检测并进行灰度分析,与正常糖浓度组相比,HG+ CRT siRNA组及等渗对照组CRT蛋白的表达仅有轻微变化,差异不显著(P>0.05),而高糖组CRT蛋白表达水平明显升高,差异显著(P<0.05)。
讨论
DCM是糖尿病常见的心血管并发症,是患者出现慢性心力衰竭及心血管病死亡的重要原因[3]。心肌细胞凋亡在DCM发生、发展过程中起着重要作用,研究表明,线粒体功能异常可能参与高糖引起的心肌细胞凋亡[9]。本研究通过在高糖环境中体外培养AC-16心肌细胞发现高糖导致细胞内ROS生成的增加、线粒体膜电位的下降及线粒体COX和SDH酶活性的下降,并伴随着心肌细胞凋亡增加,提示线粒体功能障碍可能参与高糖诱导的心肌细胞凋亡。高糖培养诱导心肌细胞中CRT表达升高,同时应用siRNA抑制高糖诱导的细胞内CRT高表达时可以缓解心肌细胞线粒体损伤,降低心肌细胞的凋亡率。结合既往研究证据我们可以推测CRT过表达介导的线粒体功能障碍可能参与高糖诱导的心肌细胞凋亡。
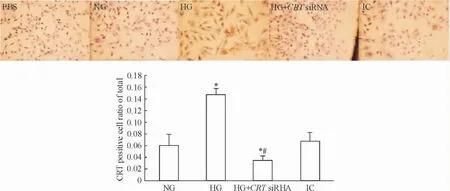
Figure 5.The expression of CRT in AC-16 cardiomyocytes (immunocytochemical staining,×400).Mean±SD.n=3.*P<0.05 vs NG group;#P<0.05 vs HG group.图5各组心肌细胞CRT的表达

Figure 6.The expression of CRT in AC-16 cardiomyocytes.Mean±SD.n=3.*P<0.05 vs NG group;#P<0.05 vs HG group.图6各组心肌细胞CRT的表达水平
CRT是KDEL家族蛋白成员,正常状态下CRT合成后滞留在内质网中,调节细胞内钙稳态[10]。CRT对于心脏发育有着重要意义,CRT敲除小鼠胚胎期出现室壁厚度减低、室壁缺损等并导致死亡[11];出生后CRT表达降低,当CRT过度表达时诱导心肌细胞肥大[12-13],导致心律失常、心腔扩大、心源性猝死等出现[14]。另外,尚有一些报道提示钙网蛋白与心肌缺血再灌注损伤密切相关,陈光献等[15]发现缺血再灌注时CRT表达升高,应用远程预处理模拟缺血预处理下调CRT的表达可减轻缺血再灌注损伤。因此CRT在心血管疾病发病中的作用越来越受到研究者的重视。本研究中我们通过高糖培养心肌细胞并运用免疫细胞化学及Western blot对CRT表达进行检测,证实在高糖诱导心肌细胞凋亡模型中CRT表达增加,提示CRT可能参与高糖诱导心肌细胞凋亡的病理生理过程。Arnaudeau等[7]研究证实在He-La细胞中CRT可降低线粒体中Ca2+浓度进而导致线粒体膜电位下降、线粒体跨膜转运异常进而引起线粒体功能降低。课题组前期建立了呋喃唑酮诱导的扩张型心肌病大鼠模型,发现扩张型心肌病大鼠心肌线粒体功能异常并出现心肌组织CRT表达升高,伴随信号转导子及转录激活子3(signal transducer and activator of transcription 3,STAT3)磷酸化过程受阻;下调CRT表达可以缓解线粒体损伤及STAT3磷酸化过程受阻,提示CRT的过表达亦可通过抑制STAT3磷酸化介导线粒体功能的受损[16]。本研究中高糖诱导心肌细胞CRT过表达时伴有线粒体损伤,而通过CRT siRNA降低高糖诱导的CRT过表达的同时线粒体损伤有所减轻且细胞凋亡率明显下降,提示CRT介导的线粒体损伤与细胞凋亡密切相关。另外,CRT可通过ROS生成等影响线粒体功能,并且Ihara等[17]指出,H9c2细胞CRT高表达可以增加细胞对H2O2的敏感性,提示H2O2诱导的氧化应激介导的细胞凋亡中CRT过表达是关键性的因素。本研究发现在高糖培养的心肌细胞中CRT表达增加、活性氧生成增加呈现一致性改变,同时抑制CRT表达并不能减少细胞内活性氧的生成,因此我们推测高糖环境使得心肌细胞活性氧生成增加,并促进CRT过表达进而导致线粒体损伤,线粒体Ca2+调节异常,MPTP开放,细胞色素C、凋亡诱导因子等释放,介导心肌细胞凋亡,但CRT异常表达导致线粒体损伤的具体机制仍需进一步探讨。
综上所述,高糖条件下,CRT表达增加诱导心肌线粒体损伤可能是心肌细胞凋亡增加的重要原因。本研究为揭示糖尿病心肌病心肌线粒体损伤提供新的理论依据,为糖尿病心肌病发病机制的阐明奠定了理论基础。
[参考文献]
[1]王吉耀,廖二元,胡品津.内科学[M].第8版.北京:人民卫生出版社,2005:341.
[2]Schilling JD,Mann DL.Diabetic cardiomyopathy: bench to bedside[J].Heart Fail Clin,2012,8(4) :619-631.
[3]Dandamudi S,Slusser J,Mahoney DW,et al.The prevalence of diabetic cardiomyopathy: a population-based study in Olmsted County,Minnesota[J].J Card Fail,2014,20 (5) :304-309.
[4]Go AS,Mozaffarian D,Roger VL,et al.Heart disease and stroke statistics-2014 update: a report from the American Heart Association[J].Circulation,2014,129(3) : e28-e292.
[5]Duncan JG.Mitochondrial dysfunction in diabetic cardiomyopathy[J].Biochim Biophys Acta,2011,1813(7) : 1351-1359.
[6]Gold LI,Eggleton P,Sweetwyne MT,et al.Calreticulin: non-endoplasmic reticulum functions in physiology and disease[J].FASEB J,2010,24(3) :665-683.
[7]Arnaudeau S,Frieden M,Nakamura K,et al.Calreticulin differentially modulates calcium uptake and release in the endoplasmic reticulum and mitochondria[J].J Biol Chem,2002,277(48) :46696-46705.
[8]Kusama K,Yoshie M,Tamura K,et al.The role of exchange protein directly activated by cyclic AMP 2-mediated calreticulin expression in the decidualization of human endometrial stromal cells[J].Endocrinology,2014,155 (1) :240-248.
[9]Williamson CL,Dabkowski ER,Baseler WA,et al.Enhanced apoptotic propensity in diabetic cardiac mitochondria: influence of subcellular spatial location[J].Am J Physiol Heart Circ Physiol,2010,298(2) : H633-H642.
[10]Nakamura K,Zuppini A,Arnaudeau S,et al.Functional specialization of calreticulin domains[J].J Cell Biol,2001,154(5) :961-972.
[11]Mesaeli N,Nakamura K,Zvaritch E,et al.Calreticulin is essential for cardiac development[J].J Cell Biol,1999,144(5) :857-868.
[12]Tsutsui H,Ishibashi Y,Imanaka-Yoshida K,et al.Alterations in sarcoplasmic reticulum calcium-storing proteins in pressure-overload cardiac hypertrophy[J].Am J Physiol,1997,272(1 Pt 2) : H168-H175.
[13]单虎,魏瑾,张明,等.钙网蛋白介导的线粒体功能异常参与心肌细胞肥大过程[J].西安交通大学学报:医学版,2014,35(3) :295-299.
[14]Hattori K,Nakamura K,Hisatomi Y,et al.Arrhythmia induced by spatiotemporal overexpression of calreticulin in the heart[J].Mol Genet Metab,2007,91(3) : 285-293.
[15]陈光献,唐白云,梁孟亚,等.远程预处理通过下调钙网蛋白高表达减轻在体大鼠心肌细胞缺血再灌注损伤[J].中国病理生理杂志,2009,25(8) :1469-1473.
[16]Zhang M,Wei J,Shan H,et al.Calreticulin-STAT3 signaling pathway modulates mitochondrial function in a rat model of furazolidone-induced dilated cardiomyopathy[J].PLoS One,2013,8(6) : e66779.
[17]Ihara Y,Urata Y,Goto S,et al.Role of calreticulin in the sensitivity of myocardiac H9c2 cells to oxidative stress caused by hydrogen peroxide[J].Am J Physiol Cell Physiol,2006,290(1) : C208-C221.
通讯作者△Tel: 029-87679770; E-mail: weijin@ mail.xjtu.edu.cn
*[基金项目]国家自然科学基金资助项目(No.81170209; No.30771862)
[收稿日期]2014-11-10
[文章编号]1000-4718(2015)06-0967-06
[中图分类号]R541.8; R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.002
