肾脏去神经对动脉粥样硬化家兔炎症因子的影响*
2015-03-30杨瀚晅卢嘉奕殷跃辉重庆医科大学附属第二医院心内科重庆400010
谭 震,杨瀚晅,卢嘉奕,刘 畅,殷跃辉(重庆医科大学附属第二医院心内科,重庆 400010)
肾脏去神经对动脉粥样硬化家兔炎症因子的影响*
谭震,杨瀚晅,卢嘉奕,刘畅,殷跃辉△
(重庆医科大学附属第二医院心内科,重庆400010)
[摘要]目的:探讨肾脏去神经(renal denervation,RDN)对动脉粥样硬化(atherosclerosis,AS)家兔肿瘤坏死因子α(TNF-α)、白细胞介素1α(IL-1α)和白细胞介素6(IL-6)的影响。方法: 28只雄性新西兰白兔随机分为对照组、RDN后高脂饲养(high-fat diet,HFD)组(RDN组)、假手术后HFD组(假手术组)和单纯HFD组(HFD组),每组7只。测量各组血浆去甲肾上腺素(norepinephrine,NE)、炎症因子及血脂水平;免疫组化检测血管紧张素II (Ang II)的表达,Western blot检测核因子κB(NF-κB)和血管紧张素II 1型受体(AT1R)的表达; real-time PCR检测TNF-α、IL-1α和IL-6 mRNA的表达;光镜下观察肾动脉结构改变和主动脉病理变化。结果: 8周后RDN组NE水平明显低于假手术组和HFD组(P<0.05) ; RDN组血浆甘油三酯(TG)水平低于HFD组(P<0.05) ; RDN组的Ang II蛋白表达低于假手术组和HFD组(P<0.01) ; RDN组NF-κB蛋白表达低于假手术组(P<0.05) ; RDN组TNF-α 和IL-1α的血浆水平低于假手术组和HFD组(P<0.05),RDN组IL-6 mRNA的表达低于假手术组(P<0.01)。结论: RDN能有效抑制全身交感神经活性,降低血浆TG水平,减轻血管炎症反应,延缓动脉粥样硬化的发展。
[关键词]动脉粥样硬化;肾脏去神经;血管紧张素II;核因子κB
[修回日期]2015-03-05
Effects of renal denervation on inflammatory factors in a rabbit model of early atherosclerosis
TAN Zhen,YANG Han-xuan,LU Jia-yi,LIU Chang,YIN Yue-hui
(Department of Cardiology,The Second Affiliated Hospital,Chongqing Medical University,Chongqing 400010,China.E-mail: yinyh63@163.com)
[ABSTRACT]AIM: To evaluate the effects of renal denervation (RDN) on the expression of tumor necrosis factor-α(TNF-α),interleukin-1α(IL-1α) and interleukin-6 (IL-6) in a rabbit model of early atherosclerosis.METHODS: New Zealand male rabbits were divided into control group,RDN+ high-fat diet (HFD) group (RDN group),sham+ HFD group (sham group) and HFD group.The rabbits in later 3 groups were fed with 2% cholesterol for 8 weeks to establish an early atherosclerosis model.The blood samples were collected to test the levels of lipids,norepinephrine (NE),TNF-α,IL-1α and IL-6.The protein expression of angiotensinⅡ(AngⅡ) was detected by the method of immunohistochemistry.The levels of nuclear factor-κB (NF-κB) and Ang II 1 type receptor (AT1R) were evaluated by Western blot.The mRNA expression of TNF-α,IL-1α and IL-6 was determined by real-time PCR.RESULTS: After 1 d of RDN procedure,the NE level was lower in RDN group than that in sham group (P<0.01).After 8 weeks,the NE level was lower in RDN group than that in sham group and HFD group (P<0.05),and triglyceride (TG) was lower in RDN group than that in HFD group (P<0.05).The protein expression of Ang II was decreased in RDN group compared with sham group and HFD group (P<0.01).The protein expression of NF-κB was lower in RDN group than that in sham group (P<0.05).The plasma levels of TNF-α and IL-1α were reduced in RDN group compared with sham group and HFD group (P<0.05).The mRNA expression of TNF-α,IL-1α and IL-6 was reduced in RDN group compared with sham group (P<0.05).CONCLUSION: RDN inhibits sympathetic activity,decreases the plasma level of TG,and alleviates inflammatory reactions in the rabbits with atherosclerosis.
[KEY WORDS]Atherosclerosis; Renal denervation; Angiotensin II; Nuclear factor-κB
随着我国人民生活水平提高和饮食习惯的改变,动脉粥样硬化已经成为我国的主要死亡原因之一,其发病机制尚未明确。炎症学说认为,动脉粥样硬化是一种慢性血管炎性疾病[1],动脉管壁在高血脂的影响下增加脂蛋白的表达(主要是氧化低密度脂蛋白和胆固醇),氧化低密度脂蛋白可损伤动脉内膜导致内皮功能紊乱,从而促进脂质沉积,释放多种炎症因子,启动炎症反应。因此,炎症在动脉粥样硬化的发生发展过程中起着重要作用。有研究发现,血管紧张素Ⅱ(angiotensinⅡ,Ang II)与其1型受体(AT1R)结合后可调节NF-κB表达,可促进炎症、影响平滑肌增殖和迁移、参与血管重塑和细胞凋亡[2]。而肾交感神经在促进肾素的分泌和调节肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)中发挥着重要的作用[3],经导管消融去肾脏交感神经术(renal denervation,RDN)能高选择性阻断肾脏的传入和传出神经,降低全身交感神经活性[4],在治疗顽固性高血压、改善心脏功能等方面已取得了很大进展。本研究通过喂养家兔高脂饲料建立动脉粥样硬化模型,喂养前去除双侧肾脏神经,8周后观察血浆炎症因子水平以及主动脉血管壁病理损伤,探讨RDN是否可以减轻全身炎症反应,从而改善动脉粥样硬化。
材料和方法
1实验动物、主要试剂和仪器
雄性新西兰白兔28只,体重2.0~2.5 kg,由重庆医科大学实验动物中心提供。
兔抗Ang II多克隆抗体(北京博奥森生物) ;鼠抗NF-κB单克隆抗体(Milipore) ;鼠抗tubulin单克隆抗体(武汉三鹰生物) ;兔去甲肾上腺素(norepinephrine,NE)、IL-1α以及IL-6 ELISA试剂盒(上海沪尚) ; TNF-α ELISA试剂盒(HCB) ;兔2步法免疫组化检测试剂盒和浓缩型DAB显色试剂盒(北京中杉金桥生物技术有限公司) ;苯酚(重庆东方化工厂) ; TRIzol试剂盒(TaKaRa) ;兔TNF-α、IL-1α、IL-6 和GAPDH引物(上海生工) ;光学显微镜(Olympus)。
2实验方法
2.1动脉粥样硬化模型的建立和分组28只新西兰白兔随机分成对照(control)组、高脂饲料喂养(high-fat diet,HFD)组、去肾脏神经+高脂饲料喂养(RDN)组及假手术+高脂饲料喂养(sham)组。对照组不做任何处理,采用普通级饲料喂养8周,高脂饲料喂养组予以高脂饲料(含2%胆固醇)喂养8周,肾脏去神经组和假手术组术后予以高脂料喂养8周。所有家兔分笼喂养,自由饮水。本实验研究经重庆医科大学伦理委员会批准。
2.2 RDN手术过程术前禁食12 h,以3%戊巴比妥麻醉兔,胸腹部脱毛,常规消毒铺巾。沿腹旁线逐层切开皮肤、肌肉以及腹膜,腹腔内探查双侧肾脏,经肾门钝性分离肾动脉及肾静脉周围筋膜和脂肪组织并游离肾动脉,以10%苯酚乙醇溶液涂擦肾动脉[5],并用浸润苯酚溶液的无菌纱布包裹双侧肾动脉15 min。逐层缝合并消毒,术后3 d青霉素80万单位每日肌肉注射,假手术组仅开腹,不去肾脏神经,其余操作同RDN组。
2.3主动脉及肾动脉组织学检查8周后使用戊巴比妥麻醉处死家兔,取主动脉根部1 cm以及双侧肾动脉以4 %多聚甲醛固定,石蜡包埋,病理切片(4 μm厚度) ; HE染色,光学显微镜下观察。主动脉标本在200倍镜下随机选取5个视野,测量内膜厚度、中膜厚度以及内膜/中膜厚度比,肾动脉标本观察去神经效果,使用Image-Pro Plus图像分析软件测量分析。
2.4血浆生化指标测定术前、术后1 d、术后第4周末及第8周末分别经后肢静脉采血5 mL,加入含EDTA的抗凝管中,静置30 min后,3 000×g离心15 min,EP管收集血浆,置于-80℃保存。全自动生化仪检测血浆总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C )。ELISA法检测血浆NE、TNF-α、IL-1α及IL-6浓度。
2.5免疫组织化学检测Ang II的含量按照免疫组化检测试剂盒说明书操作,将主动脉石蜡切片脱蜡,洗涤,3 % H2O2室温孵育10 min,加入枸橼酸钠溶液,微波修复10 min,血清室温孵育30 min,I抗4℃孵育过夜,II抗37℃孵育45 min,亲和素-生物素复合物室温孵育60 min,DAB显色,苏木素复染,脱水,透明,封片,光镜下观察,使用Image-Pro Plus图像分析软件计算平均吸光度值。
2.6 Western blot分析NF-κB和AT1R的蛋白表达
取100 mg主动脉组织剪碎,加入裂解液后超声碎裂细胞,4℃、12 000×g离心10 min,吸取上清液,用BCA法测定蛋白浓度,加入1/4体积的5×SDS凝胶加样缓冲液,沸水煮蛋白10 min备用。检测蛋白的表达,每泳道取90μg蛋白,以5%浓缩胶,10%分离胶行SDS-PAGE。250 mA电转,将蛋白质转移至二氟化聚乙烯(polyvinylidene difluoride,PVDF)膜上。采用5%牛血清蛋白(bovine serum albumin,BSA)封闭1 h,加入I抗,4℃孵育过夜。使用PBST洗涤3次,每次10 min。加入II抗,37℃孵育1 h,洗涤3次,每次10 min。然后使用Western blot荧光显影剂显影,采用Quantity One凝胶成像系统进行图像分析。
2.7Real-time PCR取150 mg主动脉组织按TRIzol试剂盒说明书提取总RNA,260 nm处测定总RNA浓度。取1 μg总RNA逆转录(总体系20 μL,37℃15 min; 85℃5 s; 4℃5 min)合成cDNA,-20℃保存。用逆转录产物PCR合成目的基因,IL-1α的上游引物序列为5’-TGTCACCCAACCTCACCTTC-3’,下游引物序列为5’-CATTGGTCTCCAGGTCAACAT-3’; IL-6的上游引物序列为5’-CTTCAGGCCAAGTTCAGGAG-3’,下游引物序列为5’-TGAGGGTGGCTTCTTCATTC-3’; TNF-α的上游引物序列为5’-CGTAGTAGCAAACCCGCAAG-3’,下游引物序列为5’-TTGACCGCTGAAGAGAACCT-3’; GAPDH的上游引物序列为5’-AGAGCACCAGAGGAGGACG-3’,下游引物序列5’-TGGGATGGAAACTGTGAAGAG-3’。反应条件为95℃30 s;95 ℃5 s,60℃30 s,共40个循环。PCR结束后,采用Bio-Rad CFX Manager系统分析结果。
3统计学处理
用SPSS 20.0统计软件进行统计学分析处理。所有数据以均数±标准差(mean±SD)表示。通过重复测量方差分析来比较各组内不同时段的各项指标变化,两组间的比较采用独立样本t检验。多组间的比较采用单因素方差分析,出现显著差异后,采用LSD-t检验进行多重比较,如果数据不满足方差齐性则选用非参数检验Dunnett’s T3。均采用双侧检验,以P<0.05为差异有统计学意义。
结果
1去交感神经情况评价
1.1血浆去甲肾上腺素水平的变化去神经前各组间NE水平无显著差异。第8周末,对照组与术前比无明显变化; RDN组较术前下降(P<0.05) ;假手术组和HFD组较术前显著升高(P<0.05)。去神经术后1 d,RDN组的血浆NE浓度为(126.78±8.88) ng/L,假手术组为(156.84±11.53) ng/L,RDN组显著低于假手术组(P<0.01) ; 4周末RDN组血浆NE浓度为(93.21±10.83) ng/L,明显低于其余组(P<0.01) ;8周末假手术组血浆NE浓度为(172.02± 8.70) ng/L,HFD组为(180.08±10.92) ng/L,对照组为(154.65±5.67) ng/L,RDN组为(123.12± 28.86) ng/L,假手术组和HFD组均高于对照组和RDN组(P<0.05),见图1。
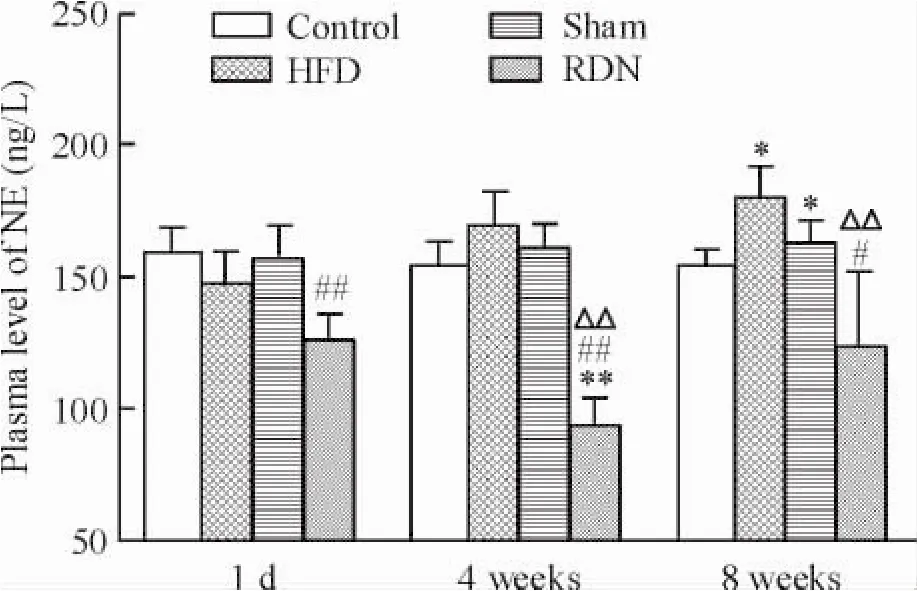
Figure 1.Plasma levels of norepinephrine (NE).Mean±SD.n=7.*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs sham group;△△P<0.01 vs HFD group.图1血浆去甲肾上腺素浓度
1.2肾动脉周围交感神经组织学的变化显微镜下可见,对照组肾动脉结构完整,内膜整齐,神经纤维分布在血管外膜,由髓鞘包裹,施万细胞胞核呈蓝色; RDN组的家兔肾脏神经被剥离和破坏,神经密度明显低于未去神经的家兔,髓鞘不完整,可见施万细胞胞核呈深蓝色,出现碎裂和固缩,见图2、表1。

Figure 2.Photomicrographs of the renal artery with HE staining (×400).图2对照组与RDN组肾动脉HE染色的显微照片

表1 去神经的效果Table 1.The effect of renal denervation (Mean±SD.n=7)
2血脂和血浆中炎症因子的变化
2.1血脂的变化术前血脂水平无显著差异。8周后RDN组、假手术组和HFD组的TC水平较对照组升高(P<0.01)。RDN组的TG水平明显低于HFD组(P<0.05),假手术组和HFD组的TG水平均高于对照组(P<0.01)。RDN组、假手术组和HFD组的LDL-C水平较对照组明显升高(P<0.01),见表2。

表2 各组血脂检测结果Table 2.The levels of plasma lipids (mmol/L.Mean±SD.n=7)
2.2血浆TNF-α、IL-1α和IL-6水平的变化血浆炎症因子水平术前无显著差异,8周末RDN组血浆的TNF-α水平明显低于HFD组和假手术组(P<0.05)。RDN组血浆的IL-1α浓度显著低于假手术组和HFD组(P<0.05)。RDN组的IL-6水平降低,但与假手术组和HFD组比较均无显著差异,见图3。
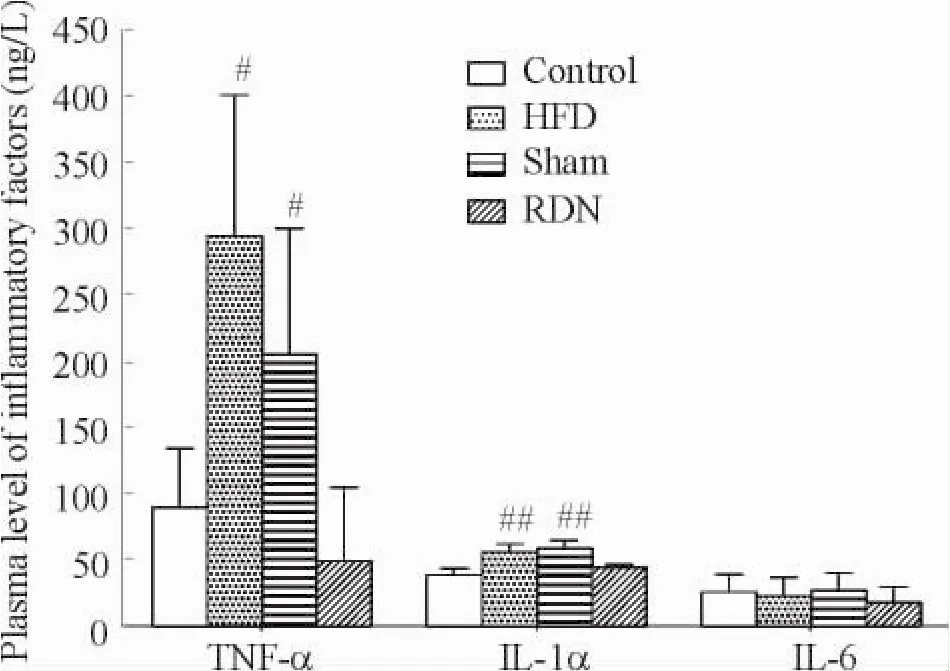
Figure 3.Plasma level of inflammatory factors after 8 weeks.Mean±SD.n=7.#P<0.05,##P<0.01 vs RDN group.图3 8周末血浆炎症因子水平
3 RDN对主动脉粥样硬化的影响
3.1主动脉的病理改变光镜下显示,对照组主动脉内膜无增厚,内弹力膜连续,中膜肌纤维排列整齐,无增殖、迁移;假手术组的主动脉内膜排列紊乱、增厚,内弹力膜不连续,可见脂质沉积,出现大量泡沫细胞,中膜向内膜增殖迁移; HFD组主动脉内膜排列紊乱,明显增厚,可见大量脂质沉积以及泡沫细胞; RDN组主动脉内膜排列较紊乱、增厚,内弹力膜不连续,少量的脂质沉积,可见泡沫细胞,病变轻于假手术组和HFD组,见图4、表3。
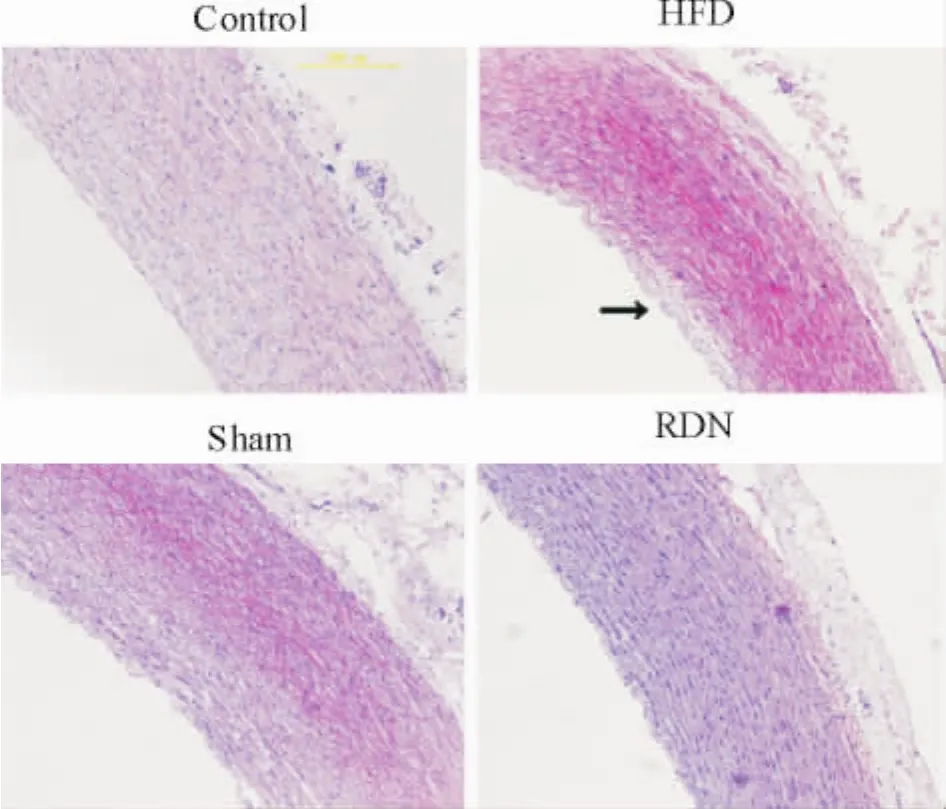
Figure 4.Photomicrographs of the aorta with HE staining (×200).图4各组主动脉HE染色的显微照片
3.2主动脉Ang II、AT1R以及NF-κB的蛋白表达
光镜下棕褐色的Ang II免疫组化阳性表达主要在主动脉内膜,呈复合型,胞浆和胞核均有。RDN组的Ang II水平比假手术组和HFD组显著降低(P<0.01),见图5。主动脉AT1R蛋白表达,RDN组、假手术组和HFD组均高于对照组(P<0.01),RDN组表达较假手术组降低但无统计学差异,见图6。RDN组NF-κB的表达高于对照组(P<0.01),但低于假手术组(P<0.05) ; HFD组表达显著低于假手术组(P<0.05),见图7。

表3 各组主动脉内膜厚度、中膜厚度以及内膜/中膜厚度比Table 3.The comparison of intimal thickness,medial thickness and ratio of intima to media (Mean±SD.n=7)
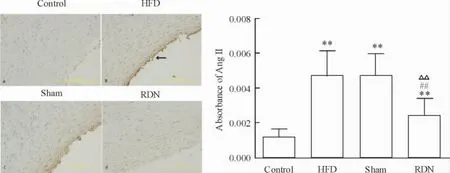
Figure 5.The protein expression of Ang II in the rabbit aorta detected by immunohistochemical method.Mean±SD.n=7.**P<0.01 vs control group;##P<0.01 vs HFD group;△△P<0.01 vs sham group.图5免疫组化检测家兔主动脉Ang II的表达

Figure 6.The protein expression of AT1R in the rabbit aorta detected by Western blot.Mean±SD.n=7.**P<0.01 vs control group.图6 Western blot检测家兔主动脉AT1R的表达
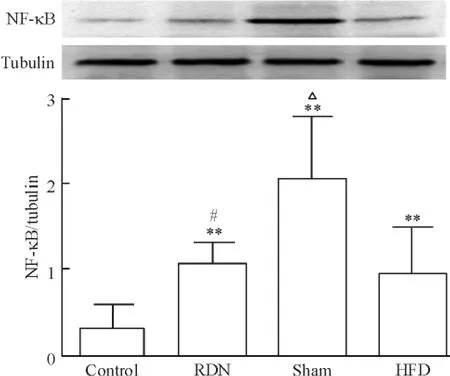
Figure 7.The protein expression of NF-κB in the rabbit aorta detected by Western blot.Mean±SD.n=7.**P<0.01 vs control group;#P<0.05 vs sham group;△P<0.05 vs HFD group.图7 Western blot检测家兔主动脉NF-κB的表达
3.3主动脉炎症因子的mRNA表达RDN组TNF-α的mRNA表达显著低于假手术组和HFD组(P< 0.05)。RDN组、假手术组和HFD组IL-1α mRNA均高于对照组(P<0.01),同时RDN组明显低于假手术组(P<0.05)。假手术组IL-6 mRNA高于对照组和RDN组(P<0.05),见图8。

Figure 8.The mRNA expression of inflammatory factors in the rabbit aorta detected by real-time PCR.Mean±SD.n=7.**P<0.01 vs control group;#P<0.05 vs HFD group;△P<0.05,△△P<0.01 vs sham group.图8主动脉炎症因子mRNA的表达
讨论
最近研究发现长期的高脂饮食可使全身交感神经系统处于过度激活状态[6-7]。另一方面,肾脏交感神经过度激活可直接调控RAAS,使Ang II上升,参与血管重塑,并且增加炎症细胞因子的释放,加重动脉粥样硬化。本研究发现,RDN可下调动脉粥样硬化形成中血管炎症因子TNF-α、IL-1α和IL-6的mRNA表达,同时降低血浆TNF-α、IL-1α以及TG水平,减轻血管炎症反应,最终延缓动脉粥样硬化的发展。
目前研究表明RDN能降低交感神经活性,改善顽固性高血压病人的血压。肾脏主要受交感神经支配,交感神经束自肾动脉开口部缠绕动脉走行进入肾脏[8],基于此特殊解剖结构,本实验通过手术可去除肾交感神经。去交感神经后,交感递质被阻断,球旁细胞的β肾上腺素能受体不能被激活,肾素分泌减少,从而降低Ang II的浓度[9],因此RDN可以抑制RAAS活性。已有研究证明,Ang II与AT1R结合后通过Ang II-AT1R-NF-κB信号通路调节转录因子NF-κB的表达,进而增强各种炎症因子(TNF-α、IL-1α、IL-6等)的转录和表达,由此引发细胞黏附增强、炎性细胞趋化、细胞分化和细胞外基质降解,参与并促进AS[10-13]。假手术组NF-κB水平显著升高可能是受到手术造成的炎症和高脂喂养的影响,而HFD组与RDN组表达无统计学差异,但HFD组的主动脉粥样硬化病变较RDN组重,其原因可能是NADPH/NADPH氧化酶系统参与调控,增加氧自由基的生成,损伤内皮细胞,促进血管炎症反应[15]。RDN组NF-κB表达受抑制,此时,炎症因子TNF-α和IL-1α 的mRAN显著降低,因此其蛋白转录与翻译减少,血浆中TNF-α和IL-1α水平也降低。Drr等[14]发现RDN可以显著降低血浆IL-6水平,改善高血压血管炎症,本研究中RDN组IL-6的mRNA表达低于假手术组,血浆IL-6水平下降,但与假手术以及HFD组比较无统计学差异,可能与样本量不足有关。另外,本实验中炎症因子mRNA水平的变化与其蛋白表达的变化趋势不一致,一方面可能因为转录和翻译后蛋白修饰,另一方可能来自real-time PCR实验的误差。
有研究证明RAAS阻断剂可以改善高甘油三酯血症,可能与AT1R的介导以及过氧化物酶体增殖物活化受体γ的激活有关[6],该受体是一种配体转录因子,可诱导肝细胞表达载脂蛋白、脂肪酸氧化酶系与过氧化物酶等,从而促进脂质的氧化代谢,降低血中TG与LDL浓度,最终纠正脂代谢紊乱[16]。本研究中发现RDN具有RAAS阻断剂的作用,通过上述途径降低血浆TG浓度,但TC与LDL-C水平并未有相应的改变,其原因仍需进一步研究。
实验过程中存在一些不足之处,首先是未对主动脉炎症因子的蛋白表达进行检测,这样可以更准确地反映血管炎症程度。其次,炎症因子蛋白与mRNA表达趋势不一致,可能与手术后炎症反应有关,在以后的实验中应减少组织的损伤,规范操作,加强无菌观念。
总之,本研究结果显示RDN能有效抑制全身交感神经活性,降低血浆TG水平,并通过抑制Ang IIAT1R-NF-κB通路减轻血管炎症反应,延缓动脉粥样硬化的发展。
[参考文献]
[1]Ross R.Atherosclerosis: an inflammatory disease[J].NEngl J Med,1999,340(2) :115-126.
[2]Marchesi C,Paradis P,Schiffrin EL.Role of the reninangiotensin system in vascular inflammation[J].Trends Pharmacol Sci,2008,29(7) :367-374.
[3]陈炜,唐晓鸿.肾交感神经对肾素血管紧张素醛固酮系统的影响[J].中华高血压杂志,2013,21(2) : 127-129.
[4]Schlaich MP,Sobotka PA,Krum H,et al.Renal sympathetic-nerve ablation for uncontrolled hypertension[J].N Engl J Med,2009,361(9) : 932-934.
[5]刘洁,周音频,王霄,等.去肾神经对中年自发性高血压大鼠血压的影响[J].第三军医大学学报,2012,34(4) : 336-340.
[6]Rüster C,Wolf G.The role of the renin-angiotensin-aldosterone system in obesity-related renal diseases[J].Semi Nephrol,2013,33(1) :44-53.
[7]Armitage JA,Burke SL,Prior LJ,et al.Rapid onset of renal sympathetic nerve activation in rabbits fed a high-fat diet[J].Hypertension,2012,60(1) :163-171.
[8]Doumas M,Faselis C,Papademetriou V.Renal sympathetic denervation and systemic hypertension[J].Am J Cardiol,2010,105(4) :570-576.
[9]Lohmeier TE,Iliescu R,Liu B,et al.Systemic and renal-specific sympathoinhibition in obesity hypertension [J].Hypertension,2012,59(2) :331-338.
[10]Pueyo ME,Gonzalez W,Nicoletti A,et al.Angiotensin II stimulates endothelial vascular cell adhesion molecule-1 via nuclear factor-κB activation induced by intracellular oxidative stress[J].Arterioscler Thromb Vasc Biol,2000,20(3) :645-651.
[11]史立宏,王守训,高尔,等.核因子-κB的活化与动脉粥样硬化的启动[J].中国病理生理杂志,2003,19 (11) :90-94.
[12]Zhang Y,Guo W,Wen Y,et al.SCM-198 attenuates early atherosclerotic lesions in hypercholesterolemic rabbits via modulation of the inflammatory and oxidative stress pathways[J].Atherosclerosis,2012,224(1) :43-50.
[13]van Diepen JA,Berbée JF,Havekes LM,et al.Interactions between inflammation and lipid metabolism: relevance for efficacy of anti-inflammatory drugs in the treatment of atherosclerosis[J].Atherosclerosis,2013,228 (2) :306-315.
[15]Garrido AM,Griendling KK.NADPH oxidases and angiotensin II receptor signaling[J].Mol Cell Endocrinol,2009,302(2) :148-158.
[16]杨智,刘昭前.PPARγ在脂肪细胞分化和糖脂代谢中的作用[J].国际病理科学与临床杂志,2008,28 (1) :14-18.
通讯作者△Tel: 023-63693065; E-mail: yinyh63@163.com
*[基金项目]重庆市渝中区科学技术委员会资助项目(No.20110301)
[收稿日期]2014-12-08
[文章编号]1000-4718(2015)06-0995-07
[中图分类号]R543.5; R363
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.06.006
