黄连抗氧化活性组分的研究
2014-07-25陈红英徐建蓉刘文静李学刚
陈红英,徐建蓉,刘文静,李学刚
(1.西南科技大学生命科学与工程学院,西南绵阳 621010;2.西南大学药学院,重庆 400716)
目前,国内外学者均在积极地寻找具有清除自由基功能的有效药物,抗氧化活性研究也成为研究和评价现代食品开发的重要内容之一。黄连是常见中药之一,为毛莨科植物黄连(Coptis chinensisFranch.)的干燥根茎,具有清热燥湿、泄火解毒、抑菌、抗氧化等多种功效[1]。它的主要化学成分是小檗碱、黄连碱、表小檗碱、药根碱和巴马汀等几种生物碱,其中小檗碱的含量最高,约为10%[2]。近研究表明黄连的很多活性如抗炎、降糖、抗癌等与其抗氧化作用有关[3-4],其中五种主要生物碱具有不同程度清除自由基的活性,特别是小檗碱[5-6]。但事实上,黄连大多以煎剂或粉剂形式在临床上使用,五种生物碱总量约占其中30%,而余下组分的作用则鲜有报道。为充分开发利用黄连药材,所在课题组对黄连各组分的抗氧化作用进行了研究,以期为黄连各部分资源的效利用和黄连药效物质基础研究提供一定科学依据。
1 材料与方法
1.1 材料与仪器
黄连药材 来源于重庆石柱黄连GMP生产基地,由重庆西南大学药学院李学刚教授鉴定,标本存放于西南大学药学院黄连研究中心;色谱甲醇、色谱乙腈、其余试剂 均为分析纯。
TBP-300B高速逆流色谱仪 上海同田生化公司;LC-20A高效液相色谱仪 日本岛津公司;Hypersil BDS C18色谱柱(250mm×4.6mm,5μm) 大连依利特科学仪器有限公司;紫外分光光度计 上海UNICO公司;旋转蒸发仪RE-52AA 上海亚荣生化仪器厂;电热鼓风干燥箱 重庆实验设备厂;
1.2 实验方法
1.2.1 各组分的制备与含量测定 按照下列图示分别制备各组分,并测定各组分的含量。
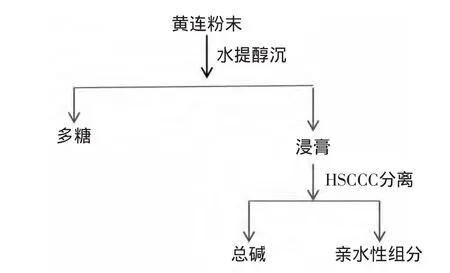
图1 黄连组分分离流程图Fig.1 Separation schematic of constituents from Coptis chinensis Franch
1.2.1.1 多糖制备与含量测定 参照方法[7],称取粉碎至20目的黄连粗粉置于索氏提取器中,用5倍量无水乙醇回流脱脂6h。滤渣挥干后,加入10倍水,80℃水浴回流提取1h。提取液调pH至中性,抽滤,滤液减压浓缩至100mL。按照除蛋白、醇沉等步骤提取粗多糖。真空干燥后即得灰白色粉末状的黄连粗多糖。多糖含量按照文献[8],用苯酚-硫酸法测定。以葡萄糖为对照制作标准曲线。
1.2.1.2 高速逆流色谱制备总碱及亲水性组分 多糖提取后余液浓缩至干得浸膏,参照文献[9],选定溶剂体系为:0~300min,氯仿∶甲醇∶0.2mol/L HCl(4∶1.5∶2,v/v));300min以后,氯仿∶甲醇∶0.2mol/L HCl(4∶2∶2,v/v)。上相为固定相,下相为流动相。称取浸膏300mg,用流动相配成20mL的样品溶液。将固定相以20mL/min的流速泵入高速逆流色谱仪的分离柱中;开启恒温冷却泵,温度为25℃;打开主机,泵入流动相,设置转速800r/min,流速2mL/min,波长254nm;待两相体系平衡好后,把样品溶液吸入分离柱中。
根据色谱工作站谱图收集馏分。按峰收集1~5号峰,合并浓缩至干得总碱。固定相中溶液用氮气吹出浓缩至干得亲水性组分。HPLC分析按照药典2010版黄连定量分析方法进行,流动相:乙腈-50mmol/L磷酸二氢钾溶液(50∶50,其中含15mmol/L十二烷基磺酸钠,磷酸调节pH为4.0;流速:1.0mL/min;柱温:30℃;进样量:20μL;检测波长:254nm。
1.2.1.3 多酚含量测定 精密称取黄连浸膏及亲水性组分50mg,用水配制成1mg/mL的溶液,取0.5mL用水定容至50mL。按照文献[10]用福林酚法测定多酚含量。以没食子酸为对照品配制标准曲线。
1.2.2 抗氧化活性测试
1.2.2.1 线粒体ROS法 取新鲜兔肾脏按照方法[11]提取线粒体并保存。线粒体用显微镜观察,应为蓝绿色圆形颗粒。取已制备的兔肝线粒体悬液,按照文献方法[10]测定活性氧。先加入pH7.2的缓冲液,然后加入两种复合体I和II底物:谷氨酸盐40mmol/L与琥珀酸盐40mmol/L,最后加入探针51mmol/L DCFH-DA,终浓度为5μmol/L。反应总体积为400μL。VC作为阳性对照。药物组设置高中低三个剂量,每个剂量三个重复且设置背景对照。加样体积见下表,加样顺序为:缓冲液-底物-探针-线粒体。避光混合均匀后立即于荧光酶标仪下测定30min内DCF的荧光强度(激发波长488nm,发射波长531nm)。荧光强度与时间的关系用线性回归拟合处理,计算直线斜率。按以下公式计
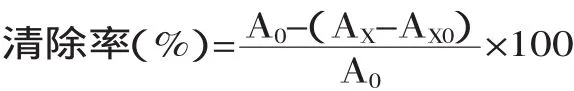
其中:A0为空白对照液的吸光度,AX为加入待测溶液后的吸光度,AX0为待测溶液的空白吸收值。
1.2.2.3 O2-·的清除能力实验 采用邻苯三酚自氧化法[13]。在试管中加入50mmol/L的Tris-HCl缓冲液(pH=8.2)2.8mL,0.1mL不同浓度的样品溶液,于25℃保温10min,然后加入0.1mL 25℃的60mmol/L的邻苯三酚0.1mL,总体积3.0mL,迅速摇匀,在420nm处测定其吸光度值,每隔0.5min记录一次。以0.1mL 10mmol/L的HCl代替邻苯三酚溶液作为待测溶液的空白吸收值。每个浓度测定三次,结果取其平均值。VC作为阳性对照。对O2-·的清除率可表示为:算抑制率。
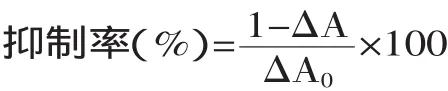
抑制率(%)=[空白荧光斜率-(样品荧光斜率-样品背景荧光斜率)]/空白荧光斜率×100
1.2.2.2 DPPH·清除率 按照方法[12],分别取三种不同浓度的各样品溶液1.0mL,于试管中,加入3.0mL的DPPH溶液,室温避光反应30min,同时以无水乙醇为空白,于517nm波长处测定吸光值。按下列公式计算样品对DPPH自由基清除率。将实验重复三次,求得清除率的平均值。VC作为阳性对照。
其中:△A0为未加待测溶液时邻苯三酚自氧化速率;△A为加入待测溶液后的邻苯三酚自氧化速率。
1.2.2.4 ·OH清除实验 采用水杨酸法[12]。在试管中加入9mmol/L FeSO41mL、9mmol/L水杨酸-乙醇1mL和待测溶液1mL,最后加入8.8mmol/L H2O21mL。37℃反应0.5h后,12000r/min离心6min,然后以双蒸水作参比,在510nm下测定吸光度。以9mmol/L FeSO41mL,9mmol/L水杨酸-乙醇1mL,待测溶液1mL和双蒸水1mL作为待测溶液的本底吸收值。每一吸光值平行测3次,取其平均值。VC作为阳性对照。清除率计算公式同1.2.2.2。
2 结果与讨论
2.1 组分制备结果分析
按照方法1.2.1.3,取黄连45g,采用水提取醇沉法,得到灰白色块状的黄连粗多糖0.6305g。余液浓缩至干后,按照分离流程图得到其余各组分。
HSCCC利用物质在互不相溶的两相溶剂中分配系数的差异实现分离,对样品损失少,且不会引起组分变性。样品在固定相(水相)与流动相(氯仿相)中不断往复萃取,按照组分在两相中分配系数的差异先后流出,据相似相溶原则,易随流动相流出的为易溶于有机溶剂的弱极性组分,最后为易溶于水相的亲水性组分。
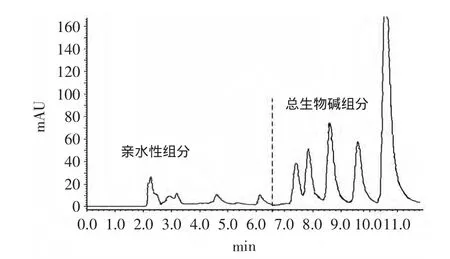
图2 HSCCC馏分在黄连浸膏HPLC图谱上的分布图Fig.2 Schematic of HSCCC fractions from Coptis chinensis Franch extracts in HPLC
馏分在HPLC图上的分布见图2,可见经高速逆流色谱分离后,黄连浸膏分离后基本分成两大块:总生物碱部分、亲水性组分(在氯仿-甲醇-水体系中更易溶解于水相)。其中总生物碱组分包括了五种主要生物碱,这部分是往往是大家关注的重点。而其余馏分则鲜有相关研究报道。馏分经减压浓缩至干,总生物碱组分占浸膏61.6%,而亲水性的组分占37.2%,其余为加样后随即被流动相带出的极弱性组分(因得到的量较少未做进一步实验)。徐颖[14]曾用80%乙醇回流提取得浸膏,并结合离子对萃取,紫外分光光度法测得浸膏中总生物碱含量为31.49%±1.41%。此实验中采用提取多糖后的水提取液浓缩后浸膏直接进行逆流色谱分离,在线监测,按峰收集并HPLC跟踪,最终得到总生物碱组分和亲水性组分,此数据与我们前期实验用黄连粗粉用溶剂体系直接溶解后进样得到的结果非常相似。
2.2 多酚与多糖含量测定结果与分析
普遍认为,中药材的抗氧化活性与多酚含量有关[15-16]。因此,本实验用福林酚法测定了浸膏和亲水组分中多酚的含量。用没食子酸为对照,标准曲线方程:y=0.0998x+0.0426,R2=0.9992,线性范围为0~0.4g/L。以100g样品中没食子酸当量表示,黄连浸膏中多酚含量为1.65g/100g,亲水性组分中多酚含量相当于没食子酸当量为(35.2±2.28)g/100g。醇提浸膏中多酚含量与文献[17]一致,亲水组分中多酚含量较高估计与其含有阿魏酸、绿原酸、木兰碱等酚酸组分有关。
按照方法1.2.1.3,用苯酚-硫酸法,以葡萄糖为对照,绘制的标准曲线方程为y=0.0074x+0.0016,R2=0.9976,线性范围为:10~135μg/mL。黄连中多糖含量为0.3586%,粗多糖中多糖含量为39.47%。与文献[18]结果测得黄连药材中多糖含量为0.32%~0.81%,粗多糖中含量约30.96%~55.45%基本一致,只是文献采用碱提取,木瓜酶与Sevag法结合除蛋白,粗多糖的纯度较高。
2.3 抗氧化活性结果与分析
活性氧(ROS)有酶源性、非酶源性、线粒体性等多种来源,其中线粒体呼吸链是ROS的主要途径,包括有O2-·、·OH、H2O2等许多种类。O2-·是机体内寿命最长的自由基,通常是自由基反应的引发剂;·OH是体内最活泼的活性自由基。实验用不同的评价体系对黄连各组分的抗氧化活性进行了测试,结果见表1。维生素C的活性与相关文献[19,10]基本上一致并作对照。
线粒体ROS法和DPPH法主要体现总抗氧化能力,从表1中可看出两法测定结果大体趋势一致,浸膏的总抗氧化能力最强,而亲水性组分略低于总碱的活性,多糖的抗氧化活性相对较弱,但也呈现较强的抗氧化活性,这似乎与黄连在临床上多用粗粉或水提液药用一致。亲水性组分的抗氧化活性估计与其含有较高含量的多酚物质比如阿魏酸、木兰碱、绿原酸等有关。因此也说明黄连中某些成分含量虽少,但与其他成分并存时,却可能存在协同增效的作用。
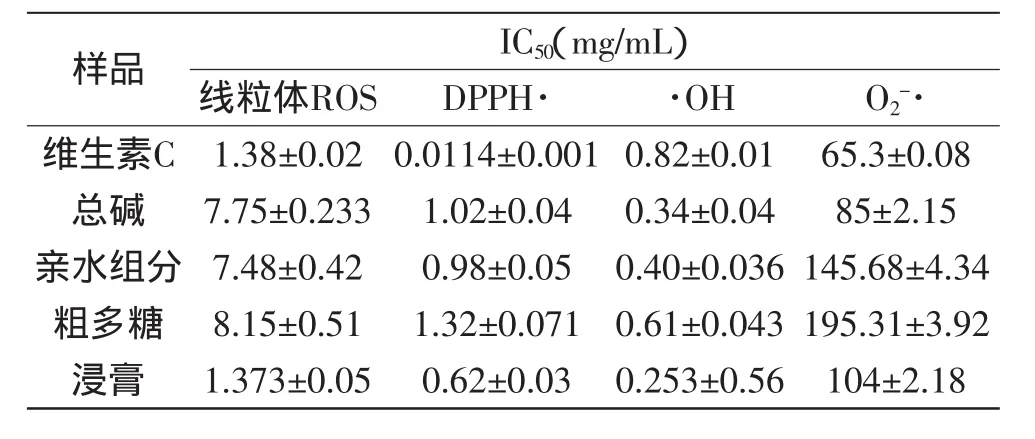
表1 各化合物抗氧化活性结果Table 1 Antioxidant activity of compounds
从对两种自由基的清除作用来看,总碱的优势较明显,均强于亲水性组分,特别是对O2-·的清除作用明显优于其他组分,IC50为85mg/mL,说明几种主要生物碱对O2-·的清除作用显著。从对·OH的清除作用比较,浸膏的效果占优,甚至优于总碱,亲水性组分也表现出较明显的作用,这与文献[20]报道基本一致,说明对·OH产生清除作用的多为一些亲水性成分。杨澄等[18]也认为黄连炮制后,清除·OH的能力显著降低,水提物的清除能力明显优于醇提物,而与之相反,对O2-·的清除作用却是醇提物清除活性强于水提物,可能原因是醇提物中生物碱等小分子含量高于水提物,减少了蛋白质、多糖等溶出的原因。多糖对两种自由基均呈现一定的清除效果。
3 结论
用HSCCC可一次性无损失的完全分离黄连中的主要生物碱,并按分配系数差异进行组分分离;黄连的抗氧化活性成分并非只有几种主要生物碱,其清除超氧自由基O2-·及清除·OH能力是黄连生物碱及其他组分合力而为。黄连抗氧化作用机制较多,要阐明其抗氧化作用的物质基础需要建立合适的活性评价体系,并进一步加大分离提取工作。
[1]李彩虹,周克元.黄连活性成分的作用及机制研究进展[J].时珍国医国药,2010,21(2):466-468
[2]匡海学.中药化学[M].北京:中国中医药出版社,2003.
[3]Jung H A,Min B S,Yokozawa T,et al.Anti-Alzheimer and antioxidant activities of Coptidis Rhizoma alkaloids[J].Biological and Pharmaceutical Bulletin,2009,32(8):1433-1438.
[4]Liu F,Ng T B.Antioxidative and free radical scavenging activities of selected medicinal herbs[J].Life Sciences,2000,66(8):725-735.
[5]Jang M H,Kim H Y,Kang K S,et al.Hydroxyl radical scavenging activities of isoquinoline alkaloids isolated fromCoptis chinensis[J].Archives of Pharmacal Research,2009,32(3):341-345.
[6]Jung H A,Yoon N Y,Bae H J,et al.Inhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase[J].Archives of Pharmacal Research,2008,31(11):1405-1412.
[7]姜延伟,王懿萍,吴玉娟,等.黄连多糖抑菌活性初探[J].时珍国医国药,2009,20(1):48-49.
[8]黄东萍,文东旭,林文翰.天芎注射液中多糖的含量测定[J].华西药学杂志,2005,20(2):167-168.
[9]Chen H Y,Ye X L,Cui X L,et al.Cytotoxicity and antihyperglycemic effect of minor constituents from Rhizoma Coptis in HepG2 cells[J].Fitoterapia,2012,83(1):67-73.
[10]张国友,唐玲,陈玮,等.分光光度法测定蒙古栎叶中多酚的含量[J].中国科学院研究生院学报,2009,26(3):319-322.
[11]He K,Li X,Ye X,et al.A mitochondria-based method for the determination of antioxidant activities using 2′,7′dichlorofluorescin diacetate oxidation[J].Food Research International,2012,48(2):454-461.
[12]陈雯,唐生安,秦楠,等.牛尾菜抗氧化活性成分研究[J].中国中药杂志,2012,37(6):806.
[13]陈美珍,宋彩霞,陈伟洲,等.海芦笋提取物体外抗氧化活性的研究[J].食品科学,2009,30(20):71-74.
[14]徐颖.黄连总生物碱的提取及其对实验性糖尿病肾病大鼠的保护作用及机制的初步研究[D].重庆:第三军医大学,2006.
[15]Wojdyło A,Oszmiański J,Czemerys R.Antioxidant activity and phenolic compounds in 32 selected herbs[J].Food Chemistry,2007,105(3):940-949.
[16]Li H B,Wong C C,Cheng K W,et al.Antioxidant propertiesin vitroand total phenolic contents in methanol extracts from medicinal plants[J].LWT-Food Science and Technology,2008,41(3):385-390.
[17]Cai Y,Luo Q,Sun M,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J].Life Sciences,2004,74(17):2157-2184.
[18]吴玉娟,王懿萍,姜延伟,等.黄连多糖含量测定及抗氧化活性研究[J].时珍国医国药,2008,19(8):1906-1908.
[19]向志军,赵广荣,元英进,等.复方丹参的体外抗氧化活性研究[J].中草药,2006,37(2):211-213.
[20]杨澄,仇熙.黄连炮制品清除氧自由基和抗指质过氧化作用[J].南京大学学报:自然科学版,2001,37(5):659-663.
