大孔吸附树脂纯化胡芦巴中原薯蓣皂苷的研究
2014-07-25郭清峰余淑娴梁永利陈建华任怡欣
郭清峰,王 玮,余淑娴,梁永利,陈建华,任怡欣
(1.包头轻工职业技术学院,内蒙古包头 014035;2.南昌大学理学院,江西南昌 330031)
胡芦巴为豆科植物胡芦巴属胡芦巴(Trigonella foenum-graecumL.)的种子,在我国主产于贵州、江西、河北、安徽、四川、新疆等地,且南北各地均有栽培。干燥的胡芦巴种子有温肾、祛寒、止痛的功效,主治肾藏虚冷、小腹冷痛、小肠疝气、寒湿脚气等症[1]。胡芦巴的主要化学成分为甾体皂苷、黄酮及其苷、三萜、生物碱、香豆素、有机酸及油脂等,其中甾体皂苷是其主要成分[2]。原薯蓣皂苷(protodioscin)属于甾体皂苷,Hiroshige等[3]在胡芦巴中发现含有原薯蓣皂苷,该有效成分具有增强性功能、降血脂、对癌细胞有毒杀和抗白血病等作用[4-7]。
大孔吸附树脂是一种有机高聚物吸附剂,具有选择性好、吸附容量大、解吸容易、再生简便等优点。基于大孔吸附树脂的特点,选用大孔吸附树脂来分离纯化胡芦巴中原薯蓣皂苷,通过对大孔吸附树脂富集、纯化胡芦巴中原薯蓣皂苷工艺条件与参数的研究,探索其分离纯化的最优工艺参数,从而确定富集、纯化胡芦巴中原薯蓣皂苷的可行工艺路线。
1 材料与方法
1.1 材料与仪器
胡芦巴(Trigonella foenum-graecumL.)药材 购自江西省药材公司(产地贵州),原薯蓣皂苷标准品(含量≥98%)购自中国药品生物制品检验所;甲醇、乙腈 色谱纯;其他试剂 分析纯;水 二次重蒸馏水;D-101、DB-301、HP-20、HPD-400A、HPD-500、HPD-l00、HPD-600型大孔吸附树脂 购自河北沧州宝恩化工有限公司;YWD-06、YWD-01B、NKA-9型大孔吸附树脂 购自中国沧州远威化工有限公司。
2695型高效液相色谱仪 美国Waters公司;Waters2996型二极管阵列检测器,Gold SpectrumLab 54型紫外可见分光光度计 上海棱光技术有限公司;KQ2200E型超声仪 昆山市超声仪器有限公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;Sartorius型十万分之一电子天平 德国。
1.2 实验方法
1.2.1 葫芦巴粗提液的制备 实验中的胡芦巴取当年生原药材,去杂、洗净、低温干燥至恒重,取出置于干燥器内冷却,用粉碎机粉碎,过40目网筛,分装备用(置于阴凉干燥处密封,供研究提取分离用)。
称取已干燥至恒重的胡芦巴粉适量,用正己烷进行索氏脱脂2h,用75%的乙醇溶液超声提取3次,每次15min,把提取液过滤,合并滤液,滤液再高速离心、滤过,将过滤液减压浓缩,浓缩液移入容量瓶,并用75%的乙醇溶液定容至250mL备用[8]。
1.2.2 葫芦巴中原薯蓣皂苷的含量测定[8]
1.2.2.1 色谱条件 Lichrospher C18柱(4.6mm×250mm,5μm);流动相:乙腈-水(8∶92);柱温:30℃;流速:0.5mL/min;检测波长:203nm。
1.2.2.2 校准曲线和线性范围考察 称取50℃干燥2h的原薯蓣皂苷标准品2.70mg,置于25mL棕色容量瓶中,用流动相超声溶解,并定容至刻度,摇匀,即得标准品溶液(0.108mg·mL-1)。依次精密吸取标准品溶液1、2、4、6、10、12μL进样,记录峰面积,以峰面积值Y对原薯蓣皂甙的进样浓度X(mg·mL-1)进行线性回归,得回归方程为Y=11582.93X-16.73,r=0.9999。
1.2.3 大孔吸附树脂的筛选 通过比较10种大孔吸附树脂的静态吸附和解吸的性能筛选出适合于纯化原薯蓣皂苷的树脂。精密称取各种型号已干燥至恒重的树脂0.5g,置于锥形瓶中,加入原薯蓣皂苷提取液25mL,放入恒温(25℃)摇床中振荡24h。把经过吸附后的提取液过滤,然后用高效液相色谱测定滤液中原薯蓣皂苷的浓度,从而测定各种型号大孔吸附树脂的吸附量。将吸附平衡后的树脂转移至色谱柱中,用4BV的70%乙醇解吸,然后用高效液相色谱测定解吸液中原薯蓣皂苷的浓度。大孔吸附树脂的吸附量,吸附率和解吸率按下式进行计算。

式中:C0—起始溶液中原薯蓣皂苷的质量浓度,mg/mL;C1—洗脱液中原薯蓣皂苷的质量浓度,mg/mL;Ce—吸附平衡时溶液中原薯蓣皂苷的质量浓度,mg/mL;V—葫芦巴提取液体积,mL;m—树脂质量,g。
1.2.4 动态吸附条件的确定 把通过静态与解吸实验筛选出的大孔树脂进行湿法装柱,分别考察上柱吸附体积流量、树脂药材比、树脂柱径高比等因素,收集不同因素下的各洗脱液,通过测定洗脱液中原薯蓣皂苷的浓度,计算出原薯蓣皂苷的吸附量,以吸附率为指标确定最佳吸附条件。
1.2.4.1 上柱吸附体积流量的确定 精密吸取10mL原薯蓣皂苷提取液分别以2、4、6、8、10BV/h的体积流量上柱吸附,收集流出液,静置1h。然后用3BV的水以8BV/h的流速进行清洗,收集流出液。合并2次的流出液,测定原薯蓣皂苷的质量浓度,根据式(2)计算原薯蓣皂苷的吸附率。
1.2.4.2 树脂药材质量比的确定 调整胡芦巴提取液的上柱量,使干树脂药材质量比分别为1∶1,2∶1,4∶1,8∶1和16∶1(质量比的单位为g/g),以70%乙醇作为洗脱剂,用3BV(树脂床体积数)70%乙醇,在10BV/h下进行解吸,收集洗脱液,测定洗脱液中原薯蓣皂苷的质量浓度,根据式(2)计算原薯蓣皂苷的吸附率。
1.2.4.3 树脂柱径高比的确定 取HP-20型干树脂湿法装柱,使径高比分别为1∶3、1∶6、1∶9、1∶12,1∶15,树脂药材质量比为8∶1,精密吸取胡芦巴提取液上柱,用70%乙醇液洗脱,收集洗脱液,测定原薯蓣皂苷的质量浓度,根据式(2)计算原薯蓣皂苷的吸附率。
1.2.5 动态解吸条件的确定 把通过静态与解吸实验筛选出的大孔树脂进行湿法装柱,分别考察不同洗脱剂、洗脱剂用量、不同体积分数的洗脱剂、洗脱剂体积流量等因素,收集不同因素下的各洗脱液,通过测定洗脱液中原薯蓣皂苷的浓度,计算出原薯蓣皂苷的解吸率,以吸附量为指标确定最佳解吸条件。
1.2.5.1 洗脱剂体系的确定 最常用的洗脱剂是水、甲醇、乙醇、丙酮、醋酸乙酯以及它们的混合液等,所以考虑水、甲醇、乙醇、丙酮、醋酸乙酯以及它们的混合液来选择。精密吸取胡芦巴提取液装柱、上样,然后分别用3BV树脂床体积数的水、甲醇、乙醇、丙酮、醋酸乙酯、70%甲醇、70%乙醇溶液分别以10BV/h的流速进行解吸,收集洗脱液,测定原薯蓣皂苷的质量浓度,根据式(3)计算原薯蓣皂苷的解吸率。
1.2.5.2 洗脱剂用量的确定 精密吸取胡芦巴提取液上样,然后用70%乙醇,以10BV/h的速度洗脱,按树脂床体积1、2、3、4、5BV的70%乙醇洗脱剂分别收集洗脱液,测定洗脱液中原薯蓣皂苷的质量浓度,根据式(3)计算原薯蓣皂苷的解吸率。
1.2.5.3 洗脱剂浓度的确定 精密吸取胡芦巴提取液上样,然后分别用15%、30%、50%、70%、90%乙醇溶液以10BV/h的流速进行解吸,收集洗脱液,测定原薯蓣皂苷的质量浓度,根据式(3)计算原薯蓣皂苷的解吸率。
1.2.5.4 洗脱剂体积流量的确定 精密吸取胡芦巴提取液上样,以3BV的70%乙醇溶液作为洗脱剂,分别以4、8、10、12、15BV/h的流速进行解吸,收集洗脱液,测定,根据式(3)计算原薯蓣皂苷的解吸率。
2 结果与分析
2.1 大孔吸附树脂的筛选
通过静态吸附与解吸实验测定了10种大孔树脂对原薯蓣皂苷的的吸附量和解吸率,吸附量和解吸率的按照1.2.3项下式(1)和式(2)计算,结果见表1。
从表1可看出,不同厂家不同型号的大孔吸附树脂对原薯蓣皂苷的吸附量与解吸率均不同,其中HP-20型大孔吸附树脂吸附量最大,且解吸率也最高,故选用HP-20型大孔吸附树脂作为胡芦巴中原薯蓣皂苷的纯化树脂。
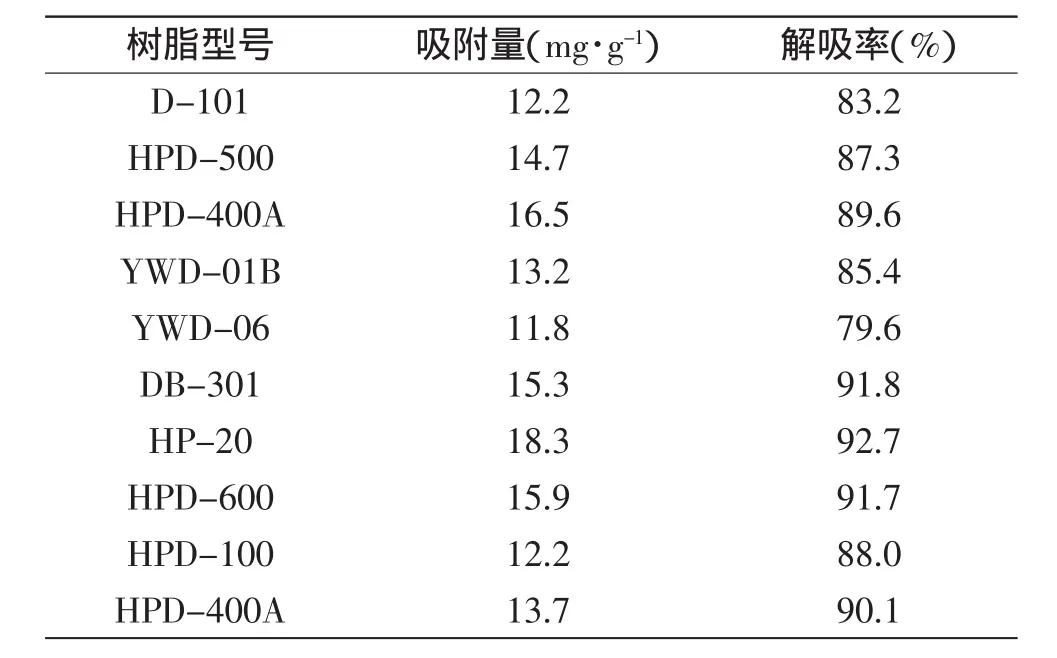
表1 不同类型大孔树脂对原薯蓣皂苷的静态吸附量及解吸率Table 1 Static adsorption of protodioscin capacity and desorption rate of different types of macroporous resin
2.2 动态吸附条件的确定
2.2.1 上柱吸附体积流量的确定 上柱吸附体积流量是影响吸附率的重要因素,原薯蓣皂苷在树脂床上的吸附需要有一个过程,若药液的上柱吸附体积流量过快,部分原薯蓣皂苷未及吸附就会泄漏,因此应适当控制吸附体积流量,实际实验结果见图1,图1表明当吸附体积流量小于4BV/h时,原薯蓣皂苷吸附率均较高,考虑时间因素,综合考虑最后选择吸附体积流量为4BV/h,当吸附体积流量为4BV/h时,可保证原薯蓣皂苷在树脂上有较高的吸附率。
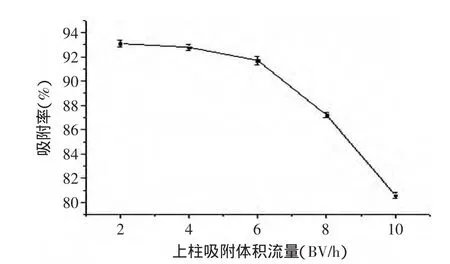
图1 上柱吸附体积流量对吸附率的影响Fig.1 Effect of column adsorption volume flow on adsorption rate
2.2.2 树脂药材质量比的确定 树脂药材比是影响原薯蓣皂苷转移率的重要因素,树脂药材质量比值过小,会引起药量超载,使药物泄漏流失。树脂药材质量比值过大,能充分吸附原薯蓣皂甙,但却没有充分利用树脂的吸附能力,实际实验结果见图2。图2表明,树脂药材质量比在16∶1~4∶1时,吸附率均较高,考虑到树脂药材质量比越小,上柱时间越长,增加成本,为减少上柱时间,综合考虑确定树脂药材质量比为8∶1。
2.2.3 树脂柱径高比的确定 通过实验得出树脂径高比对吸附率影响的实验,实验结果见图3,可以看出树脂的径高比对吸附率亦有较大影响,在树脂柱直径一定的条件下,树脂高度越高,柱效越高,在一定的上样量的情况下,随柱长的增加,吸附率增加,柱分离次数增加,太低则柱效过低,吸附路径过短,则会容易造成泄漏。从图3可看出,树脂柱径高比在1∶9~1∶15时,原薯蓣皂苷的吸附率均较高,从工业化生产的成本考虑,树脂径高比确定为1∶12较为妥当。

图2 树脂药材质量比对吸附率的影响Fig.2 Effect of the mass ratio between resin and herbs on adsorption rate

图3 树脂径高比对吸附率的影响Fig.3 Effect of the ratio between diameter and height on adsorption rate
2.3 动态解吸条件的确定
2.3.1 洗脱剂体系的确定 通过不同洗脱剂对原薯蓣皂苷的解吸率的实验,实验结果见图4,由图4可看出,采用乙醇、甲醇-水、乙醇-水、丙酮体系对原薯蓣皂苷均有比较好的洗脱效果。其中丙酮、70%甲醇和70%乙醇的洗脱效果更好,但考虑到丙酮的的成本和其挥发性,还有甲醇的毒性,实际工作的安全、成本等问题,最后确定以70%乙醇-水作为洗脱剂体系。

图4 洗脱剂体系对解吸率的影响Fig.4 The influence of eluent system on desorption rate
2.3.2 洗脱剂用量的确定 洗脱剂用量也是影响解吸率的重要因素,洗脱剂用量少,不能充分把原薯蓣皂苷洗脱下来,反之洗脱剂用量太多,会使工业生产成本增大。洗脱剂用量对解吸率的影响实验结果见图5,从图5可以看出,当洗脱剂用量为3、4、5BV时,都可基本将提取液中原薯蓣皂苷洗脱干净,综合考虑时间和成本,选择3BV的洗脱剂作为到达终点时洗脱剂的用量。

图5 洗脱剂用量对解吸率的影响Fig.5 Effct of dosage of eluenton on desorption rate
2.3.3 洗脱剂浓度的确定 乙醇溶液浓度对解吸率的影响结果见图6,图6表明随着洗脱剂中乙醇体积分数的增大,原薯蓣皂苷的解吸率逐渐增大,当乙醇体积分数大于70%时具有较高的洗脱能力,但同时观察到随着乙醇体积分数的增加,洗脱液颜色明显变深,说明已将许多有色杂质洗下,因此,在保证解吸率较高的条件下,应选用较低体积分数的乙醇溶液,减少脂溶性杂质,提高洗脱液中原薯蓣皂苷的纯度。另外考虑到体积分数太低,洗脱速度过慢,洗脱剂用量大,同时鉴于洗脱终点检查的灵敏度,可能会造成洗脱不完全,因此,应选择一个适中的体积分数,综合考虑,选择以70%乙醇作为洗脱剂较为妥当。
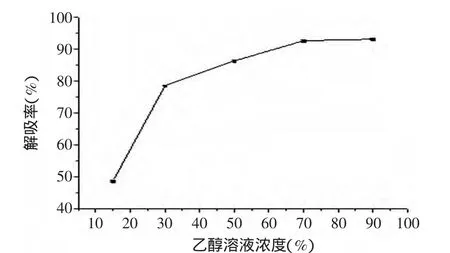
图6 乙醇溶液浓度对解吸率的影响Fig.6 Effct of ethanol solution concentration on desorption rate
2.3.4 洗脱剂体积流量的确定 洗脱剂体积流量的对解吸率影响的实验结果见图7,由图7表明,表明洗脱剂体积流量4~10BV/h转移效果均较好,基本能将原薯蓣皂苷洗脱干净。但同时考虑到洗脱剂流速过快会导致原薯蓣皂苷来不及解吸而造成损失,过慢会导致洗脱时间更长,综合考虑,原薯蓣皂苷的洗脱流速选择在10BV/h。

图7 洗脱剂体积流量对解吸率的影响Fig.7 Effct of eluent volume flow on desorption rate
3 结论与讨论
原薯蓣皂苷在植物中的含量很低,文献报道中提取分离的主要办法是用有机溶剂提取后,再用硅胶柱和甲醇-氯仿作为洗脱剂,反复进行层析分离得到原薯蓣皂苷[9-11]。大孔吸附树脂用于原薯蓣皂苷的纯化,国内还未见有文献报道,是一个值得研究的课题。
HP-20型大孔吸附树脂是高多孔性苯乙烯型树脂,具有很好的吸附和脱附性能,邓洁红等筛选出HP-20树脂作为对刺葡萄皮色素的最佳树脂[12],龚志华等大孔吸附树脂分离纯化儿茶素EGCg,EGCg的纯度和得率分别达68.32%和72.08%[13]。
本实验比较多种型号大孔吸附树脂的静态饱和吸附量和解吸率,筛选出最佳的大孔吸附树脂是HP-20型,HP-20型大孔吸附树脂纯化原薯蓣皂苷的最佳工艺为:上柱吸附体积流量为4BV/h,树脂药材质量比为8∶1,树脂柱径高比在1∶12,以70%乙醇-水体系作为洗脱剂,洗脱剂用量为3BV,洗脱剂流量为10BV/h。
[1]国家药典委员会.中国药典[S].北京:化学工业出版社,2005:167.
[2]荆宇,赵余庆.胡芦巴化学成分和药理作用研究进展[J].中草药,2003,34(12):1146-1149.
[3]H iroshige H ibasam.Protodioscin isolated from fenugreek(Trigonellafoenum graecum L.inducescelldeath and m orphological change indicat ive of apoptosis in leukemic cell line H-60,but not in gastric cancercell line KATO III[J].International Journal of Molecular Med Icine,2003,11:23.
[4]陈惠芳.植物活性成分辞典.第1册[M].北京:中国医药科技出版社,2001:789.
[5]陈俊,刘继红.促进阴茎海绵体平滑肌松弛的植物性中药研究进展[J].中华男科学,2003,9(8):615-617.
[6]刘锡葵,陈国珍,杨庆雄,等.甾体皂苷的心血管活性研究[A].中国药学会学术年会论文集(下册)[C].宁波:2000:996.
[7]聂纯.天然药物抗癌有效成分进展[J].中草药,1999,30(1):65-67.
[8]余淑娴,郭清峰,张纬,等.反相高效液相色谱法测定胡芦巴中原薯蓣皂苷的含量[J].时珍国医国药,2007,18(7):1684-1685.
[9]董梅,陈泉,吴立军,等.黄山药化学成分的研究(ΙΙ)[J].中草药,2001,32(8):685.
[10]杨顺丽,刘锡葵.栽培菊叶薯蓣中甾体皂苷成分[J].中草药,2004,35(11):1213-1215.
[11]唐世蓉,姜志东.浙江山萆薢甾体皂甙的研究[J].植物学报,1987,29(2):193-196.
[12]邓洁红,黄甜;庞月兰,等.HP-20大孔吸附树脂分离纯化儿茶素EGCg的效果[J].湖南农业大学学报:自然科学版,2010,36(1):87-90.
[13]龚志华,谭兴和,王锋,等.HP-20大孔吸附树脂对刺葡萄皮色素纯化特性研究[J].食品工业科技,2008,29(2):145-148.
