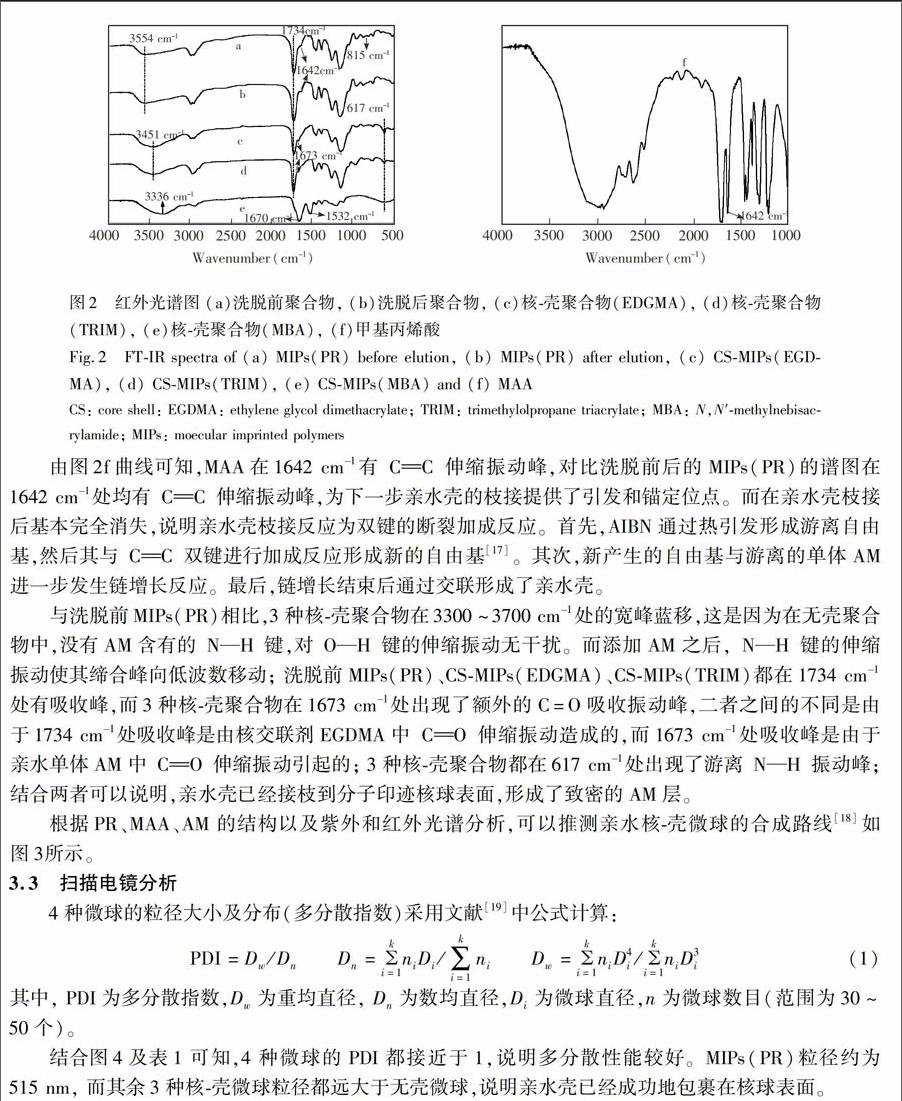
蒸馏沉淀法制备扑热息痛亲水核—壳分子印迹微球及其吸附性能研究
2017-02-06鲁佩佩王兵郭聪于鹏飞
鲁佩佩+王兵+郭聪+于鹏飞
摘 要 选取扑热息痛(PR)作为模板分子,甲基丙烯酸(MAA)为功能单体,通过蒸馏沉淀聚合制得聚合物内核; 以丙烯酰胺(AM)作为亲水单体,采用不同的壳交联剂,乙二醇二甲基丙烯酸酯(EGDMA)、3.羟甲基丙烷三甲基丙烯酸酯(TRIM)、 N,N′.亚甲基双丙烯酰胺(MBA)通过自由基聚合枝接亲水层外壳,成功制得一系列亲水核.壳分子印迹聚合物微球(CS.MIPs), 并对比其对聚合物性能的影响。通过紫外光谱(UV)、红外(FT.IR)光谱、扫描电镜(SEM)以及吸附实验进行表征,并进行了亲水性能测试。结果表明,采用MBA作交联剂的印迹微球吸附性能以及亲水性能最好,吸附量达120 μmol/g,接触角23.3°。本研究为检测水溶液中扑热息痛含量,提供了一种新思路。
关键词 亲水性; 核壳; 蒸馏沉淀聚合; 自由基聚合; 分子印迹; 扑热息痛
1 引 言
扑热息痛(Paracetamol, PR)作为解热和镇痛剂效果温和,是乙酰苯胺类药物中最好的品种,广泛用于对阿司匹林过敏、不耐受或不适于应用阿司匹林的病例。但是过量服用扑热息痛的副作用已见报道,如急性肝衰竭、子宫内胎儿生长迟缓、参与大脑血清素激活、发烧等其它问题[1]。因此,有必要检测和计算扑热息痛在人体血清和尿液的含量。目前,常用的检测方法有高效液相色谱法[2]、毛细管电泳法[3]、荧光光谱测定法[4]和分光光度法[5]。但是这些传统方法成本高,耗时长,步骤繁琐。因此,研究出一种快速准确的检测和计算血清和尿液中PR含量的方法对人类健康具有重要意义。在这方面,具有分子识别功能的分子印迹材料具有良好的分离识别性能。
分子印迹技术(Molecular imprinting technology,MIT)是指以特定目标分子作为模板,合成对其具有特异性识别功能的聚合物的过程[6],得到的聚合物成为分子印迹聚合物(Molecularly imprinted polymer,MIP)。由于分子印迹聚合物具有优良的分子识别性能,目前已经被广泛应用于许多领域,如固相萃取[7],传感器[8~11],免疫分析[12],药物检测和分离[13,14]。
尽管分子印迹聚合物可以快速、有效地分离模板分子,但是目前大部分分子印迹聚合物在有机溶液中才体现出良好的分子识别性能[15],而扑热息痛的临床诊断样本需要溶解在水溶液中。为解决这个问题,本实验在疏水印迹核表面修饰一层亲水分子层,既不影响核单体的选择,又可以应用于水溶液中。首先采用蒸馏沉淀聚合法制备内核,蒸馏沉淀聚合是鹿现永等[16]在沉淀聚合的基础上发展起来的,其优点是反应时间短,可以回收溶剂,溶剂浪费少,提高回收利用率; 再利用印迹核表面残留的碳碳双键,通过自由基聚合反应枝接亲水层,并通过改变交联剂的种类对聚合物在水中的分散性和吸附量进行优化实验。这种检测扑热息痛含量的方法不受溶剂条件的影响,制备过程的简便性、快捷性以及对于扑热息痛的敏感性,使其在扑热息痛检测及富集方面具有潜在的应用前景。
2 实验部分
2.1 仪器与试剂
UV.1200型紫外可见分光光度计(北京瑞利分析仪器公司); Tensor.37型傅里叶变换红外光谱仪(德国Bruker公司); QUANTA.200型场发射扫描电子显微镜(日本日立公司); HY.8回旋式大容量振荡器(金坛市金南仪器制造有限公司); DF.101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司)。
扑热息痛 (PR, 分析纯,国药集团化学试剂有限公司); 甲基丙烯酸 (MAA)、丙烯酰胺(AM)(分析纯,天津市北方天医化学试剂厂); 乙二醇二甲基丙烯酸酯(EDGMA,分析纯,广州哋科复合材料科技公司); 3.羟甲基丙烷三甲基丙烯酸酯 (TRIM)、偶氮二异丁腈(AIBN)(成都贝斯特试剂有限公司); N,N′.亚甲基双丙烯酰胺 (MBA,分析纯,天津市津科精细化工研究所); 对硝基苯酚、对苯二酚(分析纯,天津市风船化学试剂科技有限公司); 乙腈、甲醇(分析纯,天津市大茂化学试剂厂); 无水乙醇、冰乙酸(分析纯,天津市化学试剂三厂)。
2.2 无壳扑热息痛印迹微球MIPs(PR)的制备
称取PR (0.5 mmol),MAA (2.0 mmol),AIBN(15 mg)和EGDMA (2.5 mmol)溶于80 mL乙腈中,恒温振荡1 h,将蒸馏装置置于油浴锅中,通氮气30 min, 80℃搅拌下回流1 h。升温至110℃,开始蒸出溶剂,控制在1.5~2.0 h内蒸出1/2溶剂,停止反应。离心得白色聚合物。经甲醇.乙酸(9∶1, V/V)溶液索氏提取洗脱模板,干燥得MIPs(PR)微球。
2.3 核.壳扑热息痛印迹微球CS.MIPs的制备
称取PR (0.5 mmol),MAA (2.0 mmol),AIBN (15 mg)和EGDMA (2.5 mmol)溶于80 mL乙腈中,恒温振荡1 h。将蒸馏装置置于油浴锅中,通氮气30 min, 80℃搅拌下回流1 h。升温至110℃,出现白色聚合物。同时通过恒压滴液漏斗将含有AM (4.0 mmol),EGDMA (2.5 mmol),AIBN (15 mg)的40 mL 乙腈溶液缓慢滴加到烧瓶中,控制在1.5~2.0 h内蒸出60 mL乙腈,停止反应。经甲醇.乙酸(9∶1, V/V)溶液索氏提取洗脱模板,干燥得CS.MIPs(EGDMA)微球。
CS.MIPs(TRIM)及CS.MIPs(MBA)的制备只改变恒压滴液漏斗内交联剂的种类,方法同上。对应非印迹聚合物(NIPs)的制备,除不加模板分子外方法同上。所制备聚合物分别为NIPs(PR)、CS.NIPs(EGDMA)、CS.NIPs(TRIM)、CS.NIPs(MBA)。
3 结果与讨论
3.1 紫外光谱分析
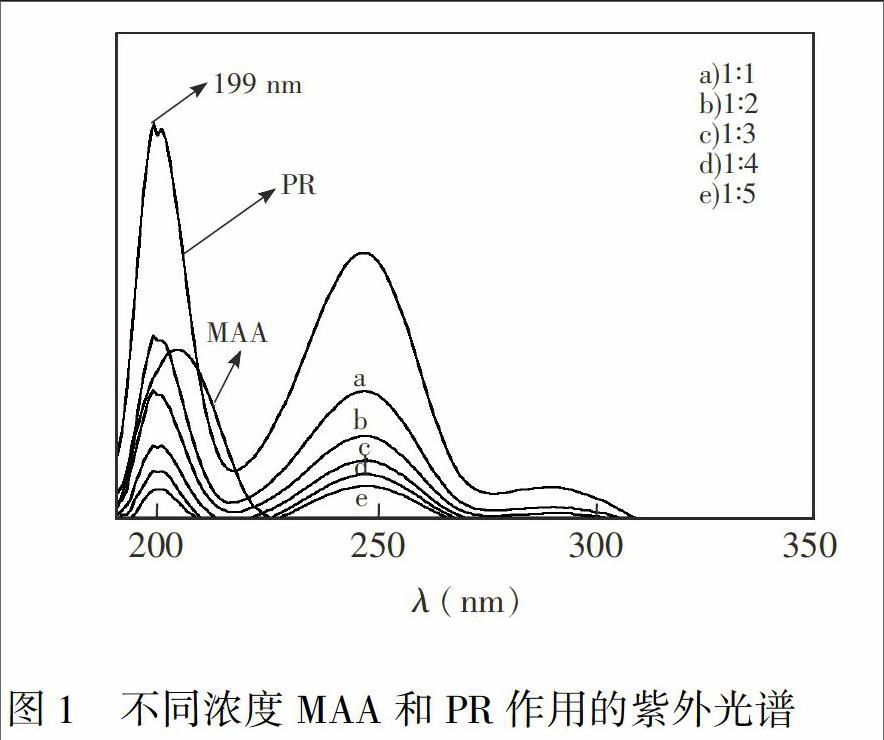
固定PR的浓度为0.05 mmol/L,分别以n(PR)∶n(MAA)=1∶1, 1∶2,1∶3,1∶4,1∶5配制系列浓度的PR和MAA的乙腈混合溶液。超声20 min后,静止3 h,测得紫外谱图。由图1可知,PR在199 nm处有吸收峰,属于π.π*电子跃迁产生的E吸收带; 247 nm处为π.π*电子跃迁产生的B吸收带。PR和MAA结合之后E吸收带发生红移,因为π轨道与π*轨道之间能量差值变小,π.π*跃迁所需能量变小,故发生红移。由此可以推测PR和MAA发生了相互作用,根据PR与MAA的结构推测两者的相互作用力为氢键。随着MAA浓度的增大,峰强度逐渐下降,当配比为1∶3时,峰强度下降幅度开始明显减弱。因为随着MAA浓度的增大,MAA之间出现缔合,峰强度进一步减弱,但由于MAA相互间的氢键作用较弱,故其下降幅度较小。由此推出PR与MAA在配比为1∶3时基本达到饱和。同时,为了进一步对微球表面进行改性,利用核球表面残留的烯基进行亲水壳层枝接,需加入过量的MAA,使核球表面残留烯基增多,增大枝接密度。故制备过程中控制n(PR)∶n(MAA)=1∶4。
结合图4及表1可知,4种微球的PDI都接近于1,说明多分散性能较好。MIPs(PR)粒径约为515 nm, 而其余3种核.壳微球粒径都远大于无壳微球,说明亲水壳已经成功地包裹在核球表面。
3.4 亲水性能研究
分子印迹微球的亲水接触角的测定采用渗透法[20]。1921年,Washburn等[21]导出了液体在毛细管中流动的动力学方程,当毛细管垂直时:
式中, h(cm)为润湿液体上升的高度; t(s)为润湿液体上升的时间; C为常数1; r(cm)为粉末间空隙的毛细管平均半径; θ(°)为润湿液体对粉末的接触角; η (mPa·s)为润湿液体粘度。对粉体而言, C和r为定值; 以h2对t作图,由该直线斜率便可求得Crcosθ值。因此该测定方法称为高度法。
实验中,润湿液体为纯水,水浴温度为25℃,毛细管粒径为5 mm。
为了考察聚合物亲水性能,用渗透法测定4种微球的亲水接触角。由表2可知,4种微球亲水接触角大小为:90°> MIPs (PR) > CS.MIPs(EGDMA) >CS.MIPs(TRIM) > CS.MIPs(MBA),说明其都是亲水的, 且CS.MIPs(MBA)的亲水性能最好。4种微球的浸润性依次增大,也说明其亲水性能是依次增大,符合亲水性能的外观表征。比较3种交联剂结构,TRIM多一个CC,故其与AM交联时,交联程度较高,使亲水壳表面更为致密。而MBA含有酰胺基团,自身亲水性能较好,故所得核.壳微球亲水性能最好。所以,亲水壳交联剂的交联效率及其自身亲水性大小都对核.壳印迹微球的亲水性能有着较大影响。
3.5 静态吸附实验及Scatchard分析
将5 mL系列浓度的扑热息痛乙腈溶液分别置于25 mL具塞锥形瓶中,各加入20 mg聚合物,室温振荡12 h,离心并取上清液, 用紫外分光光度计测定平衡吸附溶液中扑热息痛的吸光度,计算吸附量,并绘制平衡吸附量对平衡浓度的关系曲线。平行测定3次取平均值。
其中, Q为印迹聚合物对扑热息痛的吸附量 (μmol/g); C0为初始浓度 (mmol/L); C为吸附后浓度 (mmol/L); V为溶液的体积 (mL); m为印迹聚合物的质量 (g)。
由图5可知,随着初始浓度增大,聚合物吸附量逐渐增大最后达到吸附平衡。曲线A和a有着相同的趋势,而A的吸附量要远大于a,因为印迹微球洗脱之后内部存在空穴; 而非印迹微球没有空穴,故其吸附量相对较小。
对比3种核.壳微球及无壳微球,核.壳微球的吸附量大于无壳型微球。原因可能是:亲水壳中存在空穴,可以吸附模板分子,增大了其吸附量。
为了验证上述观点,采用Scatchard模型评价MIPs的结合特性, 确定平衡结合常数以及结合位点的种类。
Q/C=(Q max-Q)/Kd(4)
其中, Q max(μmol/g)为聚合物最大吸附量, Kd (mmol/L)为吸附平衡常数, C(mmol/L)为吸附平衡时溶液浓度。
由图6可知, 未枝接亲水壳时,Scatchard曲线为一条直线,可得知微球内只有一种结合位点; 而枝接之后,Scatchard曲线拟合为两条直线,由此可知PR在核.壳型微球上有两种亲和力不同的结合位点。这是由于在形成亲水壳时,模板分子分别与AM通过氢键作用结合,通过交联形成了立体结构,因此有着额外的结合位点。由表3列出的吸附平衡常数可以得知,B1和b2与A和a在数值上接近,可以推出其为MAA特异性结合位点,而B2和b1为AM结合位点,从而验证了上述推测。
3.6 特异性吸附实验
称取20 mg聚合物置于25 mL具塞锥形瓶中,分别加入5 mL,5 mmol/L的扑热息痛、对硝基苯酚及对苯二酚的乙腈.水 (1∶1, V/V)溶液,室温振荡12 h,按上述方法计算吸附量并计算分配系数Kd及分离因子α[23]:
K=Cp/Cs; α=Κi/Kj(5)
其中, Cp为聚合物所结合底物的浓度, Cs为溶液中底物浓度, i和j分别为模板分子和底物分子,规定i=j时,α=1。
选择两种结构类似物对硝基苯酚和苯二酚作为底物,分别进行吸附实验。从表3可知,MIPs对于PR的分配系数明显大于其它两种底物。比较3种底物的结构式可知,3种物质的结构空间大小相似,但PR与MAA在3个位置上都出现了氢键之间的结合,而对硝基苯酚只有一个结合位点,对苯二酚有两个结合位点,其与MAA的结合并不牢固,在振荡的作用下可以轻易脱离,表现出较小的吸附量。而PR与MAA之间结合较为牢固,使得被吸附的PR分子不易脱离,故其分配系数远大于其余两种结构类似物,表现为特异性吸附。核.壳型分子印迹聚合物由于亲水壳中也出现特异性结合位点,故其分配系数更大。NIPs对于3种底物的α值都比较接近1,说明非印迹微球对于底物的吸附为非选择吸附。
3.7 动态吸附实验
称取20 mg CS.M/NIPs(EDGMA)于25 mL具塞锥形瓶中,加入5 mL 5 mmol/L扑热息痛.乙腈溶液,振荡不同时间,计算吸附量Q,绘制吸附量Q对时间t的吸附动力学曲线。实验结果如图7所示。
初始90 min内,CS.MIPs和CS.NIPs的吸附量快速增加,150 min后吸附逐渐达到平衡。相同时间内CS.MIPs的吸附量远高于CS.NIPs说明CS.MIPs存在特殊的结合位点,能提高其吸附性能。将吸附动力学数据用准二级动力学方程[18]进行拟合, 得到方程y=0.00771x+0.60225, R=0.99903; y=0.02913x+100812, R=0.99927。
3.8 循环使用实验
称取50 mg CS.MIPs(EDGMA)于50 mL离心管中,加入25 mL 5 mmol/L扑热息痛乙腈溶液,常温振荡吸附120 min,离心并测上清液中PR浓度,然后洗脱至检测不到PR。重复以上步骤,考察聚合物的再生性能。结果如图8所示, 聚合物初次对模板分子的吸附量为88 μmol/g,7次洗脱之后吸附量是75 μmol/g, 吸附量下降14.5%, 说明聚合物可在短期内循环使用。
4 结 论
结合蒸馏沉淀法和自由基聚合反应制备了亲水核.壳型扑热息痛分子印迹聚合物,其在乙腈.水(1∶1, V/V)溶液中表现出较高的特异性吸附性能。通过改变交联剂种类对聚合物在水中的分散性和吸附量进行了优化。这种亲水印迹微球的制备方法,不受功能单体选择的局限性,可以快速、简便地在疏水分子印迹微球表面包裹一层亲水层,从而使得微球具有亲水性。同时,聚合物重复使用7次吸附率仍在85%以上,表明聚合物具有亲水性好、易制备、成本低、重复性好等优点,使其在扑热息痛检测方面具有潜在的应用前景。
References
1 Sandrini M, Romualdi P, Vitale G, Morelli G, Capobianco A, Pini L A, Candeletti S. Biochem. Pharmacol., 2001, 61(11): 1409-1416
2 Dewani A.P, Dabhade S M, Bakal R L, Gadewar C K, Chandewar A V, Patra S. Arabian J. Chem., 2015, 8(4): 591-598
3 Dana N. Haj.Ali, Imad I. Hamdan. Saudi. Pharma. J., 2010, 18(4): 233-237
4 Abdul Rauf Khaskheli, Jan Fischer, Jií Barek, Vlastimil Vyskoil, Sirajuddin, Muhammad Iqbal Bhanger. Electrochim. Acta, 2013, 101: 238-242
5 Praveen Kumara S, Giribabua K, Manigandana R, Munusamya S, Muthamizha S, Padmanabana A, Dhanasekarana T, Sureshb R, Narayanan V. Electrochimi Acta, 2016, 194 : 116-126
6 WANG Ru.Juan, MA Ying.Xia, LU Cui.Ping, LI Tao, DU Xue.Yan. Acta Chimica Sinica, 2014, 72(5): 557-582
王茹娟, 马应霞, 路翠萍, 李 涛, 杜雪岩. 化学学报, 2014, 72(5): 557-582
7 Xie J Q, Cai C Q , Lai S Z, Yang L, Luo L, Yang H, Chen Y, Chen X M. React. Funct. Polym, 2013, 73(12): 1606-1611
8 Whitcombe M J, Chianella I, Larcombe L. Chem. Soc. Rev., 2011, 40(3): 1547-1571
9 MA Ming.Ming, LIU Cheng.Long, SU Xin.Ke, AN Feng.Qiu, ZHANG Wei. Chinese J. Anal. Chem., 2015, 43(7): 1021-1026
马明明, 刘承龙, 苏新科, 安凤秋, 张 炜. 分析化学, 2015, 43(7): 1021-1026
10 Lakshmi D, Prasad B B, Sharma P S. Talanta, 2006, 70(2): 272-280
11 LIU You.Qin, XU Li, YAN Yun, XU Yue.Hua. Journal of Instrumental Analysis, 2007, 26(3): 450-454
刘有芹, 徐 莉, 颜 芸, 徐悦华. 分析测试学报, 2007, 26(3): 450-454
12 Kim A, Li C R, Jin C F. Chemosphere, 2007, 68(7): 1204-1209
13 Mohajeri S A, Malaekeh N B, Sadegh H. Drug Dev. Ind. Pharm., 2012, 38(5): 616-622
14 MAO Yan.Li, NIU Yun.Feng, WU Jun.Feng, KANG Hai.Yan, LI Dong, WANG Xiang.Wen. Chinese J. Anal. Chem., 2016, 44(6): 915-922
毛艳丽, 牛云峰, 吴俊峰, 康海彦, 李 东, 王巷文. 分析化学, 2016, 44(6): 915-922
15 Li C X, Ma Y, Niu H, Zhang H Q. ACS Appl. Mater. Interfaces, 2015, 7 (49): 27340-27350
16 LU Xian.Yong, HUANG Da, YANG Xin.Lin, HUANG Wen.Qiang. Acta Polymerica Sinica, 2007, (2): 103-107
鹿现永, 黄 达, 杨新林, 黄文强. 高分子学报, 2007, (2): 103-107
17 Bai F, Yang X L, Huang W Q. Macromolecules, 2004, 37(26): 9746-9752
18 WU Shi.Kang, WANG Peng.Fei. Molecular imprinting: From Fundamentals to Applications. Beijing: Science Press, 2006: 16
吴世康, 汪鹏飞. 分子印迹学—从基础到应用. 北京: 科学出版社, 2006: 16
19 ZHANG Han, YANG Xin.Lin. Polymer Bulletin, 2010, (7): 9-23
张 晗, 杨新林. 高分子通报, 2010, (7): 9-23
20 SHEN Dong.Mei, XIAO Ju.Qiang, CHEN Xiao.Juan. Sulphur Phosphorus & Bulk Materials Handling Related Engineering, 2007, 1: 9-12
沈冬梅, 肖举强, 陈晓娟. 硫磷设计与粉体工程, 2007, 1: 9-12
21 Washburn E W. Phys. Rev., 1921, 17(3): 273-283
22 Qian.Cutrone J F, Hartz R, Ahuja V T, Vrudhula V M, Wu D R, Dalterio R A, Wang.Lverson D, Bronson J J. J. Pharm. Biomed. Anal., 2011, 54(3): 602-606
23 Dai J D, Zhou Z P, Zhao C Y, Wei X, Dai X H, Gao L, Cao Z J, Yan Y S. Ind. Eng. Chem. Res., 2014, 53(17): 7157-7166
Abstract Molecular imprinted polymer cores (MIPs) were prepared through distillation.precipitation polymerization with methacrylic acid (MAA) as the functional monomer and paracetamol (PR) as the template molecule. Then, the hydrophilic shells were grafted successfully by free radical polymerization with acrylamide (AM) as the hydrophilic monomer. The influences of different shell cross.linking agents such as ethylene glycol dimethacrylate (EGDMA), trimethylolpropane triacrylate (TRIM), and N,N′.Methylenebisacrylamide (MBA) on the hydrophilic property were investigated. The resulting MIPs were characterized by various tests, including ultraviolet spectrometry (UV), Fourier transform infrared spectroscopy (FT.IR), and scanning electron microscope (SEM). The absorbing test and contact angle measurement were also carried out for the investigation of hydrophilic property of microspheres. The results showed that MBA was the best shell cross.linking agent of the microspheres, and the adsorption capacity and contact angle of this prepared microsphere could reach 120 μmol/g and 23.3°, respectively. Core.shell (CS).MIPs provide a new thought for detection of PR in aqueous solution.
Keywords Hydrophilic; Core.shell; Distillation.precipitation polymerization; Free radical polymerization; Molecular imprinted polymers; Paracetamol