碱性蛋白酶酶解谷朊粉制备谷朊粉蛋白多肽的研究
2014-07-25刘爱国吴子健纪瑞庆
赵 源,刘爱国,吴子健,纪瑞庆
(1.天津商业大学生物技术与食品科学学院,天津 300134;2.天津市食品生物技术重点实验室,天津 300134)
谷朊粉是小麦淀粉生产的副产物,其蛋白质含量非常丰富,含量能够达到80%以上,且氨基酸组成比较齐全,钙、磷、铁等矿物质含量较高,是营养丰富、物美价廉的植物性蛋白源[1]。但谷朊粉蛋白是一种缺乏亲水性氨基酸残基的蛋白质,这导致谷朊粉蛋白的水溶性不高,因而使其应用受到很大的局限性[2]。碱性蛋白酶是一种限制性内切酶,在碱性蛋白酶的作用下,谷朊粉中蛋白质会伴随着结构的重组变化,使一些原来包埋在谷朊粉蛋白质内部的疏水性氨基酸暴露,谷朊粉蛋白会被水解成具有一定功能性的肽链,并且可以极大地提高其溶解性,使其具有新的营养、功能和生物特性[3],因而使其能够被更加广泛的应用于饲料和食品行业[4]。
近年来国内外对于谷朊粉的酶法水解研究很多,国外对于谷朊粉酶解物抗氧化肽、降血压肽谷氨酰胺肽的制备也有较多报道[5-8]。如洪宇波等[9]采用碱性蛋白酶水解小麦谷朊粉制备ACE抑制肽,并对工艺进行优化研究,优化后其抑制率比优化前提高40.7%。刘立芳等[10]以谷朊粉为原料,采用中性蛋白酶制备抗氧化多肽,并对酶解工艺进行优化。结果表明,对中性蛋白酶酶解谷朊粉制备抗氧化多肽的影响顺序依次为酶解温度>加酶量>酶解时间;通过响应面分析优化酶解条件为底物浓度8%,加酶量2800U/g,温度52℃,时间280min,此时酶解液羟自由基清除率达到65.3%,多肽含量为60.4mg/mL。此外,林琳[11]、闰桂强等[12]也分别研究了谷朊粉酶解物的体外抗氧化性。
本实验通过对碱性蛋白酶催化酶解小麦谷朊粉的条件进行系统的研究,确定碱性蛋白酶酶解小麦谷朊粉蛋白的最佳工艺条件,为小麦谷朊粉蛋白生物活性肽的制备以及其在生物、食品和饲料工业中的广泛应用提供参考。
1 材料与方法
1.1 材料与仪器
谷朊粉 市售;碱性蛋白酶 广州市博仕奥生物科技有限公司;茚三酮 上海伯奥生物科技有限公司;NaCl、NaOH、HCl等试剂 分析纯级,天津市风船化学试剂科技有限公司。
EMS-9A磁力加热搅拌器 天津市欧诺仪器仪表有限公司;AUW120D电子天平 SHIMADZU公司;3-18K低温高速离心机 德国Sigma公司;UDK159自动凯氏定氮仪 VELP SCIENTIFIC公司;FDU-810冷冻干燥机 日本东京理化公司;XMTB数显式恒温水浴锅 北京市长风仪器仪表公司;HD-5电脑紫外检测仪、CXG-1层柜、BT-100恒流泵 上海沪西分析仪器厂有限公司。
1.2 实验方法
1.2.1 工艺流程 谷朊粉→NaOH溶液溶解→恒温搅拌→加酶→恒温搅拌(4℃,1h)→离心(4℃,7500r/min,15min)→弃沉淀取上清→透析除盐(4℃,3.5ku,24h)→冷冻干燥(-72℃,24h)→谷朊粉蛋白多肽粗品。
1.2.2 测定方法
1.2.2.1 粗蛋白含量的测定 凯氏定氮法(GB/T 5511-2008),蛋白质换算系数为5.7。
1.2.2.2 脂肪含量的测定 参考GB/T 5009.5-2003。
1.2.2.3 水分含量的测定 参考GB/T 5009.3-2003。
1.2.2.4 淀粉含量的测定 参考GB/T 2019.4-2006。
1.2.2.5 灰分含量的测定 参考GB/T 5009.4-2010。
1.2.2.6 碱性蛋白酶的活力测定 碱性蛋白酶按福林酚法(GB/T 23527-2009)测定酶活。
1.2.2.7 水解度(DH)的测定 在中性和碱性的条件下采用pH-state法[13-16]。
pH-state法主要是基于蛋白质水解过程中总是要伴随质子的释放或吸收,质子化的多少依赖于溶液的pH,通过加入用于维持体系pH的碱或酸量直接计算出水解度。计算公式如下:
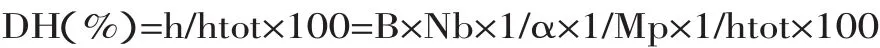
式中:B:碱液的体积(mL);Nb:碱液的浓度mol/L;α:是氨基的离解度;Mp:底物中蛋白质总含量,g;htot:每克谷朊粉蛋白的肽键毫摩尔数,mmol/g;对小麦谷朊粉蛋白,htot取8.38;1/α取2.26[17]。
1.2.3 单因素实验对谷朊粉蛋白酶解条件的研究
1.2.3.1 酶解时间对谷朊粉水解度的影响 称取10g谷朊粉,按底物浓度[S]=10%的比例溶于0.1mol/L、pH=8.0的NaOH溶液中,在水浴锅中水浴加热保持至55℃,按酶浓度[E]/[S]=5%的比例加入碱性蛋白酶,搅拌,分别保持1.0、1.5、2.0、2.5、3.0、3.5、4.0h,采用pH-state法分别测其在不同的酶解时间下的水解度。
1.2.3.2 底物浓度对谷朊粉蛋白水解度的影响 称取10g谷朊粉,按底物浓度[S]=7%、8%、9%、10%、11%、12%的比例溶于0.1mol/L、pH=8.0的NaOH溶液中,在水浴锅中水浴加热保持至55℃,按酶浓度[E]/[S]=5%的比例加入碱性蛋白酶,搅拌,保持2.5h,采用pH-state法分别测其在不同底物浓度下的水解度。
1.2.3.3 酶浓度对谷朊粉蛋白水解度的影响 称取10g谷朊粉,按底物浓度[S]=9%的比例溶于0.1mol/L、pH=8.0的NaOH溶液中,在水浴锅中水浴加热保持至55℃,按酶浓度[E]/[S]=2%、3%、4%、5%、6%、7%的比例加入碱性蛋白酶,搅拌,保持2.5h,采用pH-state法分别测其在不同酶浓度条件下的水解度。
1.2.3.4 溶液pH对酶解反应的影响 称取10g谷朊粉,按底物浓度[S]=9%的比例分别溶于0.1mol/L、pH=7.0、7.5、8.0、8.5、9.0的NaOH溶液中,在水浴锅中水浴加热保持至55℃,按酶浓度[E]/[S]=4%的比例加入碱性蛋白酶,搅拌,保持2.5h,采用pH-state法分别测其在不同的溶液pH下的水解度。
1.2.3.5 温度对酶解反应的影响 分别称取10g谷朊粉,按底物浓度[S]=9%的比例溶于0.1mol/L、pH=8.0的NaOH溶液中,在水浴锅中水浴加热保持至45、50、55、60、65℃,按酶浓度[E]/[S]=4%的比例加入碱性蛋白酶,搅拌,保持2.5h,采用pH-state法分别测其在不同的酶解温度下的水解度。
1.2.4 正交法优化制备谷朊粉蛋白多肽的酶解条件研究 在单因素实验的基础上,为了进一步验证和探索谷朊粉蛋白多肽最佳的酶解条件,以底物浓度、溶液pH、酶浓度、酶解温度、酶解时间为因素,采用L16(45)的实验方案进行正交实验,L16(45)正交设计表格如表1所示。
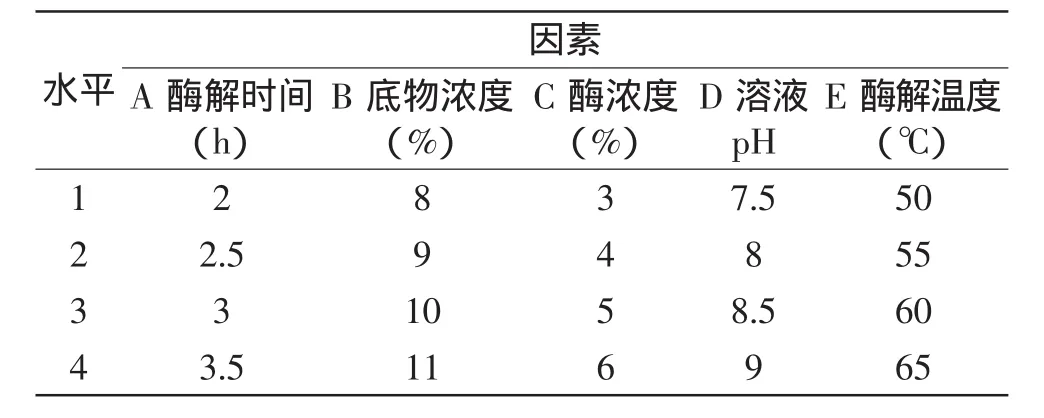
表1 L16(45)正交实验因素与水平表Table 1Factors and levels of orthogonal experiment L16(45)
1.2.5 利用Tricine SDS-PAGE测谷朊粉酶解多肽的分子量 将在最佳酶解条件下制得的谷朊粉蛋白多肽配制成1mg/mL的溶液,以相同的比例和上样缓冲液混合振荡,在沸水浴中煮沸10min,然后以10000r/min的速率离心15min。配制16.5%分离胶和5%的浓缩胶,每次上样10μL,调节浓缩胶电压至80V,分离胶电压至150V,经固定、染色、脱色后观察分离胶上条带。
2 结果与分析
2.1 谷朊粉的化学组成
谷朊粉的化学组成成分如表2所示。
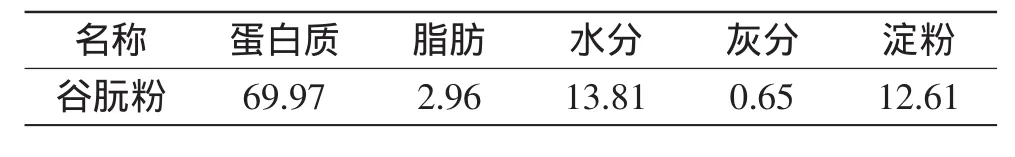
表2 谷朊粉的化学组成(%)Table 2 The chemical compositions of wheat gluten(%)
2.2 酶活的测定
通过福林酚法测得实验所用的碱性蛋白酶酶活为2.647×105U/g。
2.3 碱性蛋白酶酶解反应的单因素实验
2.3.1 酶解时间对谷朊粉水解度的影响 由图1可知,随着酶解时间的增长,谷朊粉蛋白水解度逐渐增大且增大速度较快,水解2.5h后酶解继续进行,但水解的多是小分子部分,随着酶不断被消耗,活性降低,与酶作用的肽键逐渐减少,水解度变化不大。而且反应时间过长,受美拉德反应等的影响,获得的肽溶液颜色加深、不良气味加浓,所以确定酶解最适宜的反应时间为2.5h。
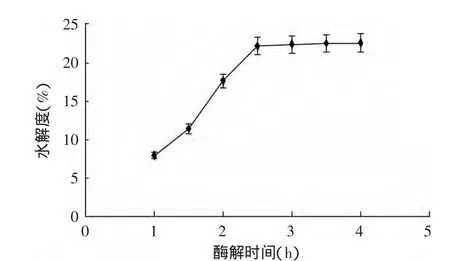
图1 酶解时间对谷朊粉水解度的影响Fig.1 Effect of enzymolysis time on the hydrolysis degree of wheat gluten
2.3.2 底物浓度对谷朊粉蛋白水解度的影响 由图2可知,当底物浓度过低时,虽然谷朊粉蛋白更加容易分散,但是单位质量的酶所接触的底物有限,造成水解度过低,不利于工业化的大规模生产;底物浓度太高,由于谷朊粉蛋白难溶于水,浓度过大会造成谷朊粉蛋白分散困难,甚至结团,阻碍了碱性蛋白酶与底物的充分接触,水解度逐渐下降。当底物浓度[S]=9%时水解度最高,水解度为22.90%。
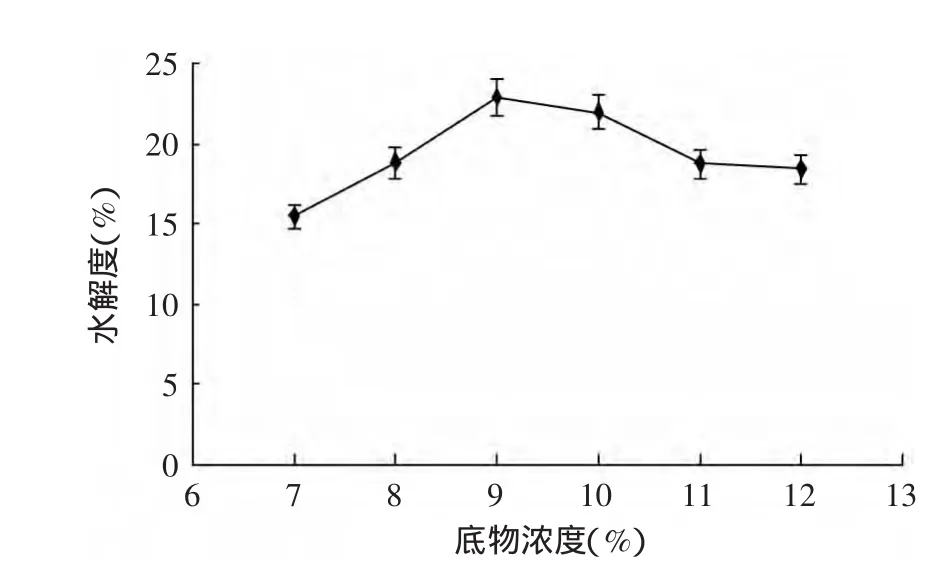
图2 底物浓度对谷朊粉水解度的影响Fig.2 Effect of substrate concentration on the hydrolysis degree of wheat gluten
2.3.3 酶浓度对谷朊粉蛋白水解度的影响 由图3可知,过少的酶,使反应速度降低,无法得到多肽的高得率的产品。酶浓度高,会加速酶解反应,但酶浓度到达一定水平以后水解程度就变化不明显,酶量太大会干扰酶解物的组成[17],并且大大增大成本,所以确定酶解反应的酶浓度为4%。
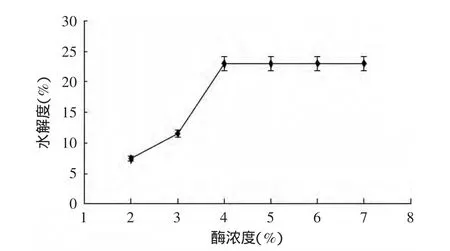
图3 酶浓度对谷朊粉水解度的影响Fig.3 Effect of enzyme concentration on the hydrolysis degree of wheat gluten
2.3.4 溶液pH对酶解反应的影响 酶解反应都有最适的酸碱度,pH过低或过高都不利于酶活性的表达,造成酶解反应水解度的降低,由图4可知,随着溶液pH的不断增加,小麦谷朊粉的水解度先增大后变小,在pH=8.0时,谷朊粉的水解度最大。初步确定pH=8.0为谷朊粉蛋白酶解的最佳pH。
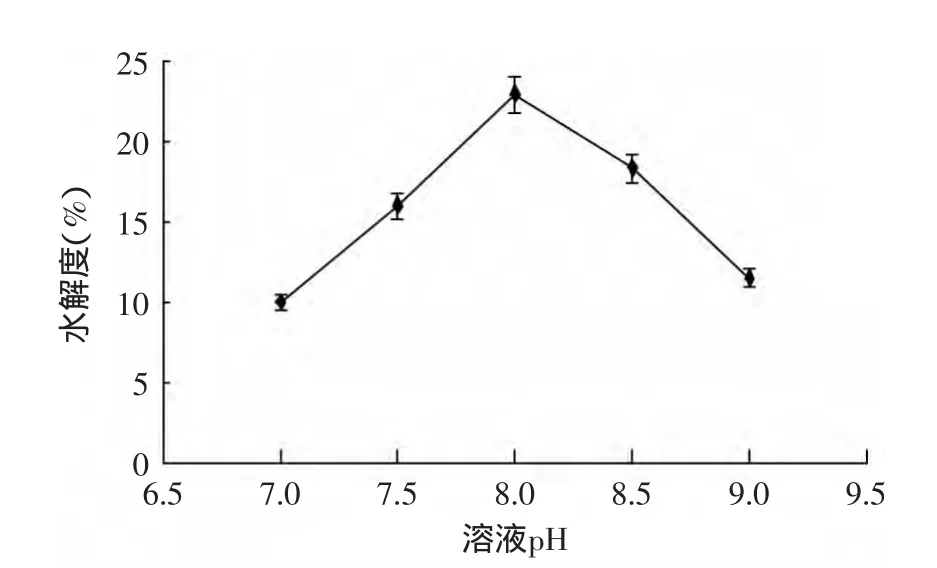
图4 溶液pH对谷朊粉水解度的影响Fig.4 Effect of pH on the hydrolysis degree of wheat gluten
2.3.5 温度对酶解反应的影响 酶解反应都有其最适温度,一般在酶的最适温度以下,随着温度的升高反应物的能量和分子间有效接触的频率增加,因而反应速度加快。温度过高,酶分子的空间结构由于能量的增加而发生改变,导致酶活性的减弱或丧失,由图5可知,随着酶解温度的升高,小麦谷朊粉的水解度先增大后变小,碱性蛋白酶的最适温度在50~60℃,初步确定碱性蛋白酶酶解谷朊粉的最适温度为55℃。
2.4 碱性蛋白酶酶解谷朊粉反应的正交实验
正交实验结果及各因素对提取条件的极差分析如表3所示,正交实验结果的方差分析如表4所示。
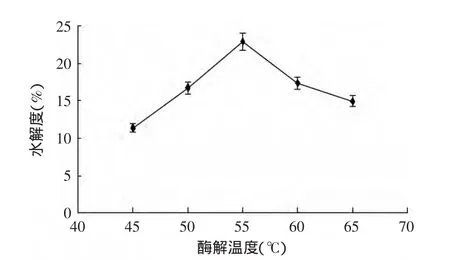
图5 酶解温度对谷朊粉水解度的影响Fig.5 Effect of enzymolysis temperature on the hydrolysis degree of wheat gluten
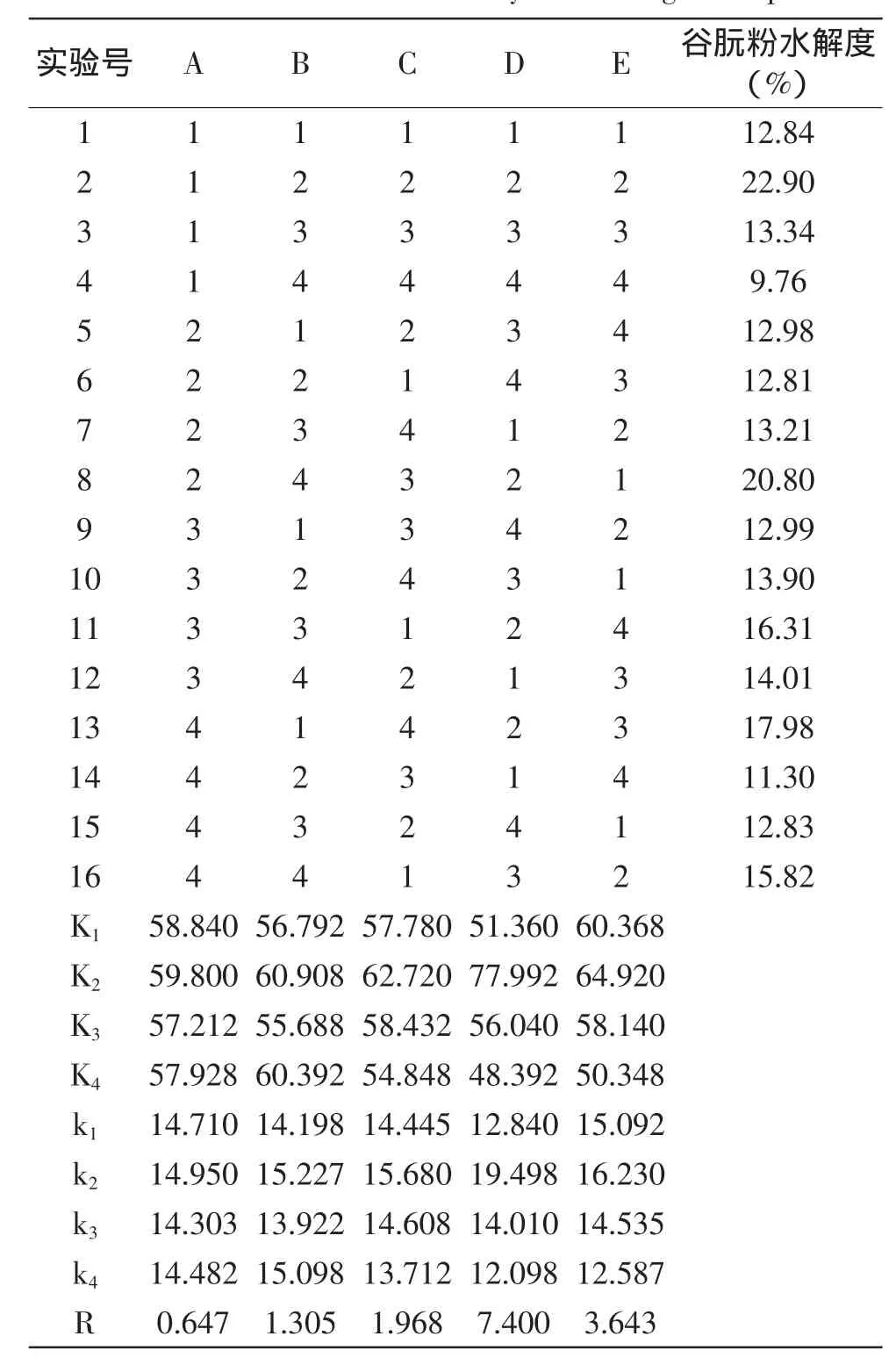
表3 正交实验结果及极差分析Table 3 Results and intuitionm analysis of orthogonal experiment
由正交表极差分析k值可得,五个因素中均为第2个水平的数值最高,最优组合为A2B2C2D2E2,即为酶解时间2.5h、底物浓度9%、酶浓度4%、pH=8.0、酶解温度55℃;由极差分析结果可知:RD>RE>RC>RB>RA,因此,五个因素对谷朊粉水解度的影响的重要性依次为:pH、酶解温度、酶浓度、底物浓度、酶解时间。
由表4的方差实验分析结果可知:pH对谷朊粉水解度具有显著的影响。
2.5 验证实验
根据优化条件进行重复验证实验,称取15g谷朊粉,按底物浓度[S]=9%的比例溶于0.1mol/L、pH=8.0的NaOH溶液中,在水浴锅中水浴加热保持至55℃,按酶浓度[E]/[S]=4%的比例加入碱性蛋白酶,搅拌,保持2.5h,采用pH-state法分别测其水解度为22.96%,在此条件下,酶解反应水解度大幅提高。表明实验中所设模型与实际情况相符,正交实验结果数据可靠。
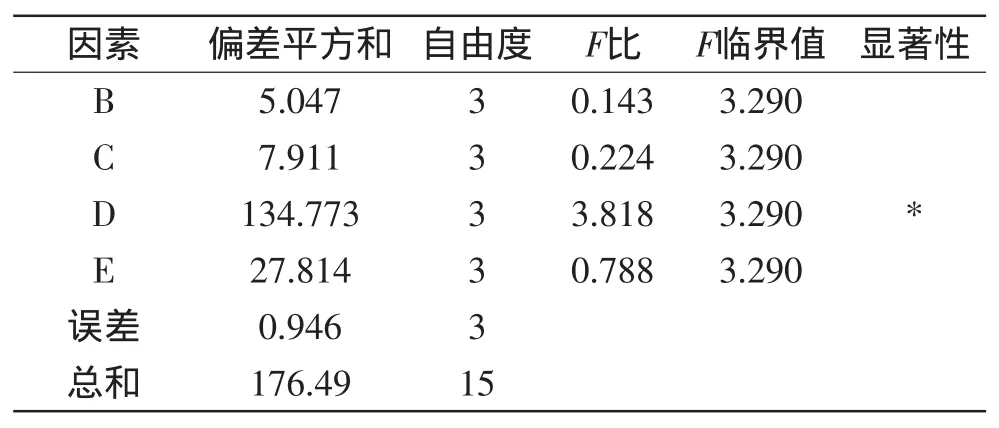
表4 方差分析Table 4 Variance analysis
2.6 利用Tricine SDS-PAGE测谷朊粉酶解多肽的分子量
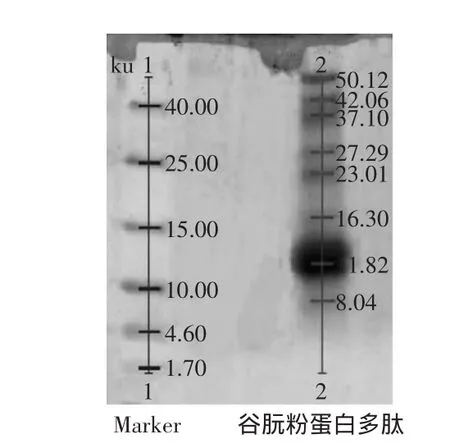
图6 谷朊粉蛋白多肽的Tricine SDS-PAGE图谱Fig.6 Tricine SDS-PAGE pectrum of Gluten polypeptide
由图6可知,谷朊粉经碱性蛋白酶在最佳的酶解条件下所得的谷朊粉蛋白多肽的分子量分布范围在8.04~50.12ku之间,且比较分散;在此酶解条件下,分子量为11.82ku的谷朊粉蛋白多肽含量最高,通过Bio-Rad公司的1D凝胶分析软件quantity one,测得其占麦谷蛋白多肽总量的57.3%。
3 结论
本实验研究了碱性蛋白酶酶解谷朊粉制备谷朊粉多肽的工艺,分析了酶解时间、底物浓度、酶浓度、pH、酶解温度五个因素对碱性蛋白酶酶解小麦谷朊粉的水解度的影响,通过单因素实验和正交实验设计建立了碱性蛋白酶水解谷朊粉的数学模型,并以此模型进行优化,得到碱性蛋白酶水解谷朊粉蛋白的最佳水解工艺为:酶解时间2.5h、底物浓度9%、酶浓度4%、pH=8.0、酶解温度55℃,在此条件下其水解度达到22.96%,其中五个因素对谷朊粉水解度的影响的重要性依次为:pH>酶解温度>酶浓度>底物浓度>酶解时间。在最佳酶解条件下制备的谷朊粉蛋白多肽粗品经Tricine SDS-PAGE测得各组分蛋白多肽的分子量分布在8.04~50.12ku之间。此实验可为今后研究谷朊粉蛋白活性肽以及谷朊粉蛋白多肽在食品和饲料行业中的运用提供广泛参考依据,具有重大的意义。
[1]彭海萍,彭凤霞.可食性小麦蛋白膜的研究[J].现代科技,2003(3):42-44.
[2]何慧如,詹朝,马美蓉,等.碱处理面筋蛋白功能之探讨[J].食品科学(台),1992(2):241-252.
[3]齐军茹,杨晓泉,彭志英.控制酶解小麦面筋蛋白的研究[J].食品工业科技,2003,24(9):43-45.
[4]吴爽,朱科学,周慧明.酶解谷朊粉的研究进展[J].粮食与食品工程,2012(2):39-44.
[5]Cornel H J.Partialin vitrodigestion of active gliadin related peptides in celiac disease[J].Journal of Protein Chemistry,1998,17(8):739-744.
[6]Cornel H J.Partialin vitrodigestion of active gliadin related peptides in celiac disease[J].Journal of Protein Chemistry,1998,17(8):739-744.
[7]Suetsuna K,Chen J R.Isolation and characterization of peptides With antioxidant activity derived from wheat gluten[J].Food Science and Technology Research,2002(32):27-230.
[8]齐军茹,王兰,李瑜.中性蛋白酶对小麦面筋蛋白的水解改性研究[J].郑州工程学院学报,2001(4):46-49.
[9]洪宇波,史劲松,张卫明,等.谷朊蛋白制备ACE抑制肤的酶解工艺优化[J].食品研究与开发,2008,29(6):15-20.
[10]刘立芳,徐怀德,王青林.中性蛋白酶酶解谷朊粉制备抗氧化多肽研究[J].西北农林学报,2008,17(6):281-285.
[11]林琳,张玲,崔凤杰,等.双酶法水解小麦面筋蛋白提高产物抗氧化活性[J].食品科技,2009,34(12):186-190.
[12]闫桂强,王文兵,崔凤杰,等.中性蛋白酶水解小麦面筋蛋白的条件优化[J].食品工业科技,2009(2):178-180.
[13]Jens Adler-Nissen.Determinationof the degree of hydrolysis of food protein hydrolysates by trinitrobenzenestdfonic acid[J].A-gric Food Chem,1979,27(6):1256-1262.
[14]Magdalena Karamac,Ryszard Amarowicz,Henryk Kostyra.Effectoftemtperature and enzyme/substrate ratio on the hydrolysisof peaprotein isolates by trypsin[J].Czech J Food Sci,2002,20(1):1-6.
[15]Marquez M C,Fernandez V.pH-state method to evaluate the heat inactivation of subtilisin inhibitor in legumes[J].Chembiochem Eng Q,2002,16(1):31-35.
[16]J Adler-Nissen.Enzymatic hydrolysis of food proteins[J].Process Biochemistry,1977,27(1):18-23.
[17]孔祥珍,周惠明,王洪燕.碱性蛋白酶水解小麦面筋蛋白的研究[J].食品工业科技,2006,27(9):104-105.
