痛经宁颗粒微生物限度检查方法的验证
2014-05-02洪亮
洪 亮
(浙江省台州市食品药品检验所,浙江 台州 318000)
痛经宁主要由当归(酒炒)、香附(醋制)、白芍(炒)、丹参、延胡索(醋制)、川楝子(炒)、川芎(炒)、炙甘草、红花等组方,具有调经止痛的功效[1]。当归、香附、白芍、丹参、川芎等药所含有效成分或提取物中,单个或多个组分对细菌及霉菌均有一定的抑制作用。根据其用途、成分和制法,按2010年版《中国药典(一部)》微生物限度检查法[2],在对具有抗菌活性的药物进行微生物限度检查时,应首先消除其抗菌活性,并对所用方法进行验证,以确定是否适用[3]。
1 仪器、材料与试药
万级空气净化间、百级净化台、生物安全柜(杭州金利净化工程有限公司);LDZX-50FBS型电热压力蒸汽灭菌器(上海申安医疗器械厂);电子天平(常熟双杰测试仪器厂);DAG-9248A型电热恒温鼓风干燥箱,GNP-9270型恒温培养箱,霉菌培养箱(上海精宏实验设备有限公司);80-2型离心沉淀器(上海手术器械厂)。大肠埃希菌[CMCC(B)44102]、金黄色葡萄球菌 [CMCC(B)26003]、枯草芽孢杆菌 [CMCC(B)63501]、白色念珠菌 [CMCC(F)98001]、黑曲霉 [CMCC(F)98003],均由浙江省食品药品检验研究院提供。营养琼脂培养基(批号为130129)、改良马丁培养基(批号为 1201062)、改良马丁琼脂斜面培养基(批号为 120913)、营养肉汤培养基(批号为120614)、玫瑰红钠琼脂培养基(批号为1212152)、胆盐乳糖培养基(批号为120306)、4-甲基伞形酮葡糖苷酸培养基(MUG,批号为101020),均购自北京三药科技开发公司。pH=7.0的无菌氯化钠-蛋白胨缓冲液(青岛蓝雁绿检生物技术有限公司,批号为20130521),0.9%无菌氯化钠溶液(安徽双鹤药业有限责任公司,批号为130118)。痛经宁颗粒(浙江万邦药业股份有限公司,批号分别为 D13130101,D13130102,D13130103,规格为每包12 g,生产日期为2013年1月24日)
2 方法与结果
2.1 菌液与供试液的制备
接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养琼脂培养基中,在30~35℃下培养18~24 h;接种白色念珠菌的新鲜培养物至改良马丁培养基中,在23~28℃下培养24~48 h后,将上述培养物用0.9%无菌氯化钠溶液制成每1 mL含菌数为50~100 cfu的菌悬液;接种黑曲霉菌的新鲜培养物至改良马丁琼脂斜面培养基中,培养5~7 d,加入3~5 mL含0.05% (mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱后吸出孢子悬液至无菌试管内,用含0.05%(mL/mL)聚山梨酯80的0.9%无菌氯化钠溶液制成每1mL含孢子数50~100 cfu的孢子悬液[2]。称取样品10 g至灭菌锥形瓶中,加入温度约为45℃、pH=7.0的无菌氯化钠-蛋白胨缓冲液至100 mL,不断振荡混匀,制成1∶10的供试液。
2.2 细菌、霉菌和酵母菌计数方法的验证
2.2.1 平皿法和培养基稀释法
试验组:1)平皿法。取1∶10供试液,分别注入直径为90mm的平皿中,每个平皿注入 1mL,并分别加入试验菌 1mL(50~100 cfu/mL),分别倾注相应的营养琼脂培养基和玫瑰红钠琼脂培养基15 mL。按大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌顺序平行制备,每种菌制备2个平皿,以下同。2)培养基稀释法。取1∶10供试液1mL,等量分注于5个平皿中,每个平皿中再分别加入试验菌1mL(50~100 cfu/mL),立即倾注相应的琼脂培养基 15 mL。以上制备的平皿分别置 30~35℃下培养 3 d和23~28℃下培养5 d,按平皿法测定其菌数。
菌液组:分别取上述稀释的试验菌液1mL注入平皿内,再倾注相应培养基。每种试验菌平行制备2个平皿,测定所加的试验菌数。
供试品对照组:取1∶10供试液1mL和0.2mL,按照试验组方法操作,不加菌液,测定供试品的本底菌数。
稀释剂对照组:用 PH=7.0的无菌氯化钠-蛋白胨缓冲液替代供试品,加入试验菌,按照试验组方法操作。
结果:见表1。可见,平皿法3次试验5种菌株均不同程度受到了抑制;培养基稀释法3次试验,大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的回收率均超过70%,白色念珠菌、黑曲霉菌则达不到回收率要求,说明此方法对细菌计数有效,须重新建立霉菌和酵母菌计数方法的验证。
2.2.2 薄膜过滤法
1∶10供试液为混悬液,取上液按每膜10mL进行过滤,滤过效率很低,未溶解颗粒堵塞滤孔。而文献[4]和2010年版《中国药典(一部)》表明,采用 500 r/min的速率离心 3 min,对霉菌的回收率影响较大,不宜采用离心法。因此选用每膜1 mL,1∶10供试液进行过滤。
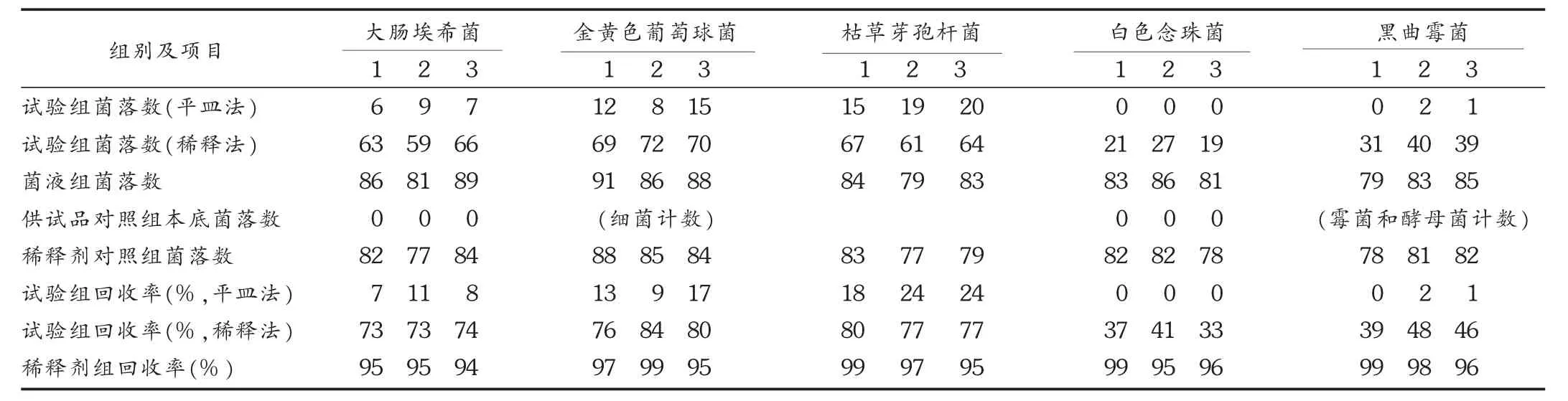
表1 平皿法和培养基稀释法试验结果(%)
试验组:取 1∶10供试液 1 mL加入含 50 mL pH=7.0的无菌氯化钠-蛋白胨缓冲液的灭菌滤器中进行薄膜过滤。接着用pH=7.0的无菌氯化钠-蛋白胨缓冲液进行冲洗,每膜每次冲洗50mL,振摇滤过,分别尝试用每膜200,300,400mL的冲洗量进行冲洗。在最后1次冲洗中,每膜加入试验菌1mL(50~100 cfu/mL),过滤。取出滤膜,菌面朝上,贴于已制备好的玫瑰红钠琼脂平皿里,平行制备2个平皿。置23~28℃下培养5 d,逐日观察,按平皿法测定其菌数。
菌液组:分别取稀释好的白色念球菌、黑曲霉菌2种菌液各1 mL注入平皿内,再倾注玫瑰红钠琼脂培养基。每种试验菌平行制备2个平皿,测定所加的试验菌数。
供试品对照组:取1∶10供试液1mL,按照试验组方法操作,不加菌液,测定供试品的本底菌数。
稀释剂对照组:用pH=7.0的无菌氯化钠-蛋白胨缓冲液1mL替代供试品,加入试验菌,按照试验组方法操作。
结果:见表2。可见,取3次平行试验稀释剂对照组和试验组的菌回收率均在70%以上的最简方法为痛经宁颗粒的菌落计数法。综合表1和表2,可得出细菌计数采用培养基稀释法,霉菌和酵母菌计数采用薄膜过滤法(1∶10供试液1mL/膜+300 mL/膜冲洗量)。
2.3 控制菌检查法的验证[5]
2.3.1 培养基稀释法
试验组取3批样品的1∶10供试液各10mL及10~100 cfu/mL大肠埃希菌菌液1mL加入灭菌锥形瓶中,再分别尝试加入300,400,500 mL胆盐乳糖培养基,于35℃下培养24 h,依大肠埃希菌检查法项下方法进行检查。
2.3.2 控制菌验证结果
由表3可见,在3批样品的平行试验中,采用培养基稀释法(加400 mL胆盐乳糖培养基)为最优方法,试验组检出大肠埃希菌,可按此方法进行痛经宁颗粒的控制菌检查。

表3 大肠埃希菌检查方法验证试验结果
2.4 微生物限度检查验证结果
综合以上验证结果,通过5种试验菌、3次平行试验的回收率方法学验证及控制菌方法验证,得出痛经宁颗粒的微生物限度检查法:细菌计数采用培养基稀释法(每皿0.2mL),霉菌和酵母菌计数采用薄膜过滤法(1∶10供试液1mL/膜+300mL/膜冲洗量),控制菌检查采用培养基稀释法(加400mL胆盐乳糖培养基)。
3 讨论
痛经宁颗粒在水中溶解后为混悬液,故在制备1∶10供试液时,需将稀释液加热至45℃再稀释或放在45℃恒温振荡仪中振摇溶解;同理,在采用薄膜过滤法时,应考虑是否进行低速离心,去除不溶于稀释剂中的药物颗粒。而文献[4]和2010年版《中国药典(一部)》表明,采用 500 r/min的速率离心 3 min,对细菌的回收率影响较小,但对霉菌和酵母菌的回收率影响很大,因此,霉菌和酵母菌计数不宜采用低速离心沉淀法。又因10mL,1∶10供试液很难进行薄膜过滤,未溶于水的药品颗粒会堵塞滤孔,故考虑用每膜1mL,1∶10供试液来进行薄膜过滤。
验证计数方法时,由于样品在水中的溶解性一般,1∶10供试液为混悬液,并对细菌和霉菌均有一定的抑制作用,因此首先尝试常规法和培养基稀释法。根据上述2种方法对各试验菌的回收结果,选择各试验菌回收率在70%以上的方法作为有效方法。
使用薄膜过滤法,冲洗量要适当,由表2可见,冲洗量越多,则薄膜上的微生物损伤越严重,且过大的冲洗量容易使薄膜破损,导致假阴性结果出现。在冲洗过程中,对冲洗液的温度应进行控制,应在40~45℃为宜。过低的温度容易使药物析出,堵塞或吸附在薄膜上;过高的温度容易伤害样品中的污染菌,导致假阴性。每次冲洗时,还应振摇滤器,使吸附在薄膜中的药物更容易被洗脱除去。
除去供试品抑菌作用的方法有培养基稀释法、低速离心沉淀法、薄膜过滤法等,或几法联用[3]。本品中的几味中药材都具有一定的抑菌活性,验证试验结果也表明,供试品对试验菌种均有抑菌作用,因此采用培养基稀释法、薄膜过滤法进行试验,结果各规定菌种的回收率均达到《中国药典》要求[6]。本方法用于痛经宁颗粒的质量控制有效、可行。
参考文献:
[1]WS-10812(ZD-0812)-2002.国家食品药品监督管理局·国家中成药标准汇编[S].
[2]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:附录ⅩⅢC.
[3]苏德模,马绪荣.药品微生物学检验技术[M].北京:华龄出版社,2007:218.
[4]袁林娜,宋 勤.微生物限度检查法中低速离心法回收细菌、真菌试验方法的研究[J].药物分析杂志,2007,27(10):1620-1622.
[5]中国药品生物制品检定所,中国药品检验总所.中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010:351.
[6]黄 英.清热安宫丸等中成药微生物限度检查方法验证[J].中国药业,2013,22(24):38-40.
