PCR仪温度过冲特性有限元仿真研究
2022-05-10孙继贤梁晓会魏名山范志永
张 辰, 孙继贤, 梁晓会, 魏名山, 田 冉,江 斌, 李 征, 范志永
(1. 军事科学院军事医学研究院科研保障中心,北京 100850; 2. 北京理工大学机械与车辆学院,北京 100081;3. 北京林电伟业电子技术有限公司,北京 100097; 4. 公安部第一研究所,北京 102200)
0 引 言
聚合酶链式反应是一种体外扩增特定DNA片段的分子生物学技术[1-2]。PCR的基本步骤分为3步:变性(95 ℃)、退火(55 ℃)和延伸(72 ℃)[3]。经过3个步骤的不断循环,PCR技术可以将微量的DNA片段扩增至初始的数百万倍。因具有特异性强、灵敏度高、操作简便快速、纯度要求低等特点,PCR技术在生物学、医学等领域具有广泛的应用[4-5]。
PCR仪是实施PCR技术的设备载体[6]。它通过控制半导体制冷片(thermal electric cooler,TEC)的输入电流,实现TEC周期性吸热与放热,令反应样品温度达到PCR步骤所需温度并保持一段时间,从而保证3个扩增反应步骤的循环[7]。在实际过程中,针对TEC的控制大多基于PID调节,故在升/降温的终止时刻,常常出现温度控制超调现象,亦称为温度过冲现象[8]。有限的温度过冲有利于试液的快速变温,而过量的温度过冲会导致试液中聚合酶失活等严重后果[9]。由此可见,PCR仪的温度过冲特性对DNA片段扩增效果有重要影响。
目前针对PCR仪的研究大多集中在温度控制算法方面,有关其传热特性仅有少数学者开展过研究。黄靖等[10-11]运用ABAQUS有限元软件仿真研究了TEC匹配差异、导热胶厚度不均和四周空气对流散热3种因素对96孔PCR仪温度均匀性的影响。其结论表明,通过匹配TEC、采取隔热或热补偿的措施,可以有效改善PCR仪96孔基座的温度均匀性。毛贺[12]运用数学插值方法对基座孔和试液的温度时变曲线进行六次多项式拟合,对试液温度延迟现象进行了数学描述,以预估某PCR仪反映试液的升/降温情况。然而,对PCR仪温度过冲现象的研究却鲜有报道。
本文针对PCR仪反应试液温度难以估计的问题,分析了某型号PCR仪热循环系统的结构及传热机理,构建了PCR仪单孔仿真模型,探究了在50 µL试液量下温度过冲特性对试液温度的影响规律。在此基础上,分析了在不同试液量下(10,20,25,50,100 µL)PCR反应试液温度的差异性,为PCR仪的设计及优化提供研究基础。
1 PCR仪热循环系统结构
典型的PCR仪热循环系统如图1所示。系统由6片基于帕尔贴效应的TEC串联连接,实现温度升降[13]。系统的温控对象为TEC上方的96(8×12)孔紫铜基座以及反应试液。基座上等距布有直径为5.5 mm的深孔,以供装有反应试液的试管嵌入其中。孔间挖有一定深度的凹槽单元,以减小基座的热容,提高温变响应速率。试管上端与恒温105 ℃的热盖相接触,避免了高温蒸发后的试液冷凝于试管顶部。TEC下端为散热器,上下两端接触面均涂有0.05 mm厚的导热硅脂。散热器下方安装有冷却风扇,以对散热器进行强制对流换热。
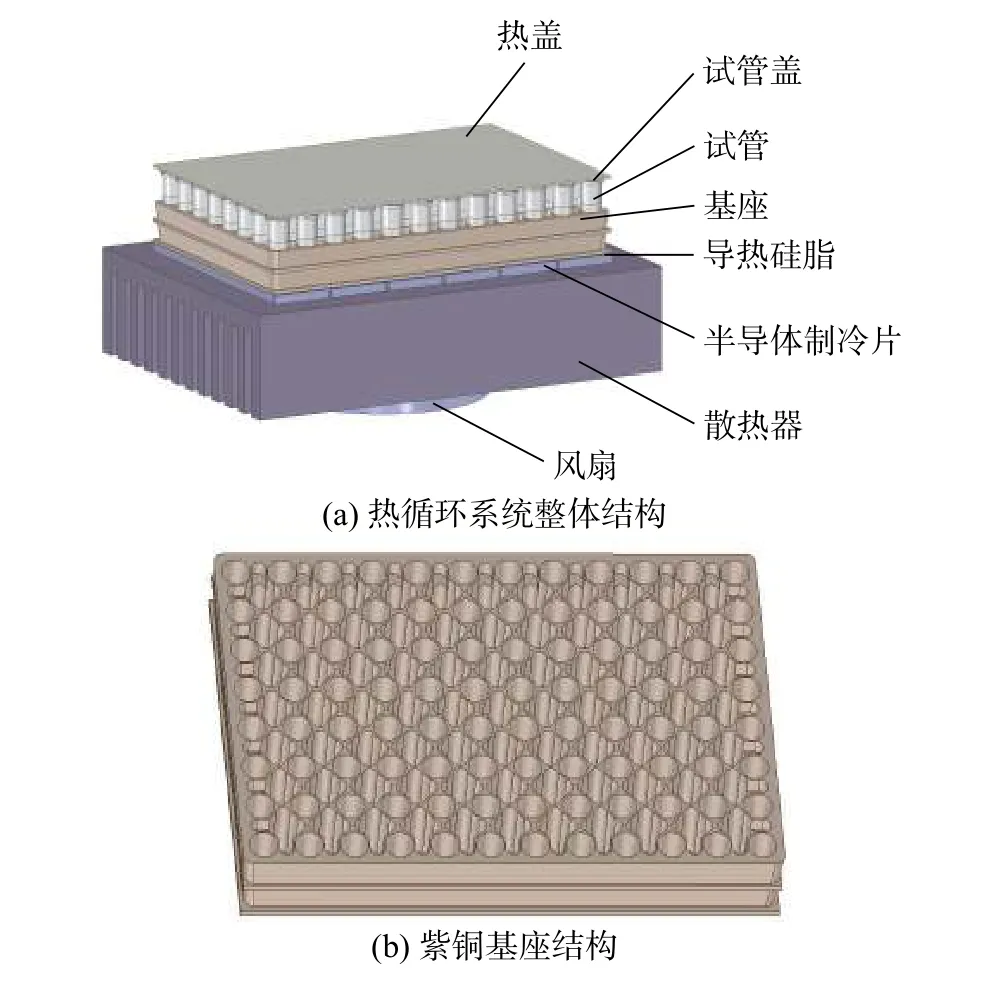
图1 PCR仪热循环系统结构示意图
2 PCR仪传热机理及数学模型
PCR仪热循环系统主要依靠热传导实现其功用。TEC上表面吸收或释放热量给导热硅脂薄层,之后热量传至金属基座,基座再将热量传递至试管,进而传递至反应试液。试管顶部的热盖在PCR反应过程中一直维持较高温度,但因试管导热系数很小,其对试液温度的影响可以忽略。此外,试管与基座之间存在狭小空气间隙,会对热传递起到阻碍作用,将其等效为接触热阻[14]。这些热传导过程均可用无内热源的非稳态导热微分方程进行描述[15]:

式中:λ——微元体导热系数,W/(m·K);
ρ——微元体密度,kg/m3;
c——微元体比热容,J/(kg·K)。
TEC在升/降温时释放/吸收的热量值可分别用下式描述[16]:
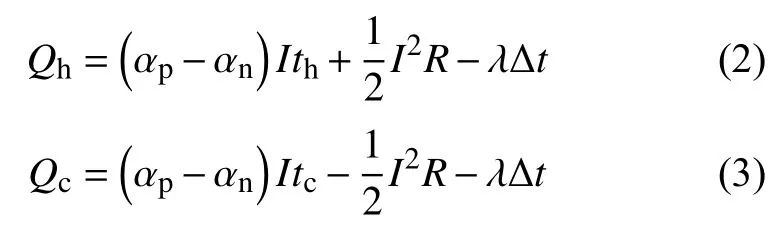
式中:Qh/Qc——升/降温时TEC释放/吸收的热量值,J;
th/tc− 升/降温时TEC与基座接触面的温度值,K;
αn/αp——TEC中N、P型半导体的塞贝克系数;
I——工作时通过TEC的电流值,A;
λ——TEC 导热系数,W/(m·K);
Δt——冷热面温差,K。
基座四周以及各试管间均存在较大的空气间隙,从而受到空气自然对流换热的影响。这一影响因素属于加载第三类边界条件的非稳态导热,可用下式进行描述:
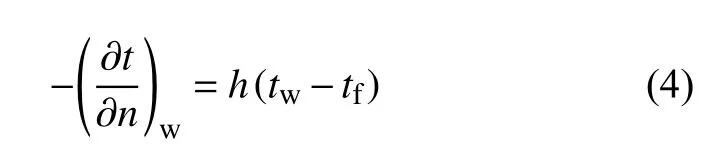
式中:h ——流体的对流换热系数,W/(m2·K);
tw——壁面温度,K;
tf——流体温度,K。
3 PCR仪仿真方法及试验验证
3.1 仿真模型的建立
PCR仪热循环模块几何模型复杂,适合采用有限元数值方法进行研究。虽然PCR仪基座各孔存在一定的温差,但由于其温差较小,各孔之间的热传导可以忽略。所以,为简化仿真难度并集中研究温度过冲特性的影响,本文假设基座各孔温度均匀,仅针对单孔的反应模型进行研究,如图2所示。其中,试管内反应试液为50 µL,其余几何结构与整体热循环系统结构保持一致。采用ANSYS-Meshing对几何模型和反应试液进行网格划分,全局网格尺寸设置为0.4 mm,空气及试液区域网格设置为0.8 mm,以减小总体网格数量。网格类型均为四面体网格。划分网格之后的节点数为33385,网格数为115642,反映网格质量的skewness值最大为0.709,平均为0.241,网格质量良好。网格划分结果如图3所示。

图2 PCR仪单孔三维模型及结构示意图

图3 单孔模型网格划分
本文采用Fluent软件完成相关数值计算。针对PCR仪瞬态传热问题,采用瞬态求解器,并激活能量方程。各区域材料对应的热物性参数如表1所示。单孔模型忽略了不同孔之间的温差以及基座四周空气对流换热对模型的影响,进而可以只考虑下边界TEC和上边界热盖,将其他边界设置为绝热壁面。 PCR单孔模型的上下表面分别与热盖、TEC直接接触。根据仪器特性,上表面温度边界设为105 ℃,并保持恒定,同时依照规范 JJF 1527—2015中PCR仪温度控制程序标准程序表的前3个步骤(表2)设计具有不同温度过冲量的温度控制曲线作为下表面的温度边界条件。此外,在基座与试管之间设置厚度为0.5 mm的空气层,模拟微小气隙。因反应试液的量少且受热较均匀,监测试液的平均温度作为试液的参考温度。设置模型初始温度为30 ℃,求解时间步长为 0.1 s,最大迭代步为 40。

表1 单孔模型各区域的热物性参数

表2 PCR仪温控程序标准程序表(部分)
3.2 数值方法准确性验证
为了验证PCR仪单孔三维仿真数值方法的准确性,进行PCR仪试液单孔测温实验。同时,构建PCR仪单孔传热一维模型,与三维仿真结果进行对比验证。
对于测温实验(图4),选择经校准后的日本S3热敏电阻作为测温传感器置于试管内,该传感器直径为 1.3 mm,测温范围为–30~150 ℃,测量精度为0.01 ℃,动态响应时间为321 ms。将热敏电阻连接温度记录器,并进行多点修正,经校准后试验装置最大误差为0.03 ℃,满足实验要求。

图4 PCR仪试液测温实验装置
采用AMESim软件构建PCR仪单孔传热一维仿真模型,如图5所示。一维模型对各部分物体的几何特征进行了简化。除此之外,包括热物性在内的其他参数设置和三维模型保持一致。
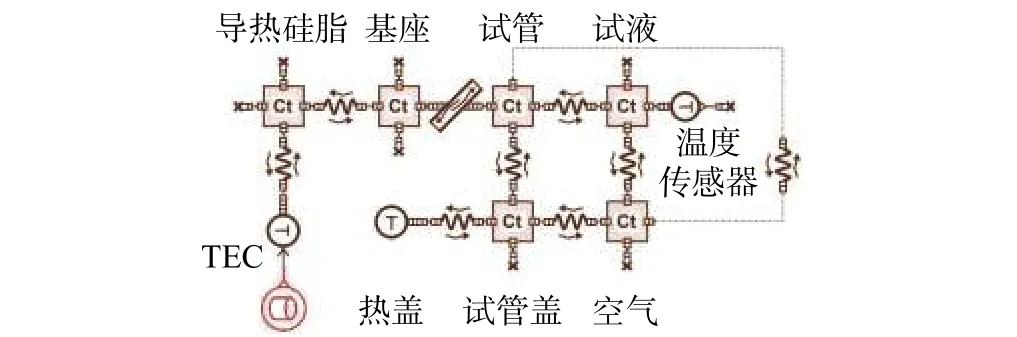
图5 PCR仪单孔传热一维模型
所测PCR仪设备的平均升温速率为2.22 ℃/s,平均降温速率为1.18 ℃/s,曲线的升/降温梯度程序为 30 ℃—95 ℃—30 ℃,升温平台期维持 180 s,与表 2保持一致。通过测温传感器测得试液温度的变化规律。同时,将设备的实际温控曲线作为温度边界条件加载至三维模型下表面与一维模型热源处,仿真求解获得试液温度。图6为实验与仿真得到的试液温度变化对比结果。
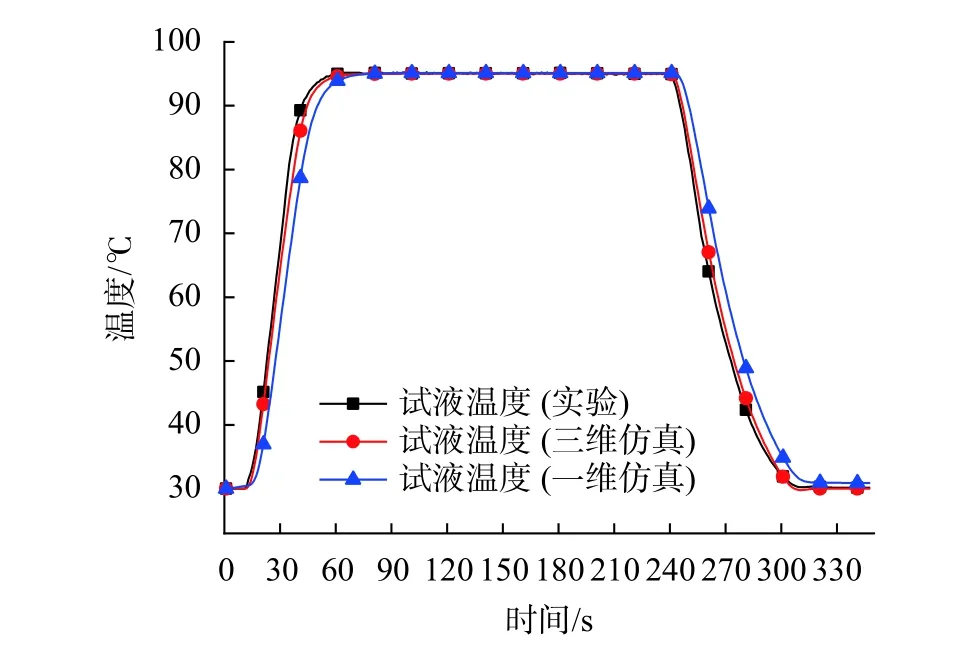
图6 试液温度变化对比曲线
由图可知,仿真的温度监测点位置与实验温度传感器放置位置保持相同的情况下,加载同一温控曲线时,三维仿真得到的试液温度较一维仿真更贴合于实验结果。一维仿真不能表征复杂的三维几何结构,是导致仿真误差增大的主要原因。由此证明三维仿真方法更可靠,且可以基于此三维模型进行温度过冲的进一步研究。
4 温度过冲量对试液温度影响分析
依据表2的程序以及设备的平均升/降温速率,设计不同升/降温过冲量的TEC温度控制曲线(图7)。其中,曲线T0至T5表示温度过冲量的范围从0 ℃依次增加到5 ℃,温度间隔为1 ℃。
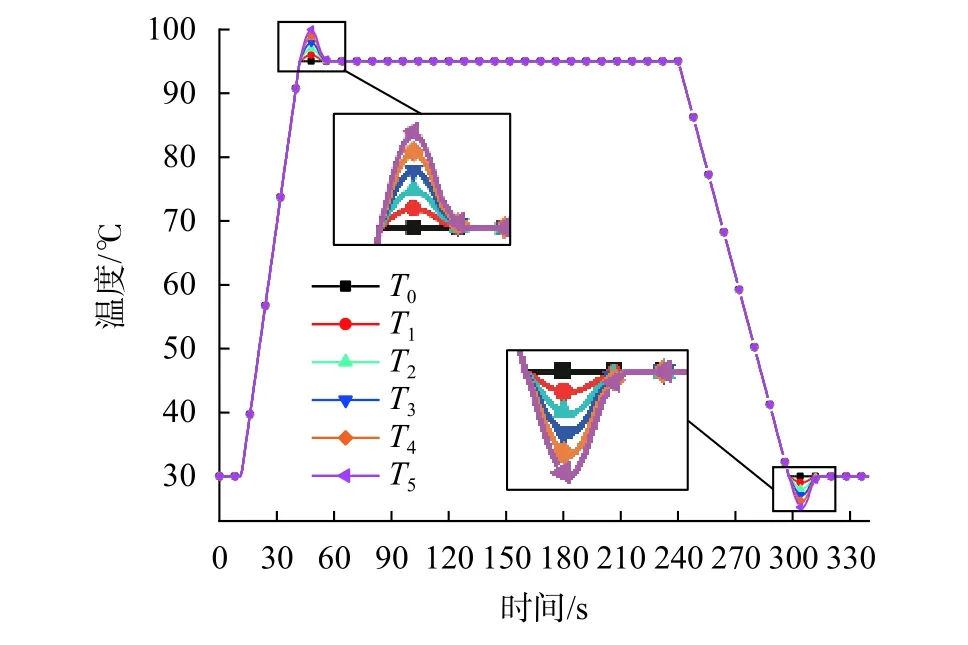
图7 不同温度过冲量的温度控制曲线
图8为T0~T5六种温度输入下试液平均温度经升/降温后首次到达平台期温度±0.5 ℃时所需时间趋势线。其中纵坐标时间从开始升温与降温时刻算起。由图可知,随着温度过冲量由0 ℃增加至5 ℃,试液的升/降温所需时间分别缩短了13.7 s与10.7 s。此外,在试液从没有过冲调整至过冲1 ℃时,试液升温时间缩短了 4.3 s,降温时间缩短了 4.6 s;若将过冲4 ℃调整至过冲5 ℃,试液升温时间缩短了1.4 s,降温时间则只缩短了0.5 s。由此说明增加温度过冲量与缩短试液升/降温时间之间的关系并不是线性的,试液升/降温时间的改善效果会随着温度过冲量的增大而不断减小。

图8 试液升/降温所需时间曲线
图9反映了试液升/降温过冲量随T0~T5六种温度输入的变化规律,其中纵坐标代表不同的温度过冲量。由图可知,对于50 µL 试液量,温控曲线升温过冲不大于3 ℃,降温过冲不大于1 ℃时,试液不会出现温度过冲现象。此时对试液来说只是增加了升/降温速率,是较为理想的情况。当温控曲线过冲量大于3 ℃时,试液升温与降温均会出现较小的温度过冲,这可能导致试液中聚合酶高温失活,严重影响基因扩增循环,是需要避免的。此外,试液降温时的温度过冲现象比升温时更显著,原因是TEC的制冷速率慢于制热速率。这会导致试液降温所需时间变长,从而受冷更充分,易产生温度过冲。
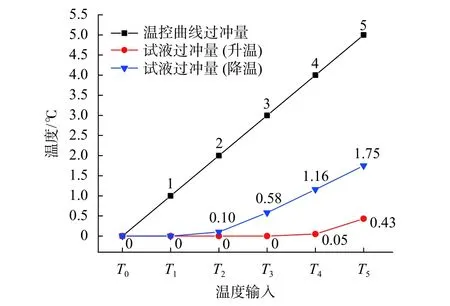
图9 不同温度输入对试液温度过冲量的影响
5 不同试液量的温度差异性分析
为了探究PCR试管内反应试液量对试液平均温度变化的影响,选取 10,20,25,50,100 µL 5种不同试液量,对仿真模型下表面分别加载图7中的T0温控曲线(无过冲)和T3温控曲线(最大过冲量为3 ℃),观察试液温度的变化情况。
图10为不同试液量下的试液升/降温时间曲线。由图可知,对于各试液量而言,温度过冲均会缩短其升/降温所需时间,进而延长试液的实际平台期,有利于扩增反应的充分进行。无论仪器是否存在温度过冲的情况,随着试液量的不断增加,试液升/降温所需时间均会不断增加。以无温度过冲情况为例,在10 µL 试液量下,试液升/降温分别需要 45 s和 68 s,而在 100 µL 下则分别需要 63.6 s和 84.5 s,与前者相差18.6 s和16.5 s。这说明在同一温控曲线下,试液量越多,试液实际平台期的持续时间就会越短,这可能会导致试液进行反应的实际时间不足。
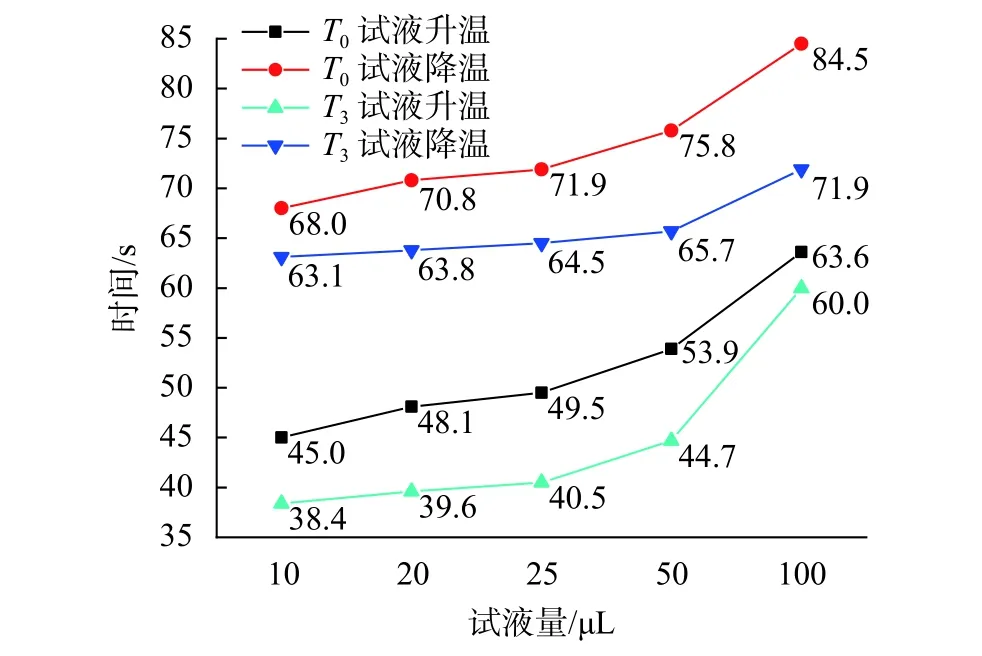
图10 不同试液量的试液升/降温时间曲线
图11为不同试液量的试液升/降温过冲量趋势线。由图可知,在加载相同温度过冲量的温控曲线时,不同试液量的试液会产生不同程度的温度过冲。以温度过冲量为 3 ℃ 的 T3曲线为例,10 µL 试液量在这一曲线下产生了1.09 ℃的升温过冲量和1.67 ℃的降温过冲量,而相同条件下100 µL 试液量的升温与降温均没有出现温度过冲现象。从实际应用角度出发,针对PCR仪一般具有的block温控(无温度过冲)和tube温控(存在温度过冲)两种温控模式,建议仪器在反应试液量低于50 µL时采用block温控模式,50 µL及以上时采用tube温控模式,且tube温控模式下的最大温度过冲量不应超过3 ℃。
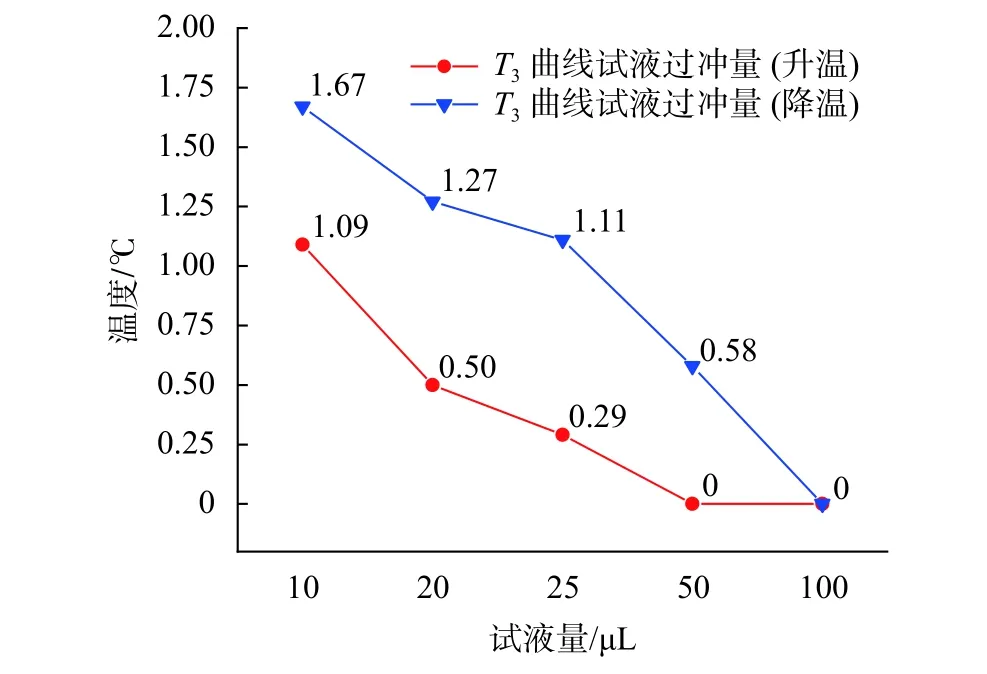
图11 不同试液量的试液温度过冲量曲线
6 结束语
本文分析了典型PCR仪热循环系统的结构及传热原理,构建了某型号PCR仪单孔三维传热模型,并通过试液测温实验与一维仿真对比验证了数值方法的准确性。对单孔模型的传热特性进行了仿真分析,研究了温度过冲现象对PCR反应试液温度的影响。在此基础上,讨论了在不同试液量下试液温度的差异性。相关结论如下:
1)增大PCR仪温控曲线的温度过冲量会缩短试液的升/降温时间,延长试液实际平台期,有利于反应的充分进行。
2)试液的温度过冲量存在上限(在50 µL试液量下为3 ℃),若高于上限将可能导致试液实际温度不理想,造成聚合酶失活等严重后果。
3)在同一温控曲线下,试液量越多,试液实际平台期的持续时间就会越短,且越不容易出现温度过冲现象。
4)PCR反应试液量低于50 µL时采用无过冲温控模式,50 µL及以上时采用过冲温控模式,将会取得更好的基因扩增效果,且过冲温控模式下的最大温度过冲量不应超过3 ℃。
