我国医疗器械标准研究文献分析
2014-05-02杨士友
周 冬,张 弦,杨士友
(安徽省食品药品审评认证中心,安徽 合肥 230051)
医疗器械标准是医疗器械生产企业设计、研制、开发和生产产品的基本依据,也是政府部门行使监管职权的法定依据。我国自20世纪80年代中期发布第一个医疗器械标准以来,历经改革开放30多年的发展,医疗器械标准数量急速增长。2012年1月,《医疗器械标准管理办法》(试行)(局令第31号)的发布,标志着医疗器械标准管理走向规范化。2009年,国家食品药品监督管理局标准管理中心(简称标管中心)的正式成立,表明医疗器械标准管理体系日臻完善[1-2]。据最新统计,截至2013年5月,现行有效医疗器械标准1064项,其中国家标准200项,行业标准864项[3]。随着医疗器械产业日新月异的发展,我国标准研究的水平稳步提升,部分业内学者已经开展了较深入的探索和实践。但我国标准研究由于起步晚,加上各级管理机构、技术支撑机构和企业主体重视程度不够,因此该领域发展空间巨大,发展前景好。笔者通过对2000年至2013年在中国期刊全文数据库(CNKI)上发表的有关医疗器械标准研究的文献进行检索、分类,并对其研究主题进行分析,旨在揭示我国医疗器械标准研究的现状及趋势。
1 文献来源与方法
数据来源于CNKI,检索条件为关键词“医疗器械”“标准”,检索年限为2000年1月至2013年12月,共检索到90篇文献,经文献评阅和筛选后,剔除报道性文献、重复文献和不相关文献,共得可用文献78篇。运用Excel2007办公软件,将所得文献按照研究主题进行初步分类,按照文献的年发文量、期刊分布、地区和作者分布、合著情况和机构分布对文献进行统计和分析,并对统计结果进行讨论。
2 结果
2.1 年发文量
发文数量在一定程度上反映了该研究领域的科研现状和发展态势,2002年至 2006年文献每年只有 1~3篇;2009年至2013年有关医疗器械标准研究领域的文献共59篇,占75.64%,其中2012年文献数量最多,高达20篇。可见,该领域近5年来日益受到业内专家学者的关注,取得了一定的研究成果,但年发文量整体波动很大,详见图1。

图1 医疗器械标准研究文献年代分布
2.2 期刊分布
检索到的78篇文献源自23种期刊,刊登文献不低于2篇的期刊有8种。8种期刊的刊文量占总文献量的80.77%,期刊分布较为集中。其中刊登文献最多的期刊依次为《中国医疗器械信息》《中国医疗器械杂志》《中国药事》,共刊登文献51篇,占总文献量的65.38%。除《中国药事》外,其他2种均为医疗器械专业期刊,详见表1。

表1 医疗器械标准研究文献期刊分布
2.3 地区和作者分布
以发文第一作者所在地为标准进行分析,北京是发文数量最多的省份,共41篇,位居全国首位,见表2。第一作者中发文量不低于2篇有11位,主要研究团队来自国家食品药品监督管理局医疗器械标准管理中心和中国食品药品检定研究院2家机构(前者隶属于后者的下设机构),2家机构的5位作者共发表文献15篇,占总文献量的19.23%。可见,该研究领域的作者分布相对集中,作者分布和地区分布的趋势相吻合。从发文数量的排名看,作者母瑞红共发表文章5篇,并取得较为系统的标准体系研究成果,拥有一定的影响力,见表3。母瑞红等[4-8]通过对我国医疗器械标准体系建设框架、标准化工作现状、产业发展趋势和标准化技术组织现况等问题进行研究和分析,阐明了当前应加快我国医疗器械标准制修订工作,加强标准的基础理论研究力度,推进医疗器械注册产品标准化管理和信息化建设,推动标准化技术组织管理及队伍建设,以更好地服务于医疗器械的科学监管,促进产业健康发展。

表2 医疗器械标准研究文献地区分布

表3 刊登不低于2篇医疗器械标准研究文献的主要作者分布
2.4 合著情况
论文的合著情况体现研究论文的深度和广度。合著度是指某一确定时期内期刊每篇论文的平均作者数,合著率则为某一确定时期内期刊合著论文篇数占论文总数的比例,两者在一定程度上可反映该领域的科研协作趋势。统计发现,78篇论文的作者数为184人,合著度为 2.36,其中独著论文 33篇,占总论文数的42.31%,2位及其以上作者合著的论文有 45篇,合著率为57.69%,详见表4。可见,由于医疗器械涉及多学科的交叉融合,所以该领域总体合著度较高,研究能力和团队合作能力较强。

表4 医疗器械标准研究文献论文合著率情况
2.5 机构分布
按照第一作者统计,从机构类型来看,公开发表医疗器械标准研究文献最多的是检验检测机构,14个国家级、省级和市级医疗器械检验检测机构共发表该领域文章36篇,占总文献量的46.15%,是我国医疗器械标准研究领域的主力军。技术审评机构和标准管理机构作为该领域的学术生力军,共发表文献19篇,占总文献量的24.36%。企业作为标准研究工作的重要主体,研究文献太少,仅占5.13%,详见表 5。

表5 医疗器械标准研究文献来源机构分布
2.6 研究主题分布
对某领域文献的研究主题进行分类,可以了解该领域工作的现状、特点,同时可判断和预测未来的发展趋势和方向。按研究主题分析78篇文献,结果显示,医疗器械标准研究大体归为应用研究、对策建议和理论研究3类主题。文献中共有31篇是有关应用研究的,占总文献量的39.74%,排第1位,详见表6。
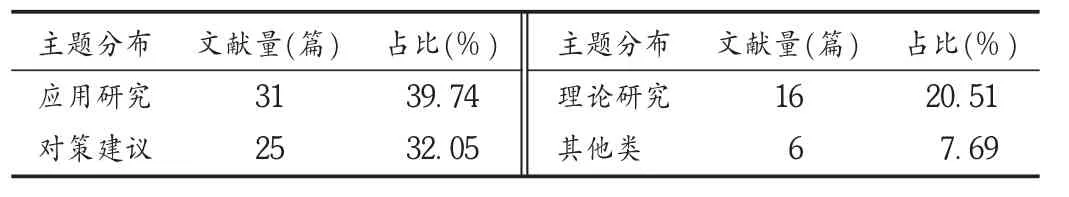
表6 医疗器械标准研究文献研究主题分布
应用研究:标准应用研究主要包括医疗器械国家标准、行业标准和注册产品标准的编制规范、标准编制问题的探讨、各类标准之间的对比分析、标准审查过程中的关键点和标准检验项目的试验验证和方法学研究。近年来,该研究领域发展迅速,2012年至今,已有17篇文献发表,如《医疗器械电磁兼容标准中对随机文件的编写要求》《医用分子筛制氧设备的标准及应用现状》《医疗器械行业标准编制中需注意的若干问题》和《甲胎蛋白定量标记免疫分析试剂盒行业标准的实验验证》等。
对策建议:标准研究中,关于对策建议的文献共25篇,占总文献量的32.05%。这类文献主要是针对我国医疗器械标准化体系、标准化技术组织体系、注册产品标准起草、复核与预评价现状分析及医疗器械监管过程中有关法规对标准的要求,提出了相关的对策和建议,以此加强标准化组织建设和管理,提升医疗器械产品标准制订和修订质量,确保医疗器械产品安全、有效和质量可控,如《对我国医疗器械标准化技术组织体系建设的几点思考》《我国医疗器械标准化现状及发展策略研究》和《我国医疗器械注册产品标准复核与预评价》等。
理论研究:理论研究的价值通常以能否切实服务于应用研究为衡量标准,理论研究属于基础研究范畴,基础研究的程度决定了应用研究的前景。目前,我国医疗器械标准理论研究主要围绕标准管理体系、标准档案和信息化管理、标准技术管理机构建设以及法规和标准的相互关系等理论问题进行探讨和思考。自2000年至今,该研究领域共检索到文献16篇,但2012年以来,仅有4篇文献发表,发文数量落后于应用研究类文献,可见,理论研究与应用研究的发展不相适应,说明各级管理机构、技术支撑机构及科研机构等对标准理论挖掘的深度不够,对标准理论研究的投入力度不够,同时也表明该研究领域人才稀缺,客观上阻碍了应用研究的发展。
3 讨论
3.1 医疗器械标准研究进入发展快车道
目前,我国医疗器械标准研究进入快速发展期,近年来年发文量迅速增多,尤其是2012年以后,发文量大幅增长。论文合著度较高,但还未达到相对成熟的阶段;作者分布相对集中,但总体较分散;期刊分布主要集中于医疗器械专业杂志;从趋势来看,医疗器械产品种类繁多,而产品标准作为医疗器械生产企业生存发展的核心竞争力,自主创新的国家标准研究、国内领先的行业标准研究、实际应用研究、基础理论研究的发展空间均较巨大,发展领域广阔。
3.2 医疗器械标准研究主题多样但深度不够
近14年来,我国医疗器械标准研究重点关注应用研究、对策建议和理论研究领域,其中有关应用研究、对策建议的文献较多,而系统性的理论研究较少见。总体上,标准研究主题多样,但思考深度不够。近年来,虽然有部分学者在标准体系研究等领域取得了一些成果,但由于研究团队的固定和单一,造成该领域研究思路缺乏多样性,因此需要更多的技术支撑机构、科研院所和企业参与其中,不断丰富研究思路,开辟研究新高地。此外,医疗器械主要涵盖有源产品、无源产品和体外诊断试剂三大类,但从文献分析看,围绕这三大类产品标准的专题研究较少,研究的系统性和连续性不强,研究内容也仅局限于国际标准的转化、国家标准关键项目的研究和标准编制要求等内容,特别是有源产品国家标准和行业标准研究始终滞后于国际步伐[9-11]。
3.3 医疗器械标准研究机构广泛但不均衡
国家级检验检测机构是从事标准研究的核心力量。目前,全国现有22个医疗器械标准化技术委员会,其中21个标技委的秘书处分别挂靠在9个国家级医疗器械检测中心,主要负责医疗器械标准制订和修订工作。随着我国深化行政审批体制改革工作的推进,各省(市)级技术审评机构成为了标准研究的新兴力量,技术审评机构依据法律法规,对拟上市销售、使用的医疗器械安全性和有效性进行评价,提出是否准予注册的建议。国家总局医疗器械标准管理中心作为统筹协调标准管理、制/修订和研究的权威机构,承担着医疗器械标准管理的法定职能。三类机构构成了现阶段我国医疗器械标准研究的中坚力量,这充分表明我国标准研究机构的广泛性和集中性。由文献分析可见,企业的参与度太低,而企业作为产品标准制订的重要主体,应当加大标准研究力度,提升产品标准的科技含量,保障产品的安全性和有效性。科研机构作为核心技术的创新来源,仅有少量文献发表,表明对标准研究的投入和关注不够,今后有待加强与企业的产学研合作联动,加速科研成果转化,促进我国医疗器械产业升级。
3.4 医疗器械标准研究任重道远
通过对2000年至2013年医疗器械标准研究的文献进行分析,初步探讨了我国医疗器械标准研究的发展现状、内容及趋势。可见,在各级机构的共同努力下,标准研究不断深入,众多专家学者不但发表了大量应用研究的文章,详细阐述了标准编制、审查要求等实际操作问题,而且还提出了许多诸如对我国医疗器械标准化建设以及注册产品标准起草、复核等进行现状分析的对策建议,这些都为拓展标准研究领域提供了参考。但与迅猛发展的医疗器械产业相比,我国标准研究的整体水平,尤其是基础理论研究仍有待进一步拓展和突破。其中为临床上使用量大、应用面广、技术成熟、性能稳定的产品制订国家标准或行业标准,规范全国各地区医疗器械注册产品标准的管理工作将是未来研究的重要方向。此外,从《医疗器械监督管理条例》及相关规章的修订、明确医疗器械注册产品标准的法律地位及强制性行业标准(如YY0505-2012)升级引发的大规模有源产品的技术革新和改造也是需要面对和亟待解决的难点问题。
参考文献:
[1]田小俊,徐红蕾,彭晓龙.我国医疗器械标准化现状和发展策略研究[J].中国医疗器械杂志,2013,37(4):285-286.
[2]董 放.对医疗器械标准技术委员会的几点思考[J].中国药物警戒,2010,17(4):211-213.
[3]储云高,朱颖锋,钱 红,等.对我国医疗器械标准体系建设的几点建议[J].上海食品药品监管情报研究,2012,8(4):21-26.
[4]母瑞红,肖忆梅.我国医疗器械行业标准体系建设工作初探[J].中国医疗器械信息,2011,17(6):27-28.
[5]母瑞红,杨昭鹏.对我国医疗器械标准化技术组织体系建设的几点思考[J].中国药事,2012,26(11):1174-1176.
[6]母瑞红,李静莉.探索建立促进产业发展的医疗器械标准化工作新模式[J].中国医疗器械信息,2013,19(9):25-27.
[7]母瑞红,李海宁,白东亭.医疗器械国家监督检验工作引发的思考[J].中国药事,2010,24(10):939-940.
[8]母瑞红,肖忆梅.我国医疗器械标准现状分析与建议[J].中国药事,2011,25(7):657-658.
[9]付海洋,邵安良,方 玉,等.纳米材料体外细胞毒性试验标准的关键项目研究[J].药物分析杂志,2013,33(7):1096-1103.
[10]缪 佳.医疗器械电磁兼容标准中对随机文件的编写要求[J].中国医疗器械信息,2013,19(5):38-40.
[11]Daniel A,Schultz,刘 斐.ASTM医疗材料和器械的应用技术与标准[J].药物分析杂志,2010,30(7):1364-1369.
