气相色谱法测定脂肪酶催化反应体系中的己酸乙酯
2014-04-24罗少华
罗少华,熊 泽,邵 伟,郭 军
(三峡大学化学与生命科学学院,湖北宜昌 443001)
己酸乙酯作为浓香型白酒的主体风味物质,是衡量白酒质量的重要指标之一[1],市场需求量很大。目前主要利用酸催化法[2]制备;但化学法制备的产品质量不高,同时酸催化还会产生大量废液,造成环境污染。相比之下,脂肪酶催化合成己酸乙酯反应条件温和、转化率高、产品风味柔和、香醇自然,具有重要的研究意义和应用价值[3-5]。
在研究有机介质中脂肪酶催化己酸和乙醇合成己酸乙酯的转化率[6-8]时,多采用中和滴定法。在对比研究各种因素对转化率的影响时,滴定法操作简便,尽管使用浓度极低的标准氢氧化钠滴定,但是由于己酸为弱酸,分析样品中己酸含量很少且相差不明显,导致滴定分析数据稳定性不好。张艳等[9-10]用气相色谱法测定了己酸乙酯的含量,本研究以实验室现有仪器为基础,以乙酸正戊酯为内标物,参考文献[11-14]的气相色谱条件,拟建立快速、准确、灵敏的测定脂肪酶催化反应体系中己酸乙酯含量的方法。
1 材料与方法
1.1 材料与试剂
正己烷(分析纯)、乙酸正戊酯(色谱纯):国药集团化学试剂有限公司;无水乙醇(分析纯)、己酸乙酯标准品(色谱纯):天津市科密欧化学试剂有限公司;正己酸(分析纯):济南兴隆化工有限公司;脂肪酶(Novozym 435):丹麦诺维信生物技术有限公司。
1.2 仪器与设备
GC-7890F气相色谱仪:上海天美科学仪器有限公司;SGD-300氮、氢、空发生器:北京东方精华苑科技有限公司;BSA224S-CW电子天平:北京赛多利斯仪器系统有限公司;DKZ-2电热恒温振荡水槽:上海一恒科技有限公司。
1.3 方法
1.3.1 气相色谱条件
色谱条件:色谱柱(AT.PEG-20M 30m×0.25mm×0.33μm):中国科学院兰州化学物理研究所,T2000P色谱工作站。程序升温:起始柱温55℃,恒温1min,以10℃/min升温至70℃,恒温2min,再以20℃/min升温至180℃,保持5min;进样口温度200℃;采用氢焰离子化检测器(flame ionization detector,FID)、温度220℃进行测定;分流比:不分流;进样量:1μL。
1.3.2 样品溶液制备
在50mL碘量瓶中加入20mL正己烷和一定量的己酸和乙醇,混合均匀,再加入适量的脂肪酶Novozym435,在45℃恒温水浴中振荡反应10h;静置,上清液为样品溶液。
1.3.3 溶液的配制
量取0.2mL乙酸正戊酯,置于10mL容量瓶中,用正己烷稀释至刻度,摇匀,配制成体积分数为2%的内标溶液。
量取0.2mL己酸乙酯,置于10mL容量瓶中,加正己烷稀释至刻度,摇匀,配制成体积分数为2%的标准对照品溶液。
量取标准对照品溶液5.00mL和内标溶液3.00mL,置于10mL容量瓶中,正己烷稀释至刻度,摇匀,作为混合标准储备液。
1.3.4 色谱分离鉴定
分别取不含己酸乙酯和内标物的阴性对照溶液(正己烷溶剂)、内标溶液、标准对照品溶液和混合标准储备液、样品溶液及加标样品溶液,在1.3.1的色谱条件下,1μL进样,以便进行色谱鉴别。
1.3.5 校正因子f的测定
取含标准品和内标物的标准储备液,在1.3.1的色谱条件下,1μL进样,测定己酸乙酯和乙酸正戊酯峰面积积分值,并计算积分值的比值和相对校正因子f;连续6次进样,考察相对标准偏差(relative standard deviation,RSD)值。
1.3.6 最低检测限的测定
量取1.30mL、1.40mL、1.50mL、1.60mL、1.70mL、1.80mL标准对照品溶液,置于6个10mL的容量瓶中,在6个容量瓶中精密加入内标溶液各3.00mL,加正己烷稀释至刻度,摇匀。在1.3.1的色谱条件下分别进样1μL,观察各质量浓度标准品岀峰情况,检测最小响应值,确定最低检测限。
1.3.7 样品中己酸乙酯含量的测定和精密度评价
量取试样1.00mL,移入2%的内标溶液3.00mL,加入正己烷稀释至10mL。混匀后,按校正因子测定相同的条件操作,根据保留时间确定己酸乙酯峰的位置,根据己酸乙酯峰面积与内标峰面积比,按内标法计算出样品中己酸乙酯的含量。连续取样6次,取平均值,考察RSD值。
1.3.8 加标回收率实验
量取1.00mL样品溶液3份,置于3个10mL容量瓶中;按己酸乙酯最低检测限含量的1.0、1.1、1.2倍量,量取己酸乙酯标准对照品溶液,分别转移到容量瓶中;再加入内标溶液各3.00mL,用正己烷定容、摇匀。在1.3.1的色谱条件下取1μL进样,测定并记录己酸乙酯和内标峰面积,按内标法计算出样品中己酸乙酯的含量和平均回收率。
2 结果与讨论
2.1 色谱分离鉴定
色谱分离实验结果见图1~图6。
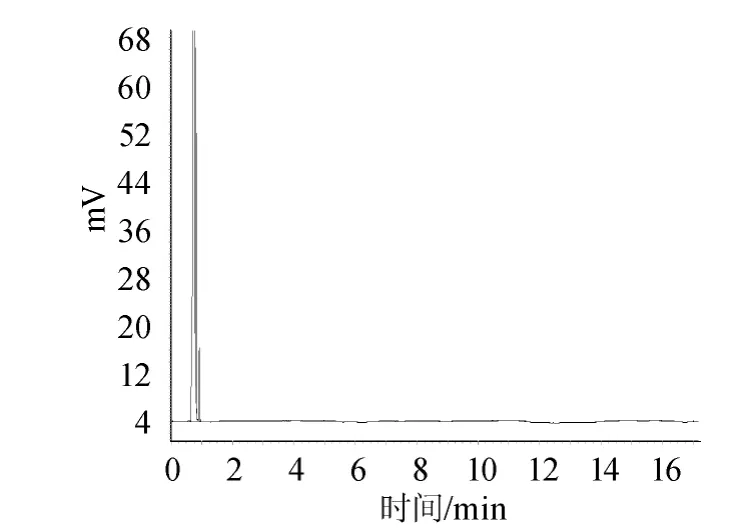
图1 阴性对照溶液的气相色谱图Fig.1 Gas chromatogram of negative control solution
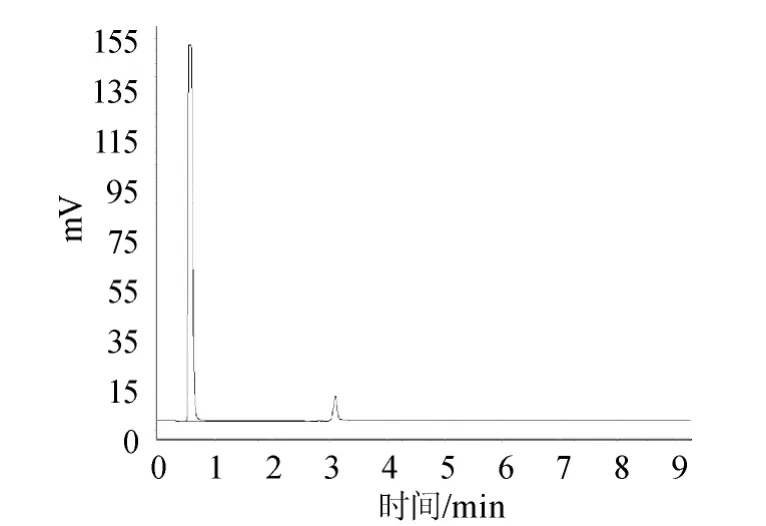
图2 内标物溶液的气相色谱图Fig.2 Gas chromatogram of internal standard solution
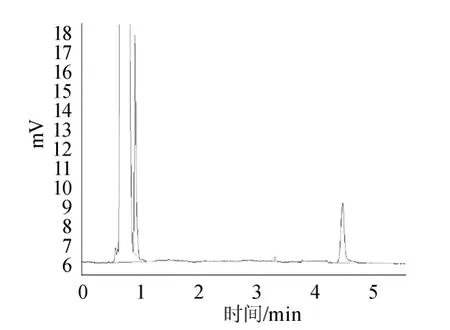
图3 标准对照品的气相色谱图Fig.3 Gas chromatogram of standard reference material

图4 标准储备液的气相色谱图Fig.4 Gas chromatogram of standard stock solution
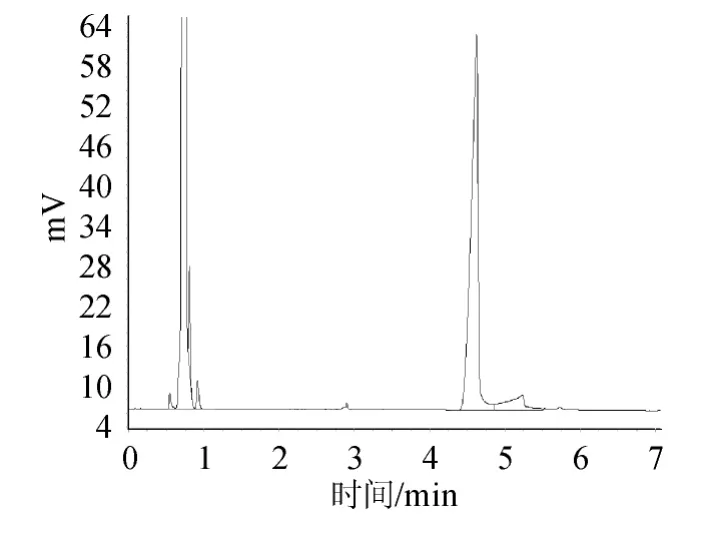
图5 样品溶液的气相色谱图Fig.5 Gas chromatogram of sample solution
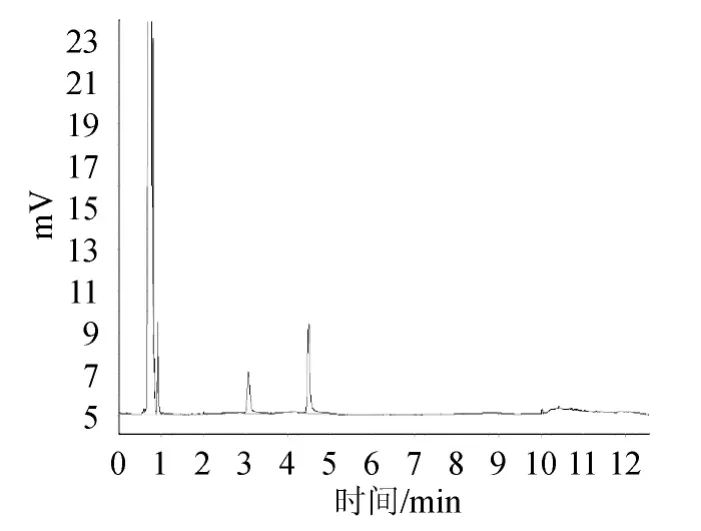
图6 加入内标物的样品溶液的气相色谱图Fig.6 Gas chromatogram of sample with internal standard substance
图1显示溶剂正己烷的流出峰,说明阴性对照溶液无干扰;图2显示内标物乙酸正戊酯的相对保留时间为3.056min;图3显示标准品己酸乙酯的相对保留时间为4.482min;图4显示混合标准储备液极好重现了乙酸正戊酯和己酸乙酯的相对保留时间分别为3.058min和4.486min;且乙酸正戊酯、己酸乙酯之间分离度大于2;图5为样品溶液的色谱图;图6是加入内标物的样品溶液的色谱图,图5、图6对比显示样品中含有待测定的己酸乙酯,不存在内标物,说明本研究选择的内标物合适。
2.2 校正因子f的测定
校正因子f的测定结果,见表1。
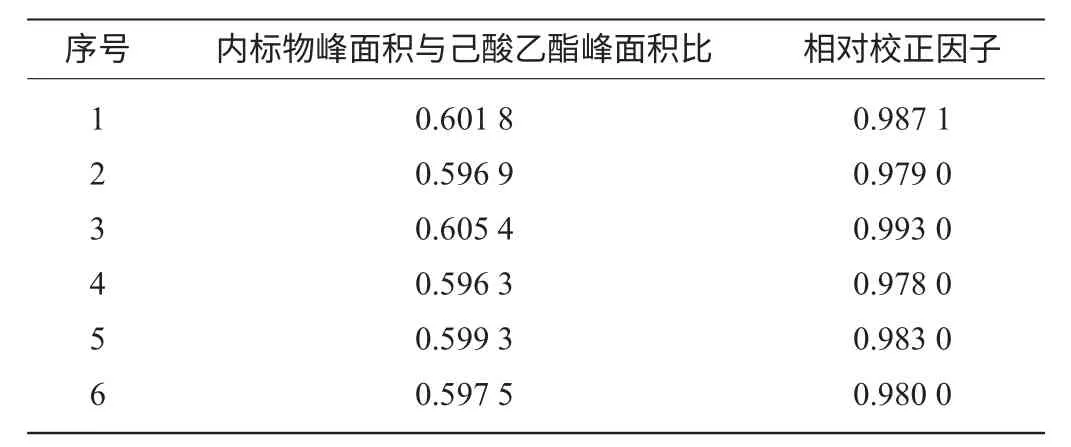
表1 校正因子实验测定结果(n=6)Table 1 Results of calibration factor test
计算相对校正因子的平均值为0.983 7,测定相对校正因子的相对标准偏差RSD=0.59%。相对校正因子是己酸乙酯与内标物乙酸正戊酯的质量相等时,内标物的峰面积是己酸乙酯组分峰面积的倍数,由于己酸乙酯与内标物是同系物,理化性质相近,与实验测定的校正因子值0.983 7相符。相对校正因子f值只与被测物和标准物以及检测器的类型有关,而与操作条件无关,实验中相对校正因子测定的相对标准偏差RSD=0.59%,说明实验中相对校正因子f值的测定稳定性好。
2.3 最低检测限的测定
最低检测限的测定结果见表2。
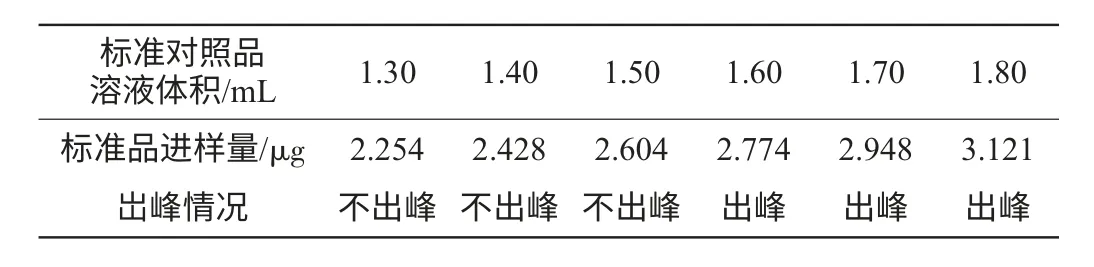
表2 最低检测限测定结果Table 2 Result of the lowest detectable limit determination
表2实验结果表明,色谱峰最低响应对应的标准品进样量为2.774μg/mL,因此,本法分析己酸乙酯的最低检测限接近2.774μg/mL。
2.4 样品中己酸乙酯含量的测定和精密度实验
样品中己酸乙酯含量测定及精密度实验结果见表3。
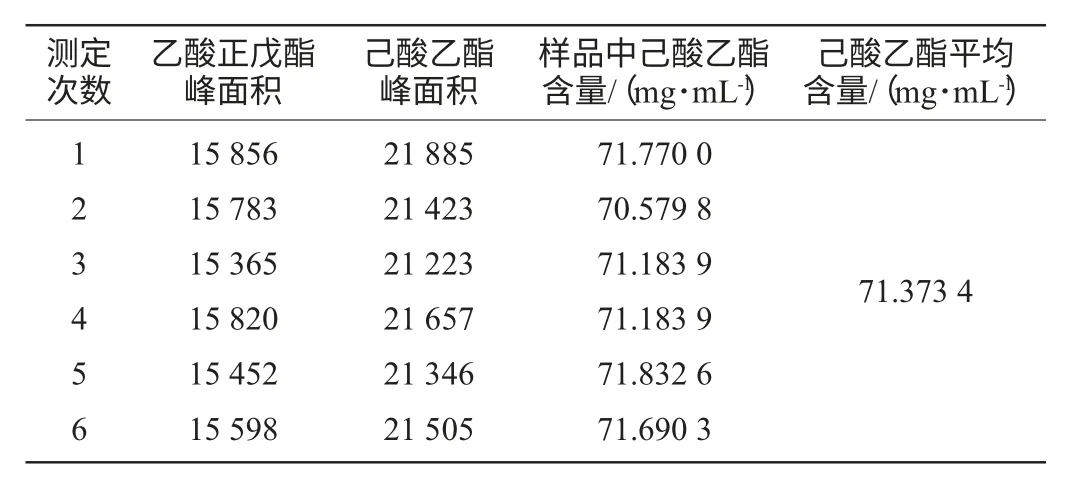
表3 样品己酸乙酯含量的测定Table 3 Determination of ethyl hexanoate in sample
根据样品测定的己酸乙酯峰与乙酸正戊酯的峰面积、添加内标物的质量浓度和己酸乙酯的相对校正因子,参考国家标准[15],计算样品中己酸乙酯含量。分析样品中己酸乙酯平均含量为71.373 4mg/mL,精密度RSD=0.97%。重复6次取样分析,样品中己酸乙酯含量的RSD=0.97%,说明分析操作的精密度好,稳定性高。
2.5 加标回收率实验结果与分析
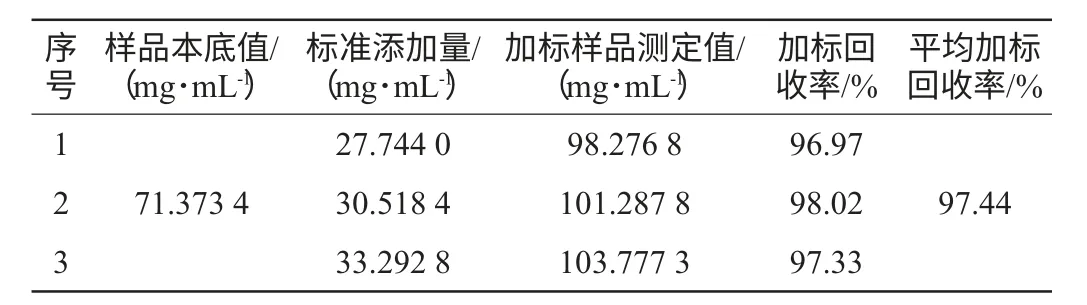
表4 己酸乙酯加标回收率Table 4 Standard addition recovery of ethyl hexanoate
按己酸乙酯最低检测限含量的1.0、1.1、1.2倍量添加标准己酸乙酯对照品,样品加标回收率见表4。平均加标回收率为97.44%,说明本法测定脂肪酶催化反应体系中己酸乙酯含量准确可行。
3 结论
在正己烷等有机溶剂中,固定化脂肪酶催化己酸和乙醇合成己酸乙酯转化率高,是一种适合工业化生产的途径。研究催化反应体系有机溶剂的选择、固定化酶的用量、底物己酸和乙醇的浓度和组成、反应温度及时间等因素对酯化过程的影响,优化己酸乙酯的合成工艺,需要快速、准确、灵敏地测定己酸乙酯含量。建立的毛细管气相色谱法测定脂肪酶催化反应体系中己酸乙酯含量,操作简便快速、省时、重现性好、结果准确,己酸乙酯的最低检测限为2.774μg/mL,相对标准偏差(RSD)为0.97%,平均加标回收率为97.44%。毛细管气相色谱法测定脂肪酶催化反应体系中己酸乙酯含量可更有效地研究酶法合成己酸乙酯相关课题,也可在该法的工业化生产中,为己酸乙酯半成品和成品质量分析提供借鉴。
[1]崔 利.酱香白酒现状与前景浅析[J].酿酒,1996(5):9-10.
[2]李继忠.对甲苯磺酸催化合成己酸乙酯的研究[J].化学工程师,2004,102(3):4-5.
[3]魏林娟,许志国,刘蓉蓉,等.非水相酶促合成己酸乙酯的研究[J].中国酿造,2001,20(6):20-22.
[4]RODRIGUEZ-NOGALES J R,ROURA E,CONTRERAS E.Biosynthesis of ethyl butyrate using immobilized lipase:A statistical approach[J].Process Biochem,2005,40(1):63-68.
[5]杨本宏,吴 克,郑 敏,等.非水溶剂中Rhizopus arrhizus 脂肪酶催化合成三种酯的最佳条件[J].中国生物化学与分子生物学报,2003,19(5):572-575.
[6]曾家豫,周兴辉,张 继,等.有机介质中酶催化合成己酸乙酯的研究[J].食品科学,2009,3(6):123-127.
[7]陈建平,葛清秀,黄祖新.碱性脂肪酶在正庚烷中催化合成己酸乙酯的研究[J].福建师范大学学:自然科学版,2005,21(4):117-120.
[8]ANDRÉIA A,ARAGÃO V C,BARBARA D A,et al.Enzymatic synthesis optimization of isoamyl butyrate[J].J Brazil Chem Soc,2011,22(11):2148-2156.
[9]张 艳,何丽明,蒋 群,等.在有机溶剂中猪胰脂肪酶催化合成己酸乙酯的研究[J].精细化工,2010,27(2):150-154.
[10]沈咏梅,谢晓娜,荀二娜.超声辅助酶促己酸乙酯的合成[J].合成化学,2012,20(5):612-615.
[11]霍权恭.毛细管气相色谱分析白酒中醇类与酯类[J].食品科学,2012,33(18):243-245.
[12]熊 泽,邵 伟,胡 滨,等.鄂西地区几种畅销白酒中乙酸乙酯含量的测定[J].中国酿造,2012,31(6):172-175.
[13]王会锋,李 瑾,林秋萍.气相色谱法快速检测白酒中醇和酯[J].食品科学,2007,28(7):456-458.
[14]何开蓉,程铁辕,张 莹,等.关于浓香型白酒己酸乙酯检测能力验证活动的分析[J].中国食品卫生杂志,2011,23(6):520-523.
[15]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 10345—2007 白酒分析方法[S].北京:中国标准出版社,2007.
