几种红葡萄酿酒过程中花色苷组成与CIELab参数的相关分析
2014-04-24梁娜娜王珮玥王金花
梁娜娜,韩 深,何 非,刘 萤,王珮玥,王金花*
(1.北京出入境检验检疫局检验检疫技术中心,北京 100026;2.中国农业大学食品科学与营养工程学院,北京 100083)
葡萄酒的颜色是评价品质的重要指标。葡萄果实中的花色苷是红葡萄酒的重要颜色来源,经葡萄破碎、压榨、发酵等酿造工艺进入葡萄酒中,成为影响葡萄酒颜色品质的重要因素。在欧亚种葡萄及葡萄酒中,花色苷主要包括5种花色素(anthocyanidin)形成的糖苷及其衍生物:花翠素(delphinidin)、花青素(cyanidin)、甲基花翠素(petunidin)、甲基花青素(peonidin)和二甲花翠素(malvidin)。糖分子通常仅与花色素的C3位相连形成花色苷,增加其稳定性和水溶性,这些糖苷会与乙酸、香豆酸和咖啡酸等进一步形成酰化修饰;随着葡萄酒的陈酿,这些单体花色苷又会进一步与乙醛、苯乙烯、丙酮酸等结合形成聚合花色苷,对红葡萄酒颜色的稳定和保持有重要作用[1]。因而,红葡萄酒中的花色苷可以概括分为2种类型:单体花色苷(非酰化花色苷和酰化花色苷)和聚合花色苷。单体花色苷中,羟基化及羟甲基化程度的不同以及糖苷结合位置和酰基化的差异,造就了葡萄果实和葡萄酒中花色苷存在的多样性,也直接影响了葡萄酒的色度、色调及化学稳定性[2]。一般而言,随着花色苷B环羟基化程度的增加,花色苷最大吸收波长增加(红移),而随着甲氧基化程度的增加,则会发生蓝移现象[3-4]。在红葡萄酒陈酿过程中单体花色苷大量消失,聚合花色苷不断形成,使红葡萄酒的颜色发生进一步的转变[5-6]。
红葡萄酒酿造过程中,葡萄果实中的花色苷经过浸渍和发酵等工艺逐渐进入葡萄酒中,并发生一定的变化,其色度色调均会发生明显的变化。在浸渍及发酵初期,果皮中的部分单体花色苷转移进入葡萄酒中,颜色鲜艳呈紫红色;发酵及陈酿过程中一些单体花色苷逐渐参与聚合花色苷的形成,使红葡萄酒的颜色逐渐变为砖红色[7]。花色苷的含量及组成在葡萄酿造及陈酿过程中的变化极其复杂,对葡萄酒的颜色有着显著的影响。按照国际葡萄与葡萄酒组织(international vine and wine organization,OIV)推荐,采用国际照明协会(commission international de I′eclairage,CIE)制定的L*,a*,b*来测量色值,这种测量方法称为CIELab法,通过视觉感知的3个特定品质属性色调(tonality)、亮度(luminosity)和色差(chromatism)来客观评价葡萄酒的颜色及其变化。尽管此方法并没有给出颜色的准确定义,但将其用于酿造过程中葡萄酒颜色变化的追踪却是非常有效的[8]。CIELab三维空间坐标包括亮度(L*)、红/绿颜色参数(a*)和黄/蓝颜色参数(b*)。其中:L*代表亮度(L*=0黑色和L*=100无色),与葡萄酒的颜色深浅相关;a*代表红/绿颜色分量(a*>0与红色相关,a*<0与绿色相关);b*代表蓝/黄颜色分量(b*>0与黄色相关,b*<0与蓝色相关),a*、b*值与颜色的强度高低及颜色饱和度相关。
近年来的大量研究主要集中在葡萄酒花色苷成分的检测,忽略了颜色感官指标分析这样一种更为直观简便的分析方法,对葡萄酒颜色与化学成分相关性的系统研究则更少。本研究采用高效液相色谱-质谱联用技术分析‘美乐’、‘西拉’和‘马瑟兰’3个酿酒葡萄品种及其品系的葡萄酒酿造过程中花色苷的组成及含量的变化,对应分析CIELab颜色参数,寻找二者之间的相关性,这将为酿酒葡萄品种及品系的选择及葡萄酒酿造工艺的设计提供一定的依据。
1 材料与方法
1.1 材料与试剂
实验材料为‘美乐’(V.viniferaL.cv.Merlot)3个品系343、346和181,‘西拉’(V.viniferaL.cv.Shriaz)2个品系100和525,马瑟兰(V.viniferaL.cv.Marselan)共6种红葡萄在葡萄酒酿造过程中采集的样品。葡萄原料均达到商业采收期,采自河北昌黎华夏葡萄基地(39°22'N 118°45'E~39°48'N 119°20'E),该基地东临渤海,北依燕山,平均海拔214m,属于我国东部季风区,暖温带半湿润大陆性气候。基本发酵工艺:葡萄原料→除梗破碎→酒精发酵→酒精发酵结束→浸渍→分汁→苹果酸-乳酸发酵→陈酿,发酵规模为300L(不锈钢发酵罐),发酵温度为16~26℃。样品分别采集于酒精发酵结束(I)、浸渍结束分汁(II)和苹乳发酵结束(III)三个阶段。
色谱纯的乙腈(acetonitrile)、甲醇(methanol)和甲酸(acetic acid)均购买于Fisher公司(Fairlawn,NJ,USA);二甲花翠素-3-O-葡萄糖苷(malvin-3-O-glucoside)标准品购买于Sigma-Aldrich公司;实验用水为娃哈哈纯净水。
1.2 仪器与设备
Agilent 1100系列LC/MSD Trap-VL液相色谱-离子阱质谱联用仪,包括在线G1379A真空溶剂脱气机、G1311A四元高压梯度泵、G1313A自动进样器、G1316A柱温箱、G1315A二极管阵列检测器(diode array detector,DAD):美国安捷伦科技公司;GL-20G-II型离心机:上海安亭科学仪器厂;UV-2450分光光度计:日本岛津公司;0.22μm微孔滤膜:天津市恒奥科技发展有限公司。
1.3 实验方法
1.3.1 CIELab法测定葡萄酒颜色
用蒸馏水作为参比,取离心后的葡萄酒样品经0.22μm滤膜过滤,采用0.2cm光程,用分光光度计分别于波长440nm、530nm、600nm处测定透光率并计算L*、a*和b*值[9],样品重复分析3次。
1.3.2 液相色谱质谱条件
色谱柱:Kromasil C18(250mm×4.6mm,5μm);流动相A:2.0%的甲酸水溶液,流动相B:2.0%的甲酸乙腈溶液。梯度洗脱程序:0min,10% B;1~18min,10%~25% B;18~20min,25%B;20~30min,25%~40%B;30~35min,40%~70%B;35~40min,70%~100%B。流速:1.0 mL/min;柱温:50℃;检测波长:525nm;进样量:30μL。
质谱采用电喷雾离子源(electronic spay ion,ESI),离子扫描范围:100~1 000m/z,正离子模式;雾化气压力:35psi;干燥气流速:10L/min;干燥气温度:325℃;碰撞诱导解离(collision indused dissociation,CID)的MS/MS诱导碰撞能量为1.0V。
1.4 定性定量分析
葡萄酒样品经滤膜过滤后直接用液相色谱-质谱联用技术进行花色苷检测分析,根据化合物的保留时间以及母离子和子离子的质荷比进行定性,通过外标法用二甲花翠素-3-O-葡萄糖苷(Malvin-3-O-glucoside)的标准曲线进行相对定量,每个样品重复3次。
2 结果与分析
2.1 葡萄酒发酵过程中花色苷组成与含量分析
分别比较了美乐、西拉、马瑟兰三个酿酒品种及不同品系葡萄酿酒过程中的花色苷组成与含量的变化。‘美乐’343葡萄酿酒过程3个阶段葡萄酒花色苷的液相色谱图,见图1。共鉴定出23种花色苷,见表1。包括花翠素-3-O-葡萄糖苷(Dephinidin-3-O-glucoside,Dp-3-glu)、花青素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside,Cy-3-glu)、甲基花翠素-3-O-葡萄糖苷(Petunidin-3-O-glucoside,Pt-3-glu)、甲基花青素-3-O-葡萄糖苷(Peonidin-3-O-glucoside,Pn-3-glu)和二甲花翠素-3-O-葡萄糖苷(Malvidin-3-O-glucoside,Mv-3-glu)共5种非酰化花色苷,其对应的11种酰化花色苷(5种乙酰酰化,5种香豆酰酰化,1种咖啡酰酰化)和7种聚合花色苷(3种丙酮酸形成的吡喃花色苷,3种乙醛形成的吡喃花色苷,1种黄烷醇聚合形成的花色苷)。由结果可知,发酵过程中同一品种不同品系葡萄酿造的葡萄酒花色苷种类相同,同属欧亚种的‘美乐’、‘西拉’和‘马瑟兰’3个葡萄品种酿造的葡萄酒花色苷只在个别种类上存在差异,‘美乐’和‘西拉’酿造的葡萄酒中可检测到相同的23种花色苷。但在‘马瑟兰’葡萄酒中仅检测到16种花色苷,未检测到的有:1种非酰化花色苷[花青素-3-O-葡萄糖苷(Cy-3-glu)]、2种酰化花色苷[花青素-3-O-香豆酰化葡萄糖苷(Cyanidin-3-O-(6-O-coumaryl)-glucoside,Cy-3-coum-glu)和甲基花翠素-3-O-香豆酰化葡萄糖苷(Petunidin-3-O-(6-O-coumaryl)-glucoside,Pt-3-coum-glu)]和4种聚合花色苷[二甲花翠素-3-O-乙酰化葡萄糖-乙醛聚合花色苷(Malvidin-3-O-(6-O-acetyl)-glucoside-acetaldehyde,Mv-3-acet-glu-acetal)、甲基花青素-3-O-葡萄糖-丙酮酸聚合花色苷(Peonidin-3-O-glucoside-pyruvic acid,Pn-3-glu-pa)、二甲花翠素-3-O-乙酰化葡萄糖-儿茶素聚合花色苷(Malvidin-3-O-glucoside-ethyl-catechin,Mv-3-glu-ethyl-ca)和二甲花翠素-3-O-香豆酰化葡萄糖-乙醛聚合花色苷(Malvidin-3-O-(6-Ocoumaryl)-glucoside-acetaldehyde,Mv-3-coum-glu-acetal)]。这些检测结果与前人进行的欧亚种葡萄酒花色苷检测结果种类基本一致,即主要由5种花色苷及其乙酰、香豆酰酰化的衍生物和少量聚合花色苷构成[4,10-11]。
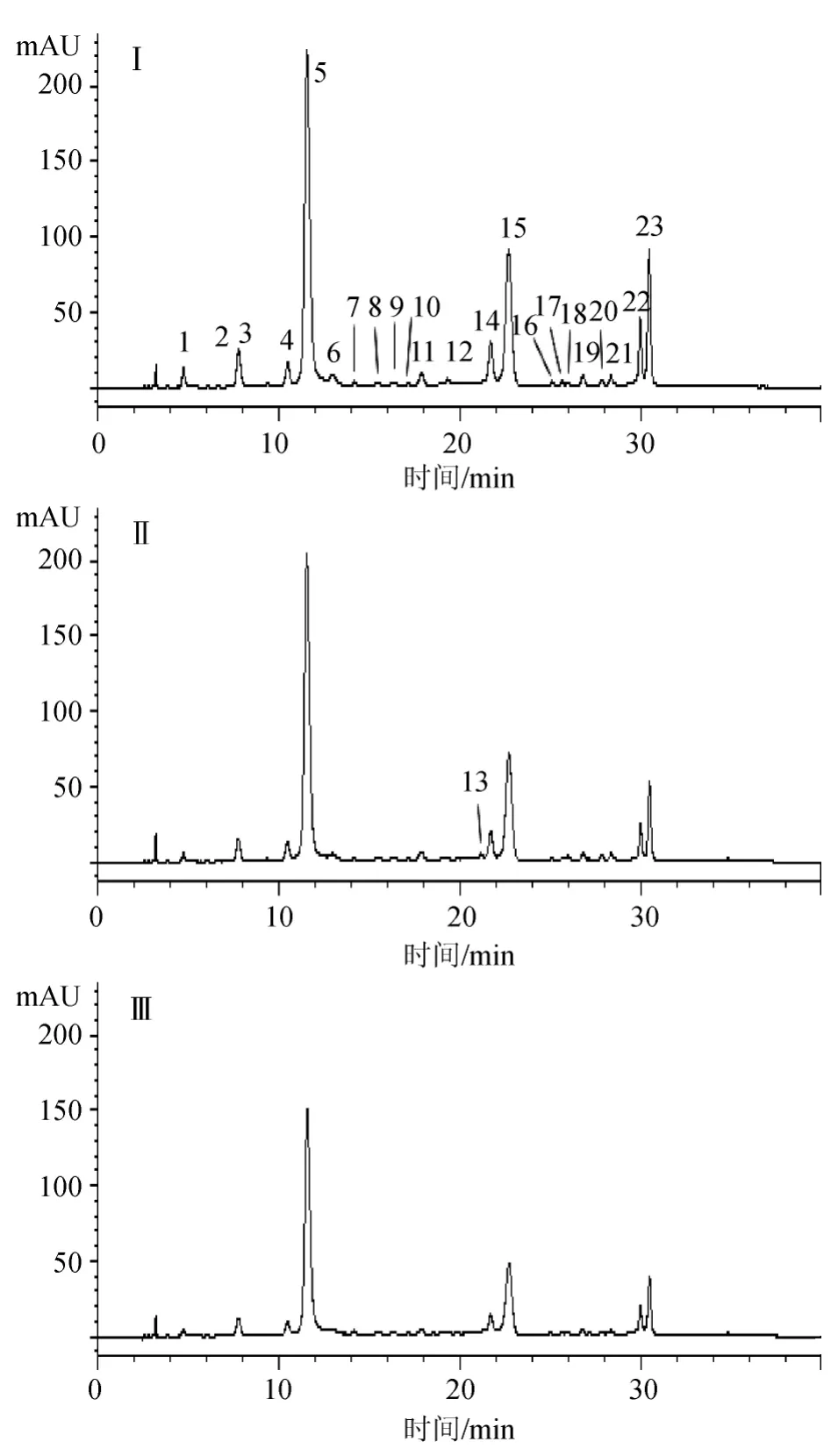
图1 ‘美乐’343葡萄酒发酵过程中花色苷的HPLC色谱图Fig.1 HPLC chromatograms of anthocyanins in‘Merlot’343 red wines during different fermentation stage

表1 ‘美乐’343葡萄酒中花色苷的HPLC-MS 信息表Table 1 The retention times,molecular and products ions of anthocyanins in‘Merlot’343 red wines
按照分子结构及酰化修饰类型的差异将这些花色苷分为非酰化花色苷、酰化花色苷(乙酰酰化花色苷、香豆酰化花色苷和咖啡酰化花色苷)和聚合花色苷。而这些花色苷在葡萄果实中主要来源于类黄酮3’-羟化酶(Flavonoid 3’-hydroxylase,F3’H,EC 1.14.13.21)和类黄酮3’,5’-羟化酶(Flavonoid 3’,5’-hydroxylase,F3’5’H,EC 1.14.13.88)2种代谢途径,由黄烷酮经F3’H和F3’5’H催化,在O-甲基转移酶(O-methyl transferase,OMT)、尿苷二磷酸萄葡糖(uridinediphosphate glucose,UDPG)-类黄酮葡糖转移酶等共同作用下,得到不同程度羟基化和羟甲基化修饰的花色苷产物[12],因此按照花色苷的纵向合成路径,即B环修饰模式(羟基化和羟甲基化修饰)将这些花色苷分为花青素类花色苷(cyanidin derivatives)、甲基花青素类花色苷(peonidin derivatives)、花翠素类花色苷(delphinidin derivatives)、甲基花翠素类花色苷(petunidin derivatives)和二甲花翠素类花色苷(malvidin derivatives)。3种葡萄品种的6个品系酿造的葡萄酒发酵过程中各类花色苷的含量变化见图2。‘美乐’343、346和181、‘西拉’100和525的花色苷总含量呈现一致的下降趋势,其非酰化花色苷总量、酰化花色苷总量以及乙酰酰化、香豆酰化等花色苷总量也随着发酵过程逐渐下降。整体而言,‘马瑟兰’红葡萄酒酿造过程中各类花色苷也呈现下降趋势,但在苹乳发酵结束时期(III)总花色苷含量比浸渍结束分汁时期(II)有所增加,主要源于二甲花翠素-3-O-葡萄糖苷(Mv-3-glu)和二甲花翠素-3-O-乙酰化葡萄糖苷(Mv-3-acet-glu)含量的增加。侯小歌等[13]利用旋转橡木桶和不锈钢发酵罐进行了‘赤霞珠’葡萄酒的酿造,发现了相似的下降规律。花色苷含量的下降可能与酿造过程中花色苷吸附损失、各种酚类物质聚合形成聚合物等原因有关[14-15]。虽然这些葡萄酒中各类花色苷含量逐渐下降,但聚合花色苷的总量均略微上升,比例低于10%。在‘美乐’和‘西拉’葡萄酒酿造过程中逐渐产生的新聚合花色苷主要包括二甲花翠素-3-O-乙酰化葡萄糖-乙醛聚合花色苷(Mv-3-acet-glu-acetal)、二甲花翠素-3-O-乙酰化葡萄糖-儿茶素聚合花色苷(Mv-3-glu-ethyl-ca)和甲基花青素-3-O-葡萄糖-丙酮酸聚合花色苷(Pn-3-glu-pa)3种,而在‘马瑟兰’葡萄酒发酵过程中逐渐产生的新聚合花色苷只有一种二甲花翠素-3-O-葡萄糖-丙酮酸聚合花色苷(Mv-3-acetglu-pa)。这些聚合花色苷主要由二甲花翠素类花色苷发生聚合反应后形成,以吡喃花色苷为主,对于葡萄酒颜色的影响大于其前体花色苷,源于新形成的吡喃环扩大了生色团的共轭体系,能够明显改善葡萄酒的颜色[16-17]。
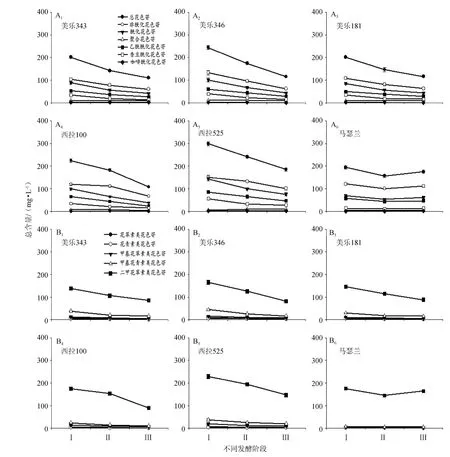
图2 ‘美乐’、‘西拉’、‘马瑟兰’葡萄酒发酵过程中各类花色苷的含量变化Fig.2 The content change of various types of anthocyanins in‘Merlot’,‘Shiraz’and‘Marselan’wines during fermentation
这些葡萄酒的酿造过程中,非酰化花色苷的比例均高于酰化花色苷,尤其在‘马瑟兰’葡萄酒中非酰化花色苷的比例高于60%。而在酰化花色苷中,乙酰酰化比例均高于香豆酰化,在‘美乐’和‘西拉’葡萄酒中乙酰酰化比例约60%,而在‘马瑟兰’葡萄酒中乙酰酰化比例达80%以上。但在这些葡萄酒中仅检测到二甲花翠素-3-O-咖啡酰化葡萄糖苷(Mv-3-caff-glu)一种咖啡酰化花色苷,且含量甚微。此外,这些葡萄酒中二甲花翠素类花色苷的比例达60%以上,在‘马瑟兰’葡萄酒中甚至高达90%以上,远超于其他4类花色苷,这在一定程度上解释了多种二甲花翠素类聚合花色苷形成的原因;其次占主要比例的是甲基花青素类花色苷,在‘美乐’343、346、181和‘西拉’100、525葡萄酒中约占10%,而在‘马瑟兰’葡萄酒中远低于10%。GÓMEZPLAZA E等[10]进行了欧亚种葡萄中非酰化及酰化类型花色苷的研究,发现‘赤霞珠’葡萄中非酰化花色苷的比例约60%,其他欧亚种葡萄中比例更高约80%,且二甲花翠素类花色苷的比例较高。葡萄酒中的花色苷来源于葡萄果皮的浸提,本研究结果进一步支持了前人对欧亚种葡萄果实花色苷的研究。
2.2 葡萄酒发酵过程中颜色参数的变化
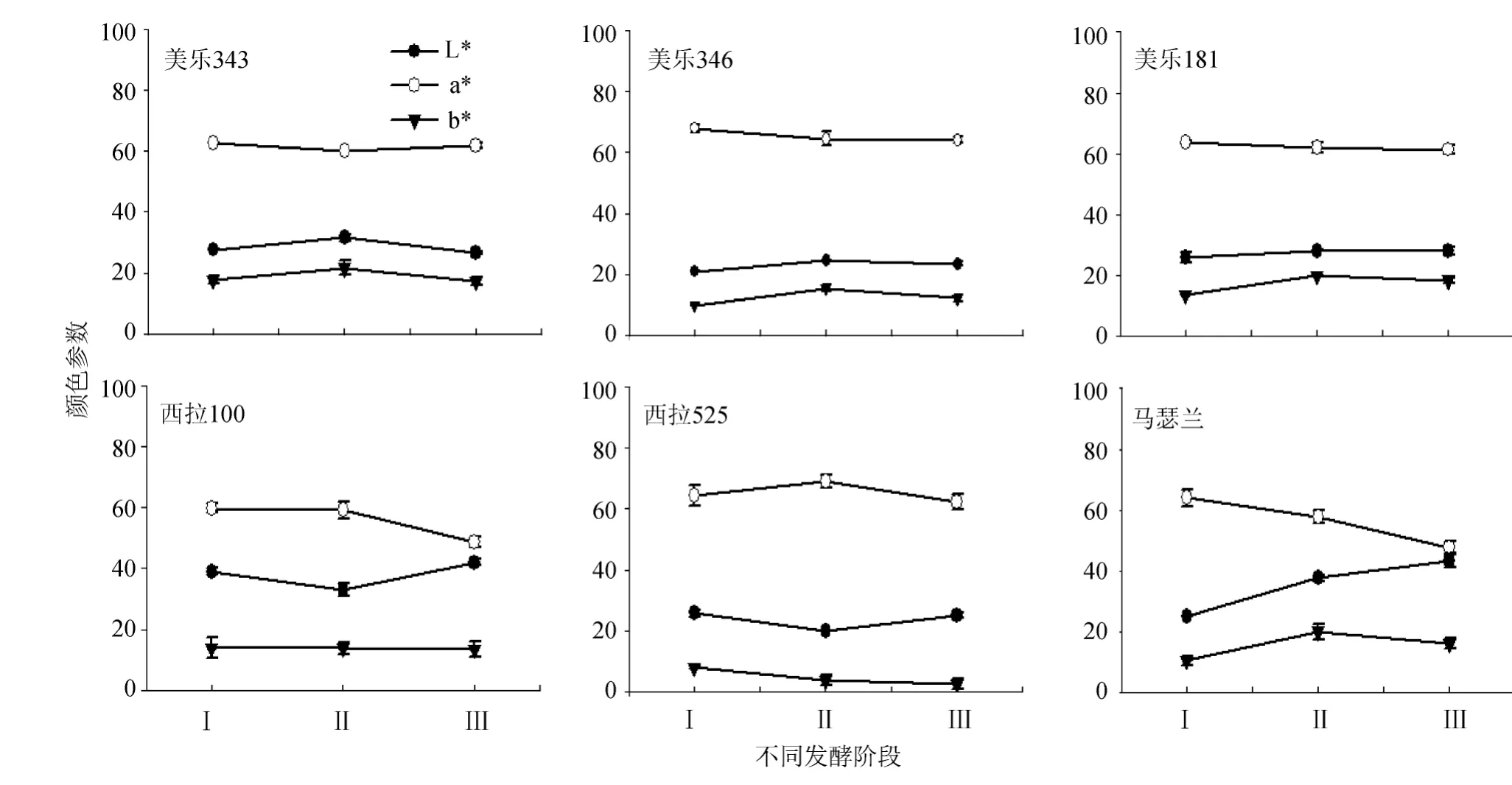
图3 ‘美乐’、‘西拉’、‘马瑟兰’葡萄酒发酵过程中CIELab颜色参数的变化Fig.3 The change of color values in‘Merlot’,‘Shiraz’and‘Marselan’wines during fermentation
由图3可知,‘美乐’、‘西拉’、‘马瑟兰’三个品种在色度色调的变化上不一致,但同一个品种的不同品系之间则较为相似。随着发酵时间的延长,‘美乐’葡萄酒的L*和b*在浸渍结束分汁时期(II)达到最大值,a*值变化不明显;‘西拉’葡萄酒亮度值L*先下降后上升,在浸渍结束分汁时期(II)亮度最低,相反地a*值在这个时期达到最高值,即颜色明显偏红;‘马瑟兰’葡萄酒L*值呈明显上升趋势,而a*值相反呈现明显下降趋势。MALIEN-AUBERT C等[18]研究发现乙酰化花色苷由于参与分子内辅色化过程能够明显影响葡萄酒颜色,而‘马瑟兰’葡萄酒中L*和a*值的明显变化可能与高达80%比例的乙酰化花色苷相关。
2.3 葡萄酒发酵过程中花色苷与颜色参数的相关性分析
将不同红葡萄酒酿造过程中检测到的花色苷与对应的葡萄酒颜色参数进行了相关性分析(表2),其中总花色苷含量、非酰化花色苷总量、酰化花色苷总量、乙酰酰化花色苷总量之间在0.01水平上呈显著相关,其与b*显著负相关,与L*和a*无相关性;香豆酰化花色苷和咖啡酰化花色苷与颜色参数L*、a*和b*不相关;聚合花色苷与L*显著负相关,与a*和b*不相关。花翠素类花色苷、花青素类花色苷、甲基花翠素类花色苷和甲基花青素类花色苷均与a*显著正相关,与L*显著负相关;二甲花翠素类花色苷与b*显著负相关;可以看出影响葡萄酒不同颜色参数的花色苷种类不同。兰圆圆等[19]进行了不同产地的葡萄酒分析,发现总花色苷含量与L*、a*不相关,与b*有相关性。

表2 花色苷组成和颜色参数的相关性分析Table 2 Correlation analysis of anthocyanins and color parameters
对发酵过程中这些酒样的花色苷含量和颜色参数进行主成分分析表明,第1主成分(principalcomponent1,PC1)、第2主成分(PC2)分别占所有数据方差的53.7%和20.4%。图4C为所有葡萄酒样品在PC1和PC2主成分上的分布情况,可看出同一‘美乐’葡萄品种3个品系343、346和181的葡萄酒变化过程一致,随发酵过程由PC1的正向端逐渐往PC1和PC2的负向端延伸(第3象限),且‘美乐’343和346品系更接近,与‘美乐’181品系明显区分。同一‘西拉’葡萄品种的2个品系100和525比较接近,变化过程与‘美乐’葡萄品种一致,均由PC1和PC2的正向端逐渐向负向端延伸。而‘马瑟兰’葡萄品种发酵过程变化与‘美乐’、‘西拉’不同,可以明显区分开来。因此根据发酵酒样的分布结果,可以区分不同葡萄酒的品种与品系。
图4D是葡萄酒各项参数在两个主成分上的载荷图,除咖啡酰化花色苷总量位于PC1的负向端外,其余花色苷含量均位于PC1正向端;a*位于PC1的正向端和PC2的负向端,L*和b*比较接近,恰巧与a*相反,位于PC1的负向端和PC2的正向端。按酰化种类差异得到的各类花色苷主要位于PC1的正向端和PC2的正向端(第1象限),按不同羟基化和羟甲基化修饰程度差异得到各类花色苷主要位于PC1的正向端和PC2的负向端(第4象限)。这些结果与CLIFF M A等[20]对于葡萄酒多酚成分的研究得出了相似的结论,说明红绿颜色参数a*受花色苷的影响明显,尤其花翠素类花色苷、花青素类花色苷、甲基花翠素类花色苷、甲基花青素类花色苷等对其影响更明显;而黄蓝颜色参数b*与总花色苷、非酰化花色苷、酰化花色苷、乙酰酰化花色苷等显著负相关;聚合花色苷与亮度L*显著负相关。
3 结论
本研究结果显示,同一品种不同品系葡萄酿造的葡萄酒花色苷种类相同,含量存在差异,不同品种葡萄酿造的葡萄酒花色苷在种类上存在差异,但这些欧亚种酿酒葡萄均由五种花色素形成的糖苷及衍生物构成,且二甲花翠素类花色苷是其主要构成;葡萄酒花色苷的总含量随着发酵过程逐渐下降,但逐渐形成了少量的聚合花色苷;葡萄酒CIELab颜色参数中,不同种类的花色苷影响不同的颜色参数,总花色苷含量、非酰化花色苷总量、酰化花色苷总量、乙酰酰化花色苷总量与b*显著负相关,花翠素类花色苷、花青素类花色苷、甲基花翠素类花色苷和甲基花青素类花色苷与a*显著正相关,聚合花色苷与L*显著负相关;供试酒样在主成分图上的分布存在差异,可以区分不同葡萄酒品种与品系。
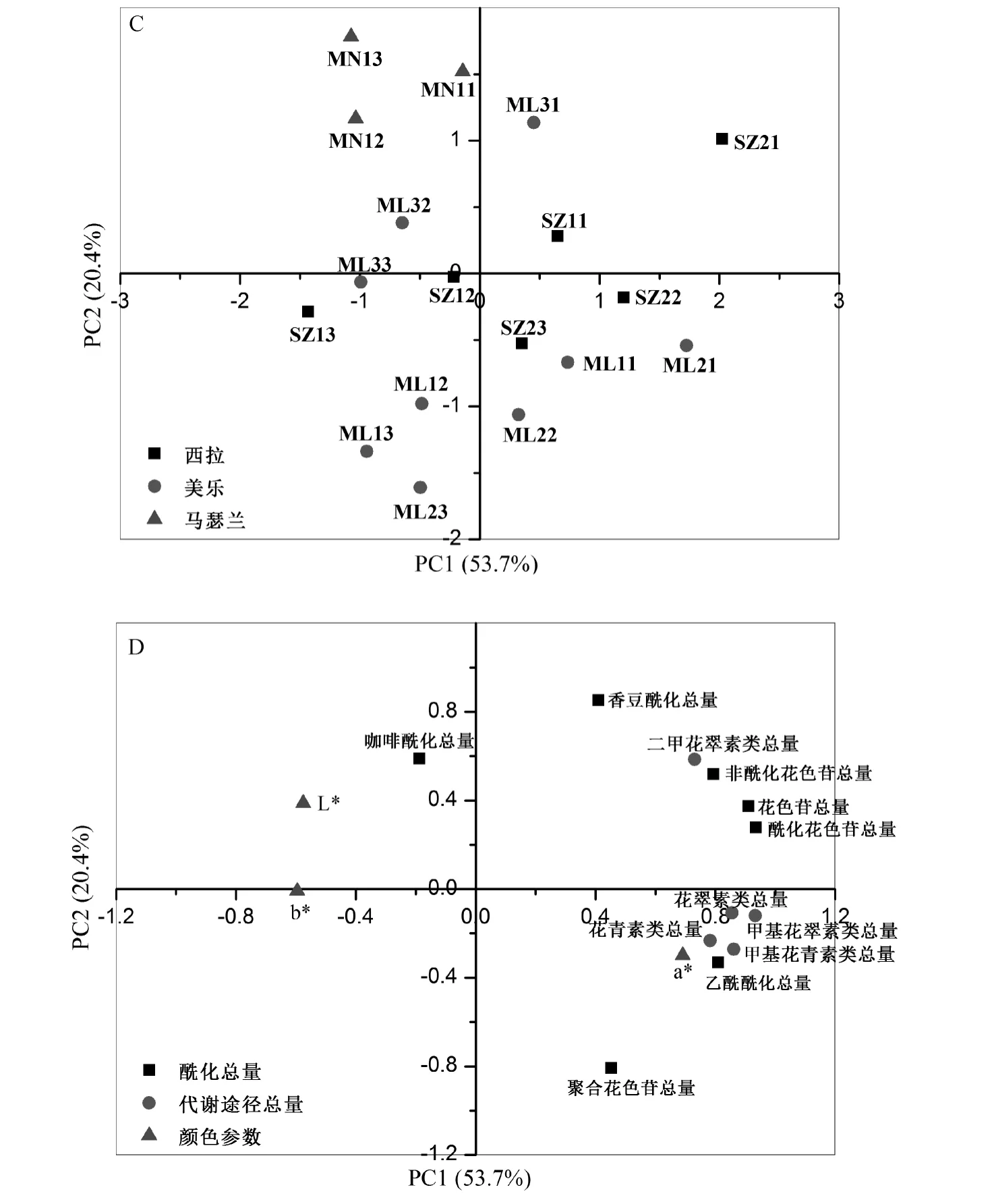
图4 ‘美乐’、‘西拉’和‘马瑟兰’葡萄酒发酵过程中花色苷的主成分分析Fig.4 Principal component analysis of anthocyanins from‘Merlot’,‘Shiraz’and‘Marselan’wines during fermentation
[1]DE FREITAS V,MATEUS N.Formation of pyranoanthocyanins in red wines:A new and diverse class of anthocyanin derivatives[J].Anal Bioanal Chem,2011,401(5):1463-1473.
[2]CABRITA L,FOSSEN T,ANDERSEN M.Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J].Food Chem,2000,68(1):101-107.
[3]HEREDIA F J,FRANCIA-ARICHA E M,RIVAS-GONZALO J C,et al.Chromatic characterization of anthocyanins from red grapes-I.pH effect[J].Food Chem,1998,63(4):491-498.
[4]HE F,LIANG N N,MU L,et al.Anthocyanins and their variation in red wines I.Monomeric anthocyanins and their color expression[J].Molecules,2012,17(2):1571-1601.
[5]GAUCHE C,DA SILVA MALAGOLI E,LUIZ M T B.Effect of pH on the copigmentation of anthocyanins from Cabernet Sauvignon grape extracts with organic acids[J].Sci Agr,2010,67(1):41-46.
[6]MATEUS N,DE PASCUAL-TERESA S,RIVAS-GONZALO J C,et al.Structural diversity of anthocyanin-derived pigments in port wines[J].Food Chem,2002,76(3):335-342.
[7]RENTZSCH M,SCHWARZ M,WINTERHALTER P.Pyranoanthocyanins-an overview on structures,occurrence,and pathways of formation[J].Trends Food Sci Tech,2007,18(10):526-534.
[8]PÉREZ-MAGARIÑO S,GONZÁLEZ-SANJOSÉ M L.Application of absorbance values used in wineries for estimating CIELAB parameters in red wines[J].Food Chem,2003,81(2):301-306.
[10]GÓMEZ-PLAZA E,GIL-MUÑOZ R,HERN^ NDEZ-JIM^ NEZ A,et al.Studies on the anthocyanin profile ofVitis viniferaintraspecific hybrids(Monastrell×Cabernet Sauvignon)[J].Eur Food Res Technol,2008,227(2):479-484.
[11]IVANOVA V,DÖRNYEI Á,STEFOVA M,et al.Rapid MALDI-TOFMS detection of anthocyanins in wine and grape using different matrices[J].Food Anal Method,2011,4(1):108-115.
[12]MATTIVI F,GUZZON R,VRHOVSEK U,et al.Metabolite profiling of grape:flavonols and anthocyanins[J].J Agr Food Chem,2006,54(20):7692-7702.
[13]侯小歌,于庆泉,严 斌,等.发酵容器对赤霞珠干红葡萄酒中花色苷的影响[J].食品科学,2006,27(8):154-158.
[14]刘一健,孙剑锋,王 颉.葡萄酒酚类物质的研究进展[J].中国酿造,2009,28(8):1-4.
[16]HAKANSSON A E,PARDON K,HAYASAKA Y,et al.Structures and colour properties of new red wine pigments[J].Tetrahedron Lett,2003,44(26):4887-4891.
[17]GONZÁLEZ-MANZANO S,SANTOS-BUELGA C,DUEÑAS M,et al.Colour implications of self-association processes of wine anthocyanins[J].Eur Food Res Technol,2008,226(3):483-490.
[18]MALIEN-AUBERT C,DANGLES O,AMIOT M J.Color stability of commercial anthocyanin-based extracts in relation to the phenolic composition.Protective effects by intra-and intermolecular copigmentation[J].J Agr Food Chem,2001,49(1):170-176.
[19]兰圆圆,陶永胜,张世杰,等.我国多产区干红葡萄酒颜色相关指标的关联分析[J].食品科学,2013,34(11):1-4.
[20]CLIFF M A,KING M C,SCHLOSSER J.Anthocyanin,phenolic composition,colour measurement and sensory analysis of BC commercial red wines[J].Food Res Int,2007,40(1):92-100.
