超声波辅助提取紫薯花青素及抗氧化性研究
2014-04-24田喜强董艳萍
田喜强,董艳萍
(绥化学院 食品与制药工程学院,黑龙江 绥化 152061)
花青素是一类水溶性类黄酮化合物[1],其抗氧化性能是维生素C的20倍、维生素E的50倍。花青素对100多种疾病有预防和治疗作用[2-4],被誉为继水、蛋白质、脂肪、碳水化合物、维生素、矿物质之后的第七大必需营养素[5-7]。随着食品着色剂(合成色素)安全性的降低,天然色素作为食品着色剂在世界范围的使用量不断增加,越来越多的天然色素被研发,近年来,人们对花青素提取进行了较深入的研究,取得了可喜的成果[8-12]。目前,已开发成功的花青素有葡萄皮红色素、萝卜红色素、紫玉米色素、紫甘蓝色素等[13],这些色素稳定性差,且含杂质多,因此其的应用和开发受到一定的限制,紫薯色素具有纯天然效应和营养功能,应用于食品中安全性高,具有很强的抗氧化活性和稳定性[14-15],对人体无害而成为研究热点。本研究在超声波辅助条件下,考察了提取紫薯中花青素的最佳工艺,对提取的紫薯花青素进行了抗氧化性研究,探讨了花青素的抗氧化性能,为紫薯花青素的进一步应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
紫薯:市售,干燥粉碎后过80目筛。乙酸、硫酸盐铁、水杨酸、乙醇均为分析纯:天津市滨海科迪化学试剂有限公司。抗坏血酸:上海博湖生物科技有限公司。
1.2 仪器与设备
TU-1901紫外可见分光光度计:北京普析通用公司;KQ300VDE双频超声清洗仪:昆山超声仪器公司;RE52A旋转蒸发仪:上海亚荣仪器公司;G-903 MB数显鼓风干燥箱:天津市泰斯特仪器公司。
1.3 实验方法
1.3.1 紫薯花青素的提取工艺流程
将新鲜的紫薯洗净沥干→切成薄片60℃烘箱中干燥至质量恒定→粉碎→筛分(80目筛)→称取适量紫薯粉→超声处理(乙酸浸提)→抽滤→色素粗提液→旋转蒸发→冷冻干燥→色素粗提物。
1.3.2 实验设计
以紫薯为实验材料,分析提取温度、浸提时间、料液比和提取液浓度对花青素提取的影响。在确定了超声功率为300W、最佳溶剂为乙酸的水溶液条件下,对料液比(g/mL)、提取液浓度、水浴温度(℃)、浸提时间(min)4个因素进行实验设计。参照杨朝霞[16]的方法,将一定量的花青素样品溶于pH为3.0的柠檬酸-磷酸氢二钠的缓冲溶液中,并测定其最大吸收波长下的花青素吸光度值,利用朗伯-比尔定律换算。
提取料液比的影响:量取10mL、15mL、20mL、25mL、30mL的15%乙酸,分别加入1.0g紫薯粉,在300W功率超声60min,保持水温为40℃条件下浸提,减压过滤,收集滤液,得到的沉淀再分别加入等体积上述溶液提取,将滤液合并,定容至100mL。通过紫外分光光度计在波长525nm处测定其吸光度值,确定料液比。
提取液体积分数的影响:量取20mL体积分数为5%、10%、15%、20%、25%的乙酸,分别加入1.0g紫薯粉,在300W功率超声60min,40℃恒温超声提取,减压过滤,收集滤液,沉淀利用20mL上述溶液再次溶解提取,将滤液合并,定容至100mL。通过紫外分光光度计在波长525nm处测定其吸光度值,确定乙酸最佳浓度。
水浴温度的影响:量取20mL的15%乙酸,加入1.0g紫薯粉,在300W功率下超声,水浴温度分别控制在20℃、30℃、40℃、50℃、60℃恒温浸提60min,减压过滤,收集滤液,得到的沉淀分别加入20mL上述溶液溶解提取,将滤液合并,定容至100mL。通过紫外分光光度计在波长525nm处测定其吸光度值,确定最好的水浴提取温度。
提取时间的影响:量取20mL的15%乙酸,加入1.0g紫薯粉,在300W功率超声,保持水浴40℃恒定浸提,时间分别为30min、45min、60min、75min、90min,减压过滤,收集滤液,沉淀再利用20mL上述溶液溶解提取,合并滤液,定容至100mL。稀释2倍后,通过紫外分光光度计在波长525nm处测定其吸光度值,确定最佳提取时间。
1.3.3 花青素抗氧化性实验
清除羟基自由基实验:取1mL 8mmol/L硫酸亚铁、1mL 8mmol/L的水杨酸-乙醇和1mL样品放入反应器,然后加入1mL 8.8mmol/L的过氧化氢,在38℃水浴中反应40min。利用二次蒸馏水作参比液,空白对照品以超纯水代替样品,对照品以抗坏血酸代替样品,每个处理重复3次。在520nm波长处测吸光度值,3次取平均值,羟基自由基清除率按下式计算:

式中:A0、A1分别为空白与样品的平均吸光度值。
2 结果与分析
2.1 花青素最大吸收波长的确定
取一定量紫薯花青素提取液用15%乙酸溶液稀释至适当浓度,使用紫外可见分光光度法在400~700nm波长范围内测试吸光度,确定花青素提取液的最大吸收波长。使用TU-1901紫外可见分光光度计对紫薯中花青素提取液进行扫描。平行扫描3次,结果如图1,花青素提取液最大吸收波长为525nm。
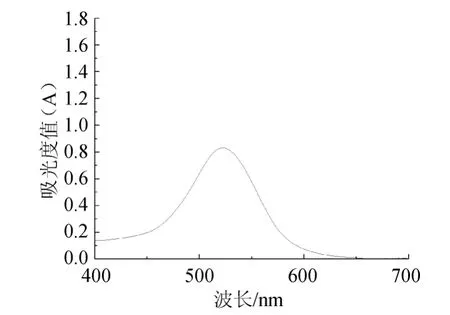
图1 紫薯花青素的紫外扫描图Fig.1 UV scan of purple potato anthocyanins
2.2 料液比的影响
料液比对紫甘薯花青素提取量的影响见图2。在300W超声辅助下,以体积分数15%的乙酸溶液为提取液,固定提取时间和提取温度,改变提取的料液比进行紫薯花青素的提取,在波长525nm处测定其吸光度值。由图2可知,在提取料液比1∶10~1∶25的区间内吸光度值随乙酸体积分数的增大而升高,在料液比为1∶25时达到最大吸收,当料液比超过这个值时吸光度值减小,说明最适提取料液比为1∶25。而且提取料液比超过1∶25,过滤和提取后溶剂的回收会有较大的困难。因此,料液比最佳值为1∶25。

图2 料液比对紫薯花青素提取的影响Fig.2 Effect of solid-liquid ratio on anthocyanin extraction
2.3 乙酸体积分数的影响
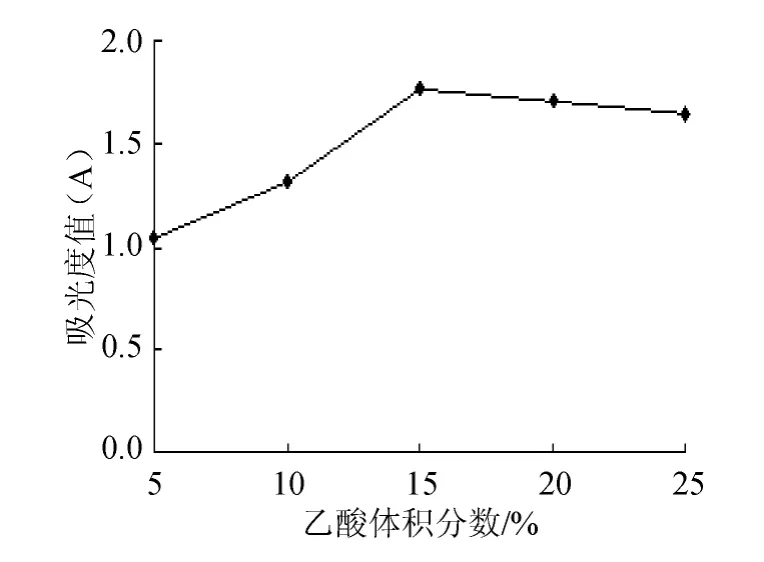
图3 乙酸体积分数对紫薯花青素提取的影响Fig.3 Effect of the acetic acid volume fraction on anthocyanin extraction
改变乙酸体积分数对紫薯花青素进行提取情况见图3。由图3可知,用乙酸作提取溶液时,当乙酸体积分数为15%提取效果最好,体积分数<15%时,随着乙酸体积分数的增大,提取效率增加,但体积分数大于15%时,提取效率呈下降的趋势,且变化不大,所以确定体积分数15%的乙酸溶液为花青素最佳提取液。
2.4 水浴温度的影响
温度对提取效果的影响见图4。由图4可知,20~40℃温度范围内,溶液的吸光度值随水浴温度的升高而增加,表明花青素提取效果随温度升高而变好。随着温度的升高,增加可溶性物质的溶解度和扩散速度,在40~60℃范围内,吸光度值不稳定,花青素的提取率低于40℃时的提取率,并且对能源的消耗较高。同时当温度过高,一些不稳定成分就可能变质或分解,因此,水浴40℃为最适宜提取温度。
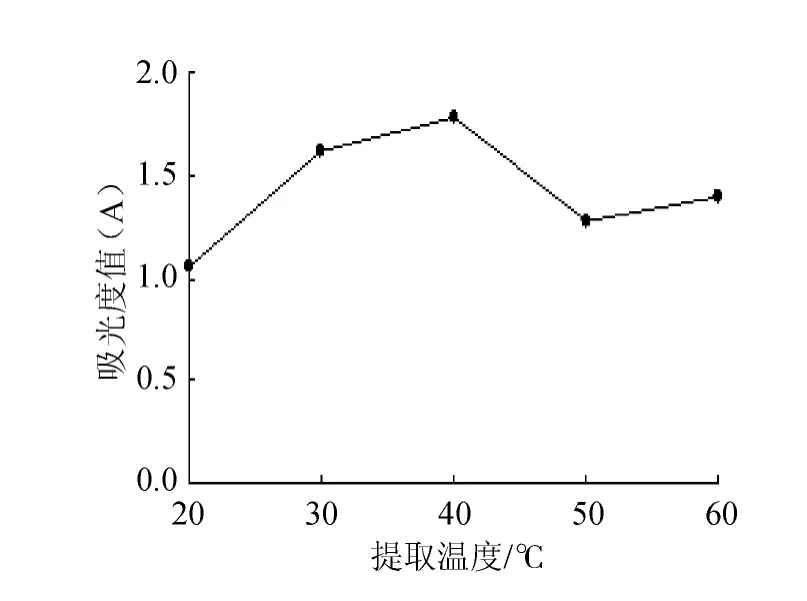
图4 水浴温度对紫薯花青素提取效果的影响Fig.4 Effect of water bath temperature on anthocyanin extraction
2.5 提取时间的影响
不同提取时间对紫薯花青素提取的影响见图5。由图5可知,提取时间在30~60min内变化时,随提取时间增加花青素溶出的更多。60min花青素的提取量达到最大。然而,在提取时间60~90min内变化时,吸光度值随提取时间增加而降低。可能是因为花青素发生水解的速率过大,导致吸光度值下降。所以,60min为最佳提取时间。

图5 提取时间对紫薯花青素提取效果的影响Fig.5 Effect of extraction time on anthocyanin extraction
2.6 清除羟基自由基效果
花青素对羟基自由基的清除率结果见图6。由图6可知,低质量浓度下花青素清对羟基自由基清除率显著强于抗坏血酸。在pH为7.0 时,质量浓度为0.1mg/mL的花青素对羟基自由基清除率达到50%,而抗坏血酸的质量浓度为0.2mg/mL对羟基自由基清除率才达到50%。所以,花青素清除羟基自由基的能力明显强于抗坏血酸。

图6 抗坏血酸和花青素清除羟自由基的能力比较Fig.6 Comparison of the scavenge hydroxyl radicals ability between ascorbic acid and anthocyanins
3 结论
紫薯富含天然花青素,其色泽鲜艳,且具有显著的自由基清除能力,防突变,是不可多得的兼具营养、保健和着色等功能的生理活性物质。本实验通过对紫甘薯中花青素提取工艺优化及抗氧化性研究,结果表明,在功率300W超声波辅助下,采用体积分数为15%乙酸作为提取剂,在温度40℃、时间60min、料液比1∶25条件下花青素提取效果最好。而且pH=7.0 时,花青素清除羟基自由基的能力强于抗坏血酸。0.1mg/mL的花青素清除羟基自由基达到50%,且低浓度下花青素清除羟基自由基的效率明显优于抗坏血酸。
[1]韩海华,梁名志,王 丽,等.花青素的研究进展及其应用[J].茶叶,2011,37(4):217-220.
[2]王日为,张丽霞,高吉刚.茶叶中花青素类物质研究展望[J].茶叶科学技术,2002,15(4):4-8.
[3]方忠祥,倪元颖.花青素生理功能研究进展[J].广州食品工业科技,2001,17(3):60-62.
[4]MATSUMOTO H,NAKAMURA Y,TACHIBANAKI S,et al.Stimulatory effect of cyaniding 3-glycosides on the regeneration of rhodopsin[J].J Agr Food Chem,2003,51(12):3560-3563.
[5]吴烈洪,汤惠芬,李 兵.紫甘薯粉生产中花青素的稳定性研究[J].粮油食品科技,2009,17(6):42-44.
[6]戚向阳,王小红,陈维军.苹果原花青素的稳定性及其保健饮品的研究[J].食品科技,2003,13(1):88-90.
[7]王 丽,赵甜甜,韩海华,等.花青素的研究进展及其应用[J].茶叶,2011,37(4):217-220.
[8]史明科,郭金英,任国艳,等.葡萄酒酚类物质研究进展[J].酿酒科技,2012,20(4):17-20.
[9]NETZEL M,STRASS G,BITSCH I,et al.Effect of grape processing on selected antioxidant phenolics in red wine[J].J Food Eng,2003,56(2-3):223-228.
[10]廖建民,黄 钢,姚万春.紫薯用于酿造中国浓香型白酒的分析[J].中国酿造,2012,31(11):153-154.
[11]左 勇,李 杨,谢 晖,等.桑椹果酒酒糟中原花青素提取工艺研究[J].中国酿造,2012,31(8):40-43.
[12]姚钰蓉,木泰华,张 伟.紫甘薯花青素的提取纯化及其稳定性研究[J].食品科技,2009,34(6):195-198.
[13]吴 春,孙胜梅,刘 涛.紫甘薯花青素的功能特性研究[J].化学与黏合,2012,34(6):13-14.
[14]吴发萍,郝萍萍,张楷正,等.紫薯与紫薯清酒中花青素的测定及稳定性研究[J].酿酒科技,2012(11):108-110.
[15]楚文靖,滕建文,夏 宁,等.紫甘薯酒抗氧化活性的研究[J].酿酒科技,2007(12):43-46.
[16]杨朝霞.紫甘薯花色苷色素提取纯化工艺研究及组分分析[D].青岛:青岛大学硕士论文,2004.
