多菌种复合制曲技术研究
2014-04-24赵红年
林 汲,赵红年*
(山西梁汾醋业有限公司,山西 太原 030032)
传统山西老陈醋大曲原料为大麦和豌豆,制曲过程中微生物主要来源于原料和制曲环境,包括霉菌、酵母菌、醋酸菌、芽孢菌等,传统制曲法主要依靠环境中的微生物自然选择形成特定的群落,进而代谢产生酶系[1]。由大麦和豌豆所构成的大曲其营养成分不能满足更多种类微生物的栖息、生长,且传统方法所富集的微生物不具有定向选择性,对原料的利用率不高,亦对食醋品质的稳定性有一定的影响[2]。
本研究在传统制曲原料的基础上,加入一定比例的麸皮、荞麦和绿豆,并分离出制曲过程中的优势菌种,经诱变、扩培、接种至复合曲的制备过程中,经多种微生物菌群的协同发酵,提高了复合曲中的特定酶活,为酿造高品质多香型食醋奠定了基础。
1 材料与方法
1.1 材料与试剂
大麦、豌豆、荞麦、绿豆(要求颗粒饱满,无病变,无霉变)均购于山西三盟实业发展有限公司;麸皮(购于古船面粉(晋中)有限公司);饮用纯净水:自制。
葡 萄 糖、NaNO3、K2HPO4、KCl、MgSO4·7H2O、FeSO4、琼脂、蛋白胨、牛肉膏、酵母提取物、磷酸氢二钾、柠檬酸铵、乙酸钠、葡萄糖、硫酸镁、硫酸锰均购自国药集团化学试剂公司。
霉菌分离培养基—马铃薯葡萄糖琼脂(potato dextrose agar medium,PDA)培养基[3]:马铃薯200.0g/L,葡萄糖20.0g/L,琼脂20.0g/L,自然pH值,121℃灭菌20min。
酵母菌分离培养基酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[4]:葡萄糖20.0g/L,蛋白胨20.0g/L,酵母浸粉10.0g/L,琼脂20.0g/L,115℃灭菌30min。
1.2 仪器与设备
UV-2100紫外分光光度计:日本岛津公司;pHS-3C型精密酸度计:上海精密仪器有限公司;SYQ-DSX-280B高压灭菌锅:上海申安医疗器械厂;LHS-250SC恒温恒湿培养箱:上海博讯实业有限公司;SW-CJ-1F单人双面净化工作台:苏州净化设备有限公司;GZC-9140MBE电热鼓风干燥箱:上海博讯实业有限公司;CX21显微镜:日本奥林巴斯公司;TE124S分析天平:德国赛多利斯;HZQ-A气浴恒温振荡器:常州中诚仪器制造有限公司。
1.3 方法
1.3.1 菌种分离
将曲块研细成粉,称取25.0g于225mL无菌生理盐水中,用玻璃珠打散,浸泡30min。取1.0mL上清液加入9.0mL无菌生理盐水中,配制成10-2菌悬液。依次类推,配制成10-3~10-7的菌悬液。分别吸取0.2mL稀释度为10-3~10-7的菌悬液,均匀涂布于已冷却至室温的平板培养基上,每个稀释度做3个平行样。将接种好的平板置于36℃恒温培养箱中培养3~5d[5]。
1.3.2 菌种诱变
参照刘庆玉等[6]试验方法,菌悬液先用30W紫外线照射60s,然后再用浓度为0.2mol/L的亚硝酸处理20min,诱变菌株经培养后,挑取菌落较大且厚的菌株,编号并接入试管斜面保藏,同时取对应的菌株活化后接种至250mL摇瓶中,30℃、180r/min摇床发酵培养48h,对发酵液进行分析并选取优势菌株。
1.3.3 菌种拮抗试验
将各菌株做拮抗试验,2种不同的菌在平板上划线但不相交,观察是否有拮抗,抑制孢子的生成等现象[7-9]。
1.3.4 种曲制备
5种原料混合、筛选、粉碎,然后加水,加水量为原料总重量的0.5~0.6倍。将不同高产菌种各取2~3环,接入装有种曲原料的三角瓶中进行培养(pH6.0~7.0,温度32~34℃,时间46~48h),之后继续扩培,制得种曲。
1.3.5 多菌种复合曲制备工艺流程
(1)配料
根据本研究中主要微生物的产酶能力,大麦、豌豆、麸皮、荞麦、绿豆按照特定比例进行组配,水的质量为上述原料总质量的0.5~0.6倍。
(2)接种
拌匀后的曲料接种预先培养好的种曲,充分翻拌。
(3)堆积
曲料堆积高度50cm,温度33~34℃,时间24~36h,以使孢子吸水膨胀、发芽。
(4)发酵控制
根据复合曲的品温来进行通风,以保持其品温在32~34℃范围内,并根据菌种生长的时期和特性对复合曲的水分进行补偿或减少。
(5)复合曲成曲
菌丝生长衰退,呼吸已不旺盛,降低湿度,提高品温至37~39℃,以排除水分,出房水分应控制在25%以下。
1.3.6 多菌种复合曲制备工艺优化
通过制曲温度、种曲接种量、复合曲相对湿度和制曲时间4个因素来研究,以酯化力为试验指标,在单因素试验基础上,通过正交试验进行优化。
1.3.7 质量鉴定方法
糖化力、液化力的测定方法依照文献[10]方法进行;酯化力根据文献[11]方法进行测定;蛋白酶活根据文献[12]方法进行测定。
糖化酶活力(简称糖化力)定义:1.0g固态发酵产物在35℃、pH值为4.6的条件下,1h分解可溶性淀粉产生1.0mg葡萄糖,即为1个酶活力单位,U/g[13]。
液化酶活力(简称液化力)定义:1.0g固态发酵产物在60℃、pH值为6.0条件下,1h液化1.0g可溶性淀粉,定义为1个酶活力单位,U/g[13]。
酯化力(以乙酸乙酯计)定义:1.0g干曲在30~32℃反应100h所产生的乙酸乙酯毫克数,以mg/(g·100h)表示[14]。
蛋白酶活力定义:1.0g干曲在40℃、pH7.5的条件下,水解反应l.0min产生l.0μg 酪氨酸为1个酶活力单位,以U/g表示[14]。
2 结果与分析
2.1 制曲原料配比
山西老陈醋大曲的原料为大麦和豌豆,两者的比例约为6∶4[15],大麦含有较多的皮壳,纤维素含量高,淀粉含量约58%~65%[16];豌豆蛋白质含量约21%~28%,淀粉含量低,黏稠性大,易黏结成块[17];麸皮碳水化合物含量约为61%,蛋白质含量16%[18];荞麦中氨基酸含量较为丰富,碳水化合物含量为73%[19];绿豆中蛋白质含量约为干质量的22%,其微量元素亦较为丰富[20],而且在制曲原料中添加绿豆,能够赋予复合曲特殊的香气。
根据山西老陈醋大曲、镇江香醋小曲以及酱油曲中碳水化合物和蛋白质含量的比例,结合本研究多菌种生长代谢的基本要求,确定了复合曲原料最适配比为大麦30%、豌豆15%、麸皮10%、荞麦20%、绿豆25%。
2.2 菌种选择
经分离、诱变,选择高产酶菌种,见表1。

表1 菌种选择Table 1 Selection of strains
2.3 菌种间拮抗
菌种间拮抗作用见表2。

表2 不同菌种拮抗作用Table 2 Antagonistic effect of different strains
表2结果表明,所选择的菌种之间不具有拮抗关系,因此可以将其接入制曲原料中。
2.4 单因素试验
2.4.1 制曲温度
固定多菌种复合曲相对湿度65%,种曲接种量3.5%,在不同温度条件下培养72h,测定其酯化力。
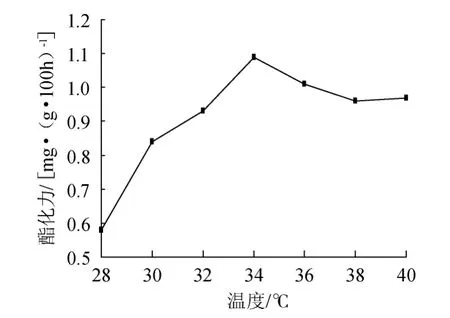
图1 温度对多菌种复合曲酯化力的影响Fig.1 Effect of temperatures on multi-strains complex koji esterifying power
由图1可知,制曲温度对多菌种复合曲的酯化力影响较大。28℃时,酯化力仅为0.58 mg/(g·100h);随着温度的上升,酯化力提高。34℃时,酯化力达到最高1.09mg/(g·100h);34~40℃,其酯化力有所降低。分析原因为曲醅中微生物在高于最适生长温度条件下,其生长代谢受到抑制,大部分菌种随着温度的增高而死亡,其代谢产生的酶系总量也有所降低。上述结果表明,制曲温度不能波动太大,34℃制曲温度较为适宜。
2.4.2 种曲接种量
固定多菌种复合曲相对湿度65%,温度34℃,培养时间72h,不同比例接种后分别培养,测定酯化力。

图2 种曲接种量对多菌种复合曲酯化力的影响Fig.2 Effect of inoculum size on multi-strains complex koji esterifying power
由图2可知,种曲接种量与多菌种复合曲的酯化力呈正相关。随着接种量的增加,多菌种复合曲的酯化力有所提高;2.5%~4.0%接种区间,酯化力随接种量的增加而增加,4.0%~5.0%接种区间,酯化力趋于稳定。因此,4.0%的接种量较为适宜。
2.4.3 多菌种复合曲相对湿度
种曲接种量4.0%,多菌种复合曲相对湿度为50%、55%、60%、65%、70%、75%,34℃分别培养72h,测定其酯化力。
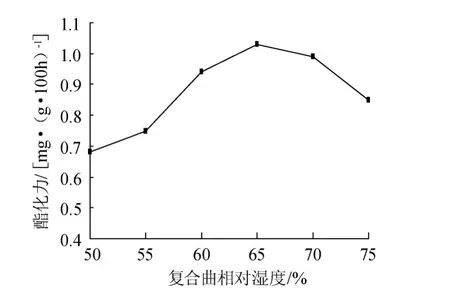
图3 多菌种复合曲相对湿度对酯化力的影响Fig.3 Effect of multi-strains complex koji relative humidity on esterifying power
由图3可知,多菌种复合曲的相对湿度对微生物的生长代谢也十分重要。接种后孢子发芽需吸水膨胀,随着相对湿度的增加(50%~65%),其酯化力有所提高,但当相对湿度过高(大于65%)酯化力有所降低。分析其原因为多菌种复合曲相对湿度过高,严重破坏微生物胞内外渗透平衡,抑制了微生物的生长代谢,影响其产酶能力。因此,相对湿度65%较为适宜。
2.4.4 制曲时间
固定多菌种复合曲相对湿度65%,种曲接种量4.0%,在34℃条件下分别培养24h、36h、48h、60h、72h、84h、106h,测定其酯化力。

图4 制曲时间对多菌种复合曲酯化力的影响Fig.4 Effect of preparation time on multi-strains complex koji esterifying power
由图4可知,24~72h时,酯化力随培养时间的延长而逐渐提高;72~106h时多菌种复合曲酯化力趋于恒定,说明在该时间段微生物群落结构及其生物总量趋于稳定,对原料的利用和代谢产生的酶系也趋于恒定。因此,制曲时间72h较为适宜。
2.4.5 多菌种复合曲制备条件优化

表3 多菌种复合曲制备条件优化正交试验因素水平Table 3 Factors and levels of orthogonal experiment for optimization of multi-strain complex preparation conditions

表4 多菌种复合曲制备条件优化正交试验结果与分析Table 4 Results and analysis of orthogonal experiment for optimization of multi-strain complex preparation condition

表5 多种复合曲制备条件优化正交试验结果方差分析Table 5 Variance analysis of orthogonal experiment for optimization of multi-strain complex preparation condition
由表4可知,对酯化力值影响的因素主次顺序为制曲时间>种曲接种量>相对湿度>温度,最佳制备条件为A2B3C2D2,即制曲温度34℃,种曲接种量4.5%,相对湿度65%,制曲时间72h。按上述优化条件制备多菌种复合曲,测得其酯化力平均值为1.14mg/(g·100h),高于正交试验中各试验组,为最佳制曲方案。由表5可知,影响多菌种复合曲酯化力的4个因素为D>B>C>A,4个因素对结果均无显著影响。
2.4.6 多菌种复合曲鉴定

表6 多菌种复合曲与大曲的理化性能比较Table 6 Comparison of physicochemical properties of multi-strain complex koji and Daqu
由表6可知,多菌种复合曲糖化力、液化力、酯化力及蛋白酶活均比大曲高。其中,糖化力提高14.63%,液化力提高15.09%,酯化力高23.91%,蛋白酶活性提高17.50%。说明多菌种的接入对复合曲糖化力、液化力、酯化力以及蛋白酶活力的提高起到直接的作用。
酯化力的提高将增加其发酵终产物食醋的香气,蛋白酶活力提高将增加产品中氨基酸的含量,甘薯曲霉和黑曲霉分别具有高产纤维素酶和糖化酶的活性,能够最大程度地将原料中的纤维素、淀粉分解为葡萄糖,为多群系多种类微生物的生长代谢提供了充足的能源。
3 结论
本研究将分离筛选到的发酵主体功能菌种进行了特定的高产酶诱变,并将其接种至复合曲的制备中,并根据特定微生物的代谢功能特点,在大曲制备原料的基础上,加入麸皮、荞麦和绿豆,进一步丰富了原料的营养成分,增加了多菌种复合曲的酶系。所得多菌种复合曲糖化力、液化力、酯化力以及蛋白酶活均有所提高,该研究为酿造高品质多香型食醋奠定了基础。
[1]侯红萍,郝 林.发酵食品工艺学[M].太原:山西高校联合出版社,1994.
[2]武晋海,郝 林,白瑞华.山西老陈醋大曲微生物生态分布[J].山西农业大学学报,2004(3):280-282.
[3]许青莲,邢亚阁,车振明,等.川西高原冰酒发酵中Pichia anomala的鉴定与耐受性研究[J].中国酿造,2013,32(8):39-42.
[4]张 磊,施 思,张文学,等.浓香型白酒大曲中酵母菌的分离和鉴定[J].酿酒科技,2010(5):39-41.
[5]郝 林.食品微生物学实验技术[M].北京:中国农业出版社,2001.
[6]刘庆玉,姚 影,张 敏,等.紫外诱变筛选高效木质素降解菌株的研究[J].可再生能源,2010,8(28):58-59.
[7]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[8]周庆红,杨寅桂,范淑英,等.金针菇航天种菌丝诱变效应的研究[J].2010,29(5):37-39.
[9]张 敏,刘庆玉,来世鹏,等.混合菌种对玉米秸秆降解作用的效果研究[J].沈阳农业大学学报,2011-12,42(6):746-748.
[10]沈怡芳.白酒生产技术全书[M].北京:中国轻工业出版社,1998.
[11]沈才洪,应 鸿,许德富,等.大曲质量标准的研究第二报:大曲酯化力的探讨[J].酿酒科技,2005(3):17-20.
[12]倪海晴.提高酱油大曲酶活和改善酱油发酵效果的研究[D].无锡:江南大学硕士论文,2010.
[13]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2005.
[14]李大和.浓香型大曲酒生产技术[M].北京:中国轻工业出版社,1997.
[15]黄仲华,殷小平.食醋生产问答[M].北京:中国轻工业出版社,1999.
[16]陈海华,董海洲.大麦的营养价值及在食品业中的利用[J].西部粮油科技,2002(2):34-36.
[17]张树成,李玉林.制取豌豆分离蛋白及淀粉的工艺研究[J].农产品加工·学刊,2012(7):77-80.
[18]林 琳.小麦麸皮的营养成分及其开发利用[J].农业科技与装备,2010(3):41-42
[19]朱锡义.荞麦的营养价值与综合利用[J].云南农业科技,1986(1):40-41.
[20]王明海,徐 宁,包淑英,等.绿豆的营养成分及营养价值[J].现代农业科技,2012(6):341-342.
