酒用酯化酶利用酒尾生产酯化液研究
2021-06-06马美荣王小伟
张 坤,马美荣,王小伟
(北京红星股份有限公司,北京 101400)
酯化酶不是酶学上的术语,酶学上名为解脂酶,是脂肪酶、酯合成酶、酯分解酶及磷酸酯酶的统称。酯化酶的种类很多,但白酒生产中已应用的多为乙酸乙酯合成酶及己酸乙酯合成酶。合成乙酸乙酯的生香酵母分泌的酶为乙酸乙酯合成酶[1-3]。红曲霉、根霉、毛霉等产生的酯化酶多为己酸乙酯合成酶[4-7]。许多细菌也能产生酯化酶[8-11]。清香型白酒是以乙酸乙酯为主体香的白酒,采用酶工程技术生产富含乙酸乙酯的酯化液具有重要的研究价值。
酒用酯化酶是华南理工大学林影教授团队开发的一种酶制剂,该酶用于非水相中催化合成短链芳香酯,结果表明,该酶可催化C10以下的酸和醇直接酯化合成多种短链芳香酯[12],酸的转化率达到90 %以上,该团队也证实其在合成己二酸二异辛酯、香叶基丁酸、肉桂醇酯、萜烯醇芳香酯等酯类物质方面具有极强的催化能力[13-15]。该酶在黄水利用、丢糟发酵中得到了良好应用[16-17]。
酒尾是白酒蒸馏后期截取的酒精度较高的酒-水混合物。酒尾中含有大量酸味物质及高级脂肪酸酯类,因此酒尾用来调整酒的酸度及后味效果明显。但用量不可过大,超过20 %将影响低度酒的透明度,而且会给酒带来酒稍子味[18-19]。
酒尾中富含大量乙醇、酸味物质,如能通过酯化酶生产酯化液,对提高酒尾的附加值具有重要意义。
1 材料与方法
1.1 材料、试剂及仪器
耗材及试剂:酒用酯化酶,华南理工大学提供;酒尾,北京红星股份有限公司酿造车间提供;乙酸(AR),购自天津市风桥化学试剂科技有限公司。
仪器设备:气相色谱仪(HP6890),安捷伦公司;生化培养箱(LRH-250),上海一恒科学仪器有限公司;全自动密度仪(DMA5000M),安东帕公司。
1.2 试验方法
1.2.1 酒精度测定
采用密度法进行测定。
1.2.2 微量成分测定(气相色谱仪法)
色谱条件:DM-WX毛细管柱,柱温程序升温,检测器温度240 ℃,汽化室温度230 ℃。载气流速:氮气35 mL/min,氢气40 mL/min,空气400 mL/min。
1.2.3 酯化酶催化酒尾合成乙酸乙酯
200 mL酒尾中加入5 %的酯化酶,30 ℃酯化1 d、2 d、3 d,酯化液用气相色谱分析。
1.2.4 酯化酶催化酒尾、乙酸合成乙酸乙酯
192 mL酒尾中加入8 mL乙酸再加入5%的酯化酶,30 ℃酯化1 d、2 d、3 d,酯化液用气相色谱分析。
1.2.5 不同乙酸用量对酯化酶催化酒尾、乙酸合成乙酸乙酯的影响
分别按照1%、2%、3%、4%的乙酸比例配制酒尾、乙酸混合液,再加入5%的酯化酶,30 ℃酯化2 d、3 d,酯化液用气相色谱分析。
1.2.6 温度对酯化酶催化酒尾、乙酸合成乙酸乙酯的影响
194 mL酒尾中加入6 mL乙酸,加入5 %的酯化酶,分别在25 ℃、30 ℃、35 ℃酯化2 d,酯化液用气相色谱分析。
1.2.7 不同酯化酶用量对酯化酶催化酒尾、乙酸合成乙酸乙酯的影响
194 mL酒尾中加入6 mL乙酸,再分别加入1 %、2 %、3 %、4 %、5 %的酯化酶,30 ℃酯化2 d,酯化液用气相色谱分析。
1.2.8 酯化酶酶活稳定性
194 mL酒尾中加入6 mL乙酸,再加入3 %的酯化酶,30 ℃酯化2 d,酯化液分离后的酶继续加入同样比例的酒尾、乙酸,30 ℃酯化2 d。直至酯化液中乙酸乙酯含量大幅下降,停止实验。
2 结果与讨论
2.1 酒尾成分分析(表1)
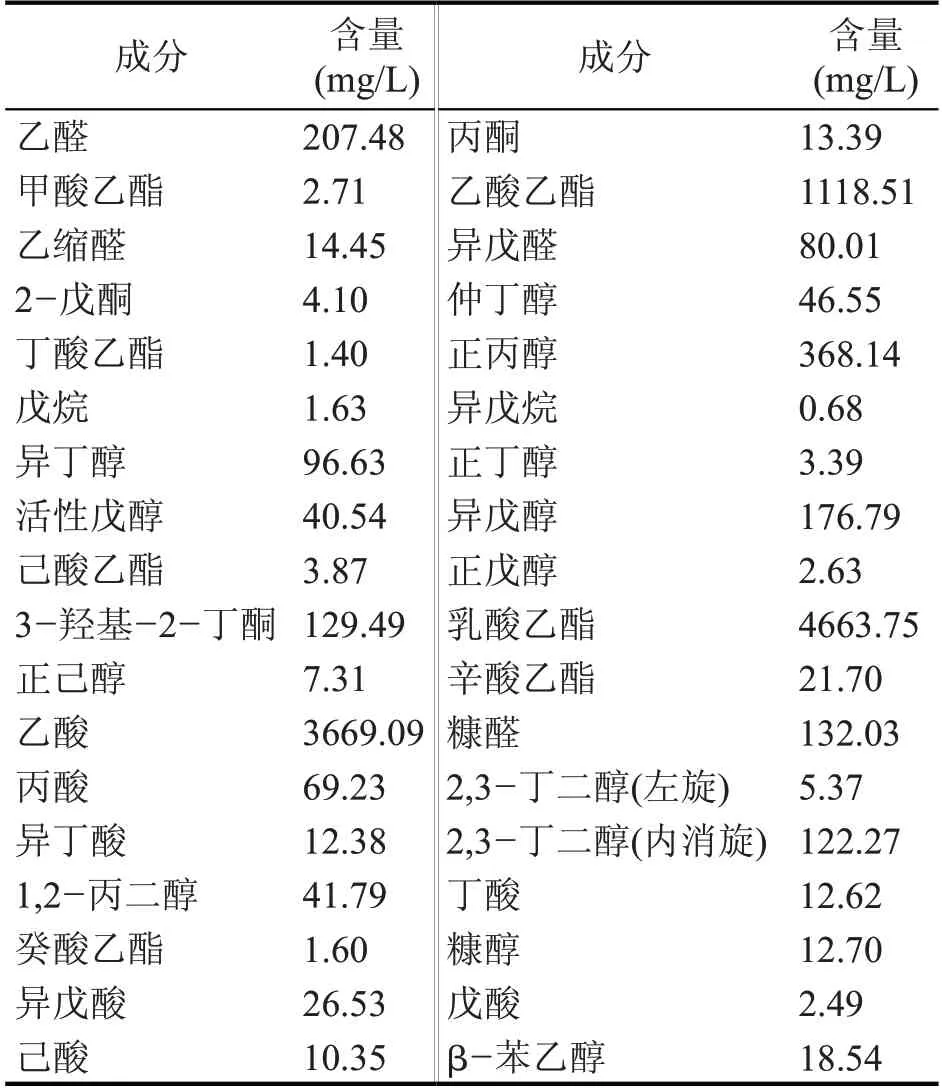
表1 酒尾成分分析
该酒尾的酒精度为26%vol,酒尾中除含有水、乙醇外,还含有种类众多的微量成分。在所检测条件下,在该酒尾中共检测到36种微量成分,其中醛类4种,酮类3种,酯类7种、醇类13种、酸类7种,烷类2种,乳酸乙酯的含量最高,为4663.75 mg/L,其次为乙酸、乙酸乙酯,含量分别为3669.09 mg/L、1118.51 mg/L,这3种物质的含量占总微量成分的84.83%。酒尾中含有较丰富的乙酸、乙醇,为酯化酶催化乙酸乙酯合成提供了一定的物质基础。
2.2 酯化酶利用酒尾合成乙酸乙酯
根据酶用量推荐量、酶作用的推荐温度,在酒尾中加入5 %酯化酶在30 ℃下酯化的结果见图1。由图1可见,在酒尾中加入酯化酶后,乙酸含量下降明显,乳酸乙酯下降幅度也大,但乙酸乙酯增加量不大,最高增加约0.36 g/L,与预期差别较大,可能是因为酒尾中成分比较复杂,酯化酶催化乙酸、乙醇合成乙酸乙酯的活性受到其他成分的影响。

图1 酯化酶利用酒尾合成乙酸乙酯
2.3 酯化酶利用酒尾、乙酸合成乙酸乙酯
酒尾直接加入酯化酶酯化效果一般,酒尾中乙醇含量应该是过量的,可能是由于乙酸含量不足导致酯化效果不佳。因此在酒尾中加入乙酸,探讨加入乙酸是否有利于酯化合成。加入乙酸后,由于反应体系中乙酸浓度过高,所采用的色谱条件不能准确反映酯化液中的乙酸含量,且本研究主要关注酯类物质变化,故此后实验不再对酯化液中的乙酸含量进行分析比较。从图2可看出,酒尾中加入乙酸再用酯化酶酯化乙酸、乙醇,酯化液中乙酸乙酯含量大幅增加。随着酯化时间增加,乙酸乙酯含量在第2天达到最高,第3天又下降,乳酸乙酯随着酯化时间增加,前两天下降幅度大。经比较酯化液中乙酸乙酯、乳酸乙酯含量,在本酯化条件下,酯化2 d比较合适。在本研究条件下,该酯化体系具有增加乙酸乙酯降低乳酸乙酯效果。

图2 酯化酶利用酒尾、乙酸合成乙酸乙酯
2.4 不同乙酸用量对酯化酶酯化酒尾的影响(表2)

表2 不同乙酸用量对酯化酶酯化酒尾的影响
采用不同的乙酸用量,比较2 d和3 d的酯化结果,都是随着反应时间增加,乙酸乙酯含量反而下降,乳酸乙酯含量也下降。从结果来看,采用本研究体系,酯化时间以2 d为宜。从反应2 d的结果来看,酯化反应体系中乙酸用量每增加约10 g/L,乙酸乙酯含量约增加3 g/L。结合实际生产需求,后续实验采用3%的乙酸用量。
2.5 温度对酯化酶酯化酒尾、乙酸的影响
温度既影响酶的催化反应速度,又影响酶的活性。参考资料[17],采用25 ℃、30 ℃、35 ℃考察温度对酯化反应的影响。从图3可以看出,从25 ℃到30 ℃,随着反应温度升高,乙酸乙酯、乳酸乙酯的含量增加,但从30 ℃到35 ℃,随着反应温度升高,乙酸乙酯、乳酸乙酯的含量降低,这说明高温并不利于酯化反应。根据实验结果,酯化温度确定为30 ℃。

图3 温度对酯化酶酯化酒尾、乙酸的影响
2.6 不同酯化酶用量对酯化酶酯化酒尾、乙酸的影响
在酒尾中加入3%乙酸后,通过添加不同量的酯化酶,考察酶用量对酯化的影响见图4。由图4可以看出,酶作为反应的主要限制性因素,酶添加量对乙酸乙酯的生成有很大的影响。随着酶添加量的增加,乙酸乙酯的含量先增加再趋于平稳,当酶用量超过3 %(W/V)时,乙酸乙酯的含量不增加,还略微下降,从数据来看,乳酸乙酯的含量随着酶用量的增加是逐步增加的,但增加幅度不大。考虑到清香型白酒的主体香为乙酸乙酯,结合酶的成本,后续实验采用3%的酶用量。本研究的酶用量研究结果不同于脂肪酶酯化白酒黄水的酶用量研究结果,这可能是与两者的化学组成差别大有关,且与黄水中含有各种微生物有关[20]。

图4 酯化酶用量对酯化酶酯化酒尾、乙酸的影响
2.7 酯化酶酶活性稳定性
为了提高酯化酶的使用效率,降低生产成本,进行了该酶酶活稳定性实验,结果见图5。由图5可见,前4批重复实验的酯化液乙酸乙酯含量基本保持稳定。第5批重复实验时,酯化液中乙酸乙酯含量大幅下降,比第1批实验降低了18.92 %。各批重复实验酯化液的乳酸乙酯含量差别不大。该酶在酒尾、乙酸酯化体系下,具有较好的酶活性稳定性。该酶能回收利用,将极大降低酶的使用量,降低生产成本。
3 结论
通过对酒尾微量成分分析,酒尾中含有较丰富的乙酸、乙醇,为采用酒用酯化酶催化乙酸乙酯合成提供了一定的物质基础。通过乙酸用量、温度、酶用量、酯化时间对反应影响研究,确定酯化酶酯化酒尾、乙酸的条件为:乙酸用量3%,温度30 ℃,酯化酶用量3%,酯化2 d。该酯化工艺作用温和,反应周期短,酯化液中乙酸乙酯含量高,具有一定的推广应用价值。
