红曲洛伐他汀发酵条件优化及降脂功能
2014-04-24赵秀举刘志国
赵秀举,刘志国
(武汉轻工大学 生物与制药工程学院,农产品加工湖北省协同创新中心,湖北 武汉 430023)
洛伐他汀(lavostatin)也称莫那可林K(Monacolin K,MK),可以有效降低冠心病和心肌梗塞的发病率和死亡率。洛伐他汀主要用土曲霉(Aspergillus terreus)和红曲霉(Monascus rubber)经深层发酵制取,红曲霉(Monascus rubber)不仅产生洛伐他汀,而且产生据推测为洛伐他汀生物合成的中间产物的聚酮类物质莫那可林J、L、X,具有很强的降低胆固醇、调节血脂的功能。功能红曲是红曲霉(Monascus)繁殖于大米等粮食作物上的制品,可药食兼用。含有丰富的酶系和多种生理活性物质如莫那可林K、麦角固醇、γ-氨基丁酸、天然植物激素等代谢产物,具有极高的营养、保健药用价值,是天然安全有效的保健食品、药品原料。在胆固醇的合成途径中,羟甲基戊二酰辅酶A(hydroxyl methyl glutaryl-coenzyme A,HMG-CoA)还原酶起限速性关键作用,而Monacolin类化合物(Monacolin J、K、L、M、X)是HMG-CoA还原酶的竞争性抑制剂,可以有效减少胆固醇的合成,其中Monacolin K的活性最为显著[1-5]。研究结果表明,功能红曲能有效降低体内总胆固醇以及甘油三酯、低密度脂蛋白水平,同时升高高密度脂蛋白水平,从而具有显著的降胆固醇及降血脂的作用;其中的Monacolin K多为酸式,其空间结构与体内羟甲基戊二酸辅酶A(HMG-CoA)还原酶更为接近,活性较内酯式高约一倍,无需水解直接发挥抑制体内胆固醇合成的作用[6-9]。
作为功能红曲的主要成分,优化Monacolin K的产量成为发酵过程的重要内容。同时,功能红曲中的其他成分,如红曲色素是否参与及如何参与降血脂的机理还不清楚。本研究从培养温度及持续时间入手,采用多变量分析的方法优化MK产量。同时利用细胞实验考察MK、功能红曲米的降脂效果及机理[10-15]。
1 材料与方法
1.1 材料与试剂
红曲(Monascus ruber):中国科学院微生物所;洛伐他汀标准品:美国Sigma公司;肝L02细胞:美国标准生物品收藏中心;早籼米:湖北武汉白沙洲农副产品大市场;醋酸、葡萄糖、酵母膏、MgSO4、NaNO3、琼脂:申试化工有限公司。
培养基:葡萄糖5%,酵母膏1%,MgSO40.1%,NaNO30.2%,pH 4~5,灭菌(123℃、30min)。
1.2 仪器与设备
HP1100高效液相色谱仪:美国Agilent公司;YPL-1回转式恒温调速药瓶柜、WJ恒温培养箱:上海新苗医疗器械公司;TDL-40B离心机、YP600电子天平:上海安亭仪器厂;JNOEC XS-212-201生物显微镜:南京江南永新光学有限公司;7500 PCR仪:美国Rockwell Allen-Bradley公司。
1.3 方法
1.3.1 红曲发酵产洛伐他汀工艺流程
原料(早籼米)预处理(蒸米102℃、3~5min,凉米至40~50℃)→菌种两级扩大培养(试管菌种→一级三角摇瓶菌种→二级三角摇瓶菌种)→接种(接种量20%)→高温培养(28~39℃,3~6d)→低温培养(17~25℃,10~18d)→烘干(60℃以下,水分≤6%)→包装
1.3.2 MK含量测定方法
发酵所得红曲米粉碎过60目筛后用甲醇萃取,采用高效液相色谱(high performance liquid chromatography,HPLC)法测定莫那可林K(MK)含量。
色谱条件:色谱柱Zorbax SBC18(250mm×4.6mm,5μm);流动相:乙腈/磷酸水体积分数为65∶35;柱温25℃;紫外检测波长238nm;流量1mL/min;进样量20μL;红曲米甲醇萃取液经0.45μm滤膜过滤后用HPLC进行测定[16]。
1.3.3 正交试验设计优化固态发酵条件
分别考察高温持续时间,低温持续时间,装料量对MK产量的影响。在单个因素试验基础上,以MK产量为考察指标,MK固态发酵条件优化正交试验设计因素与水平见表1。

表1 固态发酵条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for optimization of solid fermentation conditions
1.3.4 细胞培养
将人的肝L02细胞置于25cm2培养瓶中,并放入CO2培养箱中培养,当细胞生长至70%融合时,将细胞培养瓶中的培养基倒掉,加入1×磷酸盐缓冲液(phosphate buffer solution,PBS),润洗3次后倒掉PBS,加入1~2mL 0.25%胰酶,消化完毕后加入含有10%胎牛血清(fetal bovine serum,FBS)的改良杜氏伊格尔培养基(Dulbecco's modified eagle medium,DMEM)高糖培养基3mL,轻轻吹打细胞使其脱落,将细胞悬液置于离心管中,低速离心5min,弃上清液,加入含有10%FBS的DMEM高糖培养基3mL,重悬细胞。取出一半的细胞液转入新的细胞培养瓶中,之后分别向细胞培养瓶中添加饱和脂肪酸(saturated fatty acid,SFA)作为高脂模型及MK、功能红曲米(functionalMonascusrice,FR)等干预物,正常组仅补足培养基,加入的培养基和干预物的总体积为3mL,37℃、5%CO2恒温培养箱中培养。
1.3.5 引物设计及PCR扩增条件
cDNA 使用oligo-(dT)15 引物根据Invitrogen公司使用手册合成。PCR 引物使用Primer Premier 5.0 软件设计,持家基因beta-actin 作为内控基因。PCR扩增程序为:首先95℃持续15min,接着94℃持续5s、58℃持续15s、72℃持续10s共40个循环。mRNA 相对含量使用2-ΔΔCt方法计算。统计差异由参数方法one-way ANOVA multiple range test和非参数方法Mann-Whitney U test进行分析,统计差异按照P<0.05执行[15]。
2 结果与分析
2.1 高温温度及持续时间
高温发酵5d的条件下,温度对MK产量的影响见表2。由表2可知,35℃的高温是红曲发酵产MK的最适温度。
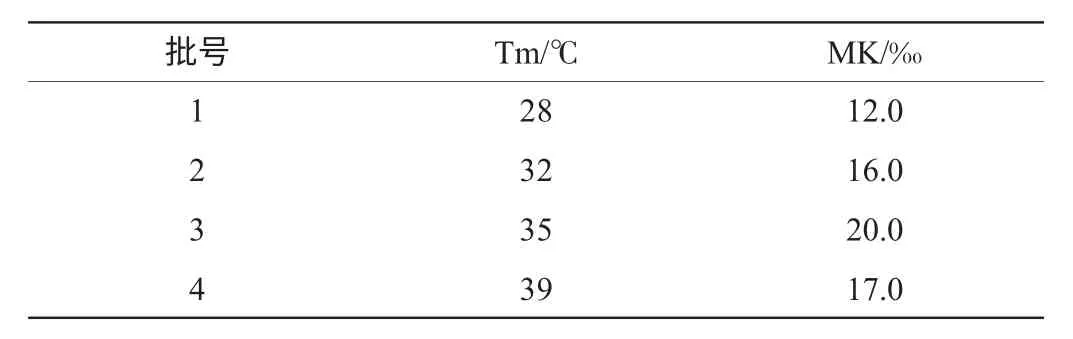
表2 高温温度对MK产量的影响Table 2 Effects of high temperature on MK yield
在35℃的高温条件下,持续时间对MK产量的影响见表3。由表3可知,5d的发酵时间MK产量最高。
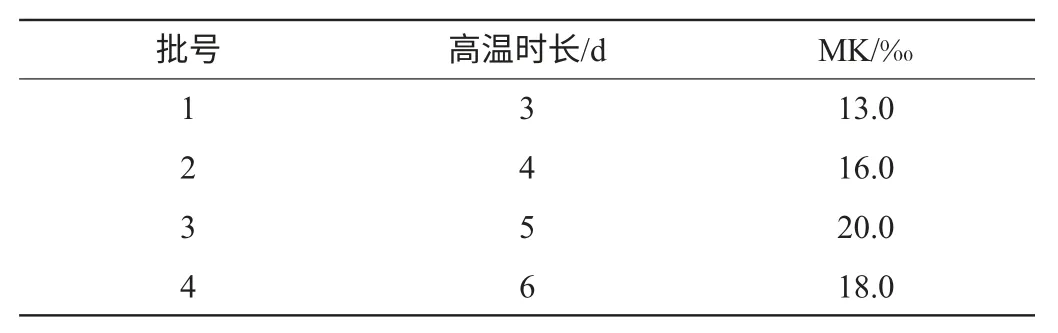
表3 高温时长对MK产量的影响Table 3 Effects of high temperature time on MK yield
2.2 低温温度及持续时间
低温发酵15d的条件条件下,温度对MK产量的影响见表4。由表4可知,22℃的低温是红曲发酵产MK的最适温度。

表4 低温温度对MK产量的影响Table 4 Effects of low temperature on MK yield
在22℃的低温下,持续时间对MK产量的影响见表5。由表5可知,18d的发酵时间MK产量最高20.8‰,但考虑到15d时的MK产量20‰与20.8‰相差甚微且减少3d的时间对于利用空间和减少能源消耗有利,所以选用15d的低温发酵时间。

表5 低温时长对MK产量的影响Table 5 Effects of low temperature time on MK yield
2.3 容器体积
在装料比均为36%的前提下,固体发酵容器体积对MK的影响见表6。由表6可知,1L三角瓶的MK产量最高。容器体积主要通过接触面积、传热等因素对MK生成量产生影响。
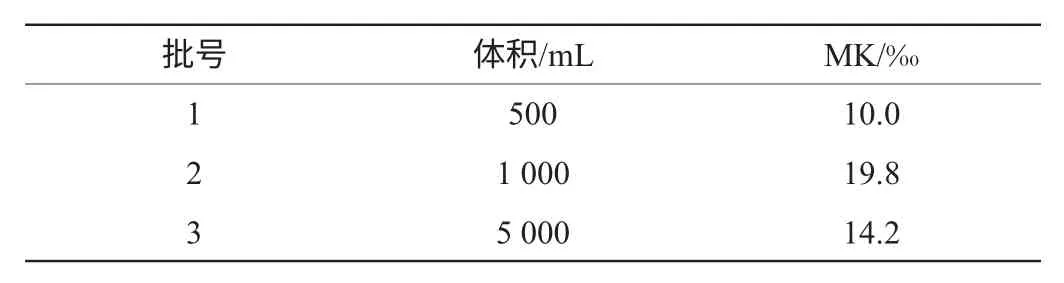
表6 发酵容器体积对MK产量影响Table 6 Effects of the volume of fermentation container on MK yield
2.4 装料量
在1L发酵体积的前提下,装料量对MK产量影响见表7。由表7可知,36%的装料量MK生成量最高。

表7 装料量对MK产量影响Table 7 Effects of the loading volume on MK yield
2.5 固态发酵条件优化正交试验结果
高低温持续时间及装料量之间可能存在交互作用;在高温35℃、低温22℃的条件下,综合考虑高温温度持续时间,低温温度持续时间,装料量等因素的影响,以MK产量为考察指标,正交试验结果与分析见表8。
由表8结果表明,影响MK产量的因素顺序为C>A>B,即装料量对MK产量的影响最大,高温发酵时长最小。A2B2C2为最优水平组合,即高温发酵5d,高温发酵15d,装料量360g/L。在该最佳条件下进行验证试验,MK产量为24‰。

表8 固态发酵条件优化正交试验结果与分析Table 8 Results and analysis of orthogonal experiments for optimization of solid fermentation conditions
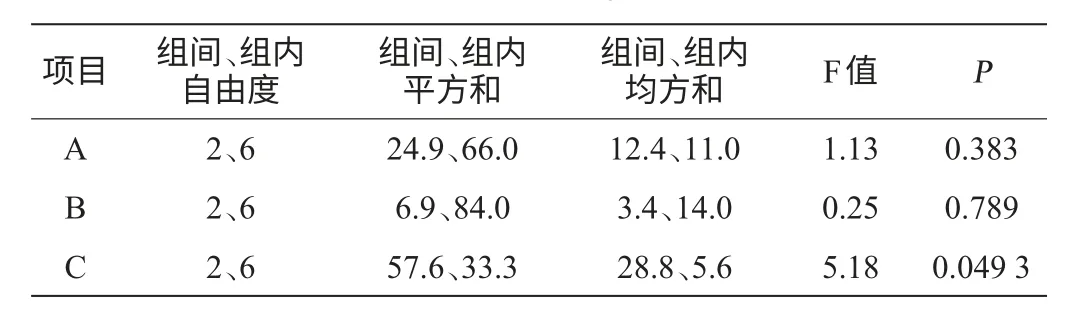
表9 正交试验结果方差分析Table 9 Variance analysis of orthogonal experiments results
由表9可知,在0.05的显著性水平下,装料量对MK产量结果影响显著(P<0.05),其他两个因素对MK产量结果影响均不显著。
2.6 基因表达
进行定量PCR(qPCR)测定所用引物见表10。ATF4、CHOP分别为活化转录因子4、CCAAT/增强子结合蛋白同源蛋白,属于内质网应激通路。

表10 引物序列Table 10 Primers sequences
MK、功能红曲米(FR)等干预物对肝L02细胞的基因表达的影响见图1。由图1可知,MK和功能红曲米(FR)均具有明显的降脂效果,且功能红曲略优于MK(P<0.05)。

图1 基因定量PCR表达变化Fig.1 Expression levels of gene quantification PCR
3 结论
通过正交试验设计,实现了功能红曲固态发酵产MK工艺条件优化:高温35℃持续5d,低温22℃持续15d,装料量360g/L;同时初步探讨了MK降脂作用,发现功能红曲与MK通过缓解内质网应激起降脂作用。
[1]周立平.红曲霉在中国的生产及其应用(上)[J].中国酿造,2004,23(9):1-4.
[2]周立平.红曲霉在中国的生产及其应用(下)[J].中国酿造,2004,23(10):5-7.
[3]朱 华,许赣荣,陈 蕴,等.HPLC 法测定红曲中酸型与内酯型Monacolin K[J].无锡轻工大学学报,2003,22(3):46-52.
[4]文 镜,常 平.RP-HPLC-PDA 检测器测定功能红曲中Monacolin化合物含量[J].中国酿造,2009,28(4):140-143.
[5]赵 玖,周立平,嘉晓勤,等.红曲菌Monacolin K 合成基因的研究进展[J].中国酿造,2010,29(4):5-8.
[6]雷 萍,金宗濂.红曲中生物活性物质研究进展[J].食品工业科技,2003,24(9):86-89.
[7]傅剑云,夏 勇,孟 佳,等.红曲对实验性高脂血症大鼠体重及血脂水平的影响[J].中国临床康复,2002,6(1):57-59.
[8]张建峰,昌友权,陈 光,等.红曲多糖的免疫活性研究[J].食品科学,2008,29(2):391-393.
[9]陈运中,陈春艳,张声华,等.红曲有效成分洛伐他汀对高脂小鼠血脂代谢及脂蛋白脂酶mRNA 表达的作用[J].中草药,2005,36(5):713-717.
[10]李炳江,李 琴.红曲生产工艺探索[J].中国酿造,2002(S1):39-40.
[11]陈运中.功能性红曲色素发酵工艺研究[J].食品科学,2003,24(7):83-87.
[12]张馨如,郑建全,魏 嵘,等.红曲中降压活性物质的提取工艺研究[J].食品科学,2005,26(4):190-192.
[13]姚继承,赵秀举.红曲色素的研究和应用新进展[C].//中国食品添加剂生产应用工业协会着色剂专业委员会2007 年年会论文汇编.2007:1-7.
[14]赵秀举.基于代谢组学及转录组学的乙酰甲喹毒作用研究[D].武汉:中国科学院研究生院(武汉物理与数学研究所)博士论文,2011.
[15]ZHAO X J,HAO F H,HUANG C Y,et al.Systems responses of rats to mequindox revealed by metabolic and transcriptomic profiling[J].J Proteome Res,2012,11(9):4712-4721.
[16]全国食品工业标准化委员会.QB/T 2847—2007 功能性红曲米(粉)[S].北京:中国标准出版社,2007.
