红曲菌转化子性状分析及分子验证*
2012-12-17蔡琪敏庄静娜魏银文吴寒华崔宇辉曹丽凌蒋冬花
蔡琪敏, 庄静娜, 魏银文, 吴寒华,崔宇辉, 曹丽凌, 蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华 321004)
红曲菌在我国已经有上千年的应用历史,是我国宝贵的科学文化遗产[1].现代研究表明,红曲具有降血脂、降血压、抗氧化、抗癌、抗菌、抗疲劳等多重功效[2].红曲菌能产生 Monacolins类、γ-氨基丁酸(GABA)、麦角固醇、色素、淀粉酶等多种生理活性物质[3],在食品、酿酒、制醋、中药等方面都有着广泛的用途[4].从医学角度看,红曲菌中含有许多值得研究的基因.但迄今为止,对红曲菌的研究主要集中在菌种分类与选育、发酵条件研究、桔霉素检测等方面,关于其分子生物学方面的研究才刚刚起步,只在红曲菌分类、DNA文库构建、遗传转化体系建立、Monacolin K和桔霉素代谢调控途径相关基因的研究等方面取得了一定的进展[5-9],对红曲菌的遗传背景知识了解很少,对红曲菌的形态分化、发育及次生代谢相关基因信息的报道也很少.
本实验以根癌农杆菌介导的红曲菌突变体库中538株转化子菌株为材料,通过菌落形态观察并结合显微特征分析,筛选转化子,进行分子验证和稳定性检测,并检测了红曲菌中的主要代谢产物红曲色素和γ-氨基丁酸(GABA),以期为今后研究红曲菌代谢产物的合成调控机理奠定基础.
1 材料与方法
1.1 实验材料
出发菌株:紫色红曲菌(Monascus purpureus)S菌株,由本实验室筛选并保藏;
突变菌株:538株转化子菌株来自本实验室构建的红曲菌T-DNA插入突变库,由本实验室保藏.
1.2 突变体库的构建
采用实验室建立的根癌农杆菌介导红曲菌的高效转化体系构建突变体库:红曲菌在PDA培养基上培养21 d后收集孢子,制备红曲菌孢子悬浮液,孢子浓度为106个/mL,根癌农杆菌溶液的A600为0.5,诱导剂乙酰丁香酮(AS)的浓度为100 μmol/L,农杆菌与红曲菌在25℃共培养3 d.
1.3 转化子的筛选
将转化子活化后转接到PDA培养基上,30℃培养7~14 d,与出发菌株S比较,根据菌落形态、大小、颜色和生长速度等特征,挑选变异明显的转化子,拍照,保存备用.
1.4 转化子遗传稳定性的分析
将随机挑选的20株红曲菌转化子用无菌牙签挑取菌丝接种到不含潮霉素的PDA培养基上,30℃培养7 d.连续转接6次后,再转接到含潮霉素的PDA培养基上,同时接种出发菌株S作为对照,30℃培养,观察转化子的生长情况和菌落形态,并计算其稳定性.计算公式为:转化子稳定性

1.5 转化子的PCR鉴定
1.5.1 转化子基因组DNA的提取
将转化子菌株接种于PDA培养基上活化,按2%的接种量接入装有40 mL PDA培养基的250 mL锥形瓶中,30℃,200 r/min振荡培养3 d.过滤收集菌丝体,洗涤,用滤纸及吸水纸尽量吸干水分.取适量菌丝样品于研钵中,加液氮快速研磨成粉末.采用十六烷基三甲基溴化铵(CTAB)法提取基因组 DNA[10].
1.5.2 聚合酶链式反应(PCR)
根据pATMT1上的潮霉素基因序列设计一对引物HygS1和HygA1,序列为:5'-ATGCCTGAACT CACCGCGAC-3',5'-CTATTCCTTTGCCCTCGGAC-3',50 μL 体系中进行 PCR 扩增.PCR 程序为94℃ 3 min后进入循环:94℃ 20 s,58℃ 60 s,72℃ 2 min,共35个循环,然后72℃延伸10 min.电泳检测,拍照记录.
1.6 转化子菌落与显微形态的观察
将活化后的转化子接种到PDA培养基上,30℃培养7~14 d,观察菌落形态特征.根据文献[11]的方法对供试菌株进行观察和描述.
用接种环挑取转化子的菌丝,制成玻片,在显微镜下观察转化子的显微特征.
1.7 转化子红曲色素的分析
将转化子菌株接种于PDA培养基上活化,按2%接种量接入培养基中,30℃,200 r/min振荡培养7 d.取培养液加95%乙醇溶液,4℃,8 000 r/min离心15 min,取上清液,稀释,以相同处理(加95%乙醇溶液)的不接入红曲菌的培养液为空白对照,测定300~600 nm波长下的吸光度,分析吸收峰值.色价(U/mL)=稀释倍数×吸光度.
1.8 转化子γ-氨基丁酸(GABA)产量的研究
将转化子菌株接种于PDA培养基上活化,按2%接种量接入培养基中,30℃,200 r/min振荡培养48 h.采用改良纸色谱法[12],测定520 nm处的吸光度,与标准曲线对比,计算 γ-氨基丁酸(GABA)的产量.
2 结果与分析
2.1 突变体库的构建
采用实验室建立的根癌农杆菌介导红曲菌的高效转化体系构建突变体库,共获得538株转化子.
2.2 转化子的遗传稳定性
将538株转化子接种到PDA培养基上,随机挑选20株突变株进行稳定性研究.结果显示,连续转接6次后,对照菌株不能生长,而20株转化子菌株均能在含有100 μg/mL潮霉素的PDA培养基上正常生长,其遗传稳定性高达100%,比文献[8]中的高,表明潮霉素抗性基因已经整合到红曲菌基因组中并能稳定遗传.
2.3 转化子的PCR鉴定
如果根癌农杆菌Ti质粒中的T-DNA成功转移到紫色红曲菌基因组DNA中,1 106 bp就能扩增出潮霉素基因特征条带,据此可以鉴定T-DNA是否成功插入到红曲菌基因组中.
随机选取9株具有代表性的转化子菌株进行PCR鉴定,并与出发菌株S比较,结果见图1.这9株供试菌株在1 000 bp左右均有条带,且条带清晰、无杂带,说明T-DNA已经插入到紫色红曲菌基因组DNA中.
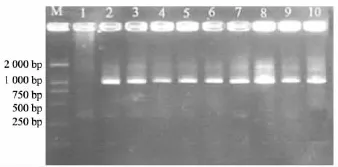
图1 红曲菌转化子的PCR鉴定
2.4 转化子的形态
2.4.1 菌落形态
将538株转化子接种到PDA培养基上,30℃培养7 d,比较转化子菌株与出发菌株S在菌落形态、颜色等方面的差异.结果表明,大部分转化子与出发菌株差别不大,只有少数转化子发生了较大变化.选取有代表性的9株转化子菌株与出发菌株一起观察,其菌落特征见表1和图2.
2.4.2 显微形态
将9株转化子菌株与出发菌株S在PDA培养基上培养7 d,挑取菌丝制成玻片,在显微镜下观察形态特征.结果如图3所示:出发菌株S的菌丝呈透明胶管状,隔膜清晰,分生孢子与子囊孢子均较多;转化子S25的菌丝透明且细小,隔膜不明显,孢子很少;转化子S18,S29和S30的菌丝中色素颗粒均较多,呈现红色,不透明,但S29的孢子很少,S30的隔膜清晰,S18与S29的隔膜不清晰;转化子S32和S36的菌丝纤细透明,分生孢子较多,但S36的菌丝形状不规则,旁枝很多;转化子S34的菌丝干净透明,隔膜明显;转化子S41和S55的菌丝中内容物均较多,前者菌丝中多为色素颗粒,后者菌丝中其他内容物居多,且前者的菌丝变异较多.

表1 9株代表性转化子菌株的菌落形态
2.5 转化子红曲色素的变化

图3 9株代表性菌株的显微形态结构
将红曲菌菌株的乙醇浸提液适当稀释后,于300~600 nm波长下测定吸光度,每个转化子菌株设置3个重复.由表2可见,红曲菌转化子的红曲色素不仅色价发生了变化,而且吸收波长也发生了不同程度的变化.如:出发菌株S的吸收峰Ⅰ和吸收峰Ⅱ分别为415和495;而色价明显下降的S18的吸收峰Ⅰ变为390,吸收峰Ⅱ没变.原因可能是转化子的色素代谢途径发生了某些变化,使色素的组成发生了改变,这对色素相关基因的研究有重要意义.
2.6 转化子γ-氨基丁酸(GABA)产量的变化
转化子菌株与出发菌株中GABA含量的纸色谱见图4.图4显色明显,拖尾现象与背景干扰等情况较少.由图4可以清楚地看出转化子菌株在GABA含量上的差异,在同样是5 μL上样量的情况下,转化子菌株 S18,S25,S30,S32,S36,S41和S55的GABA含量与出发菌株S相比有明显的升高,S18和S32更是达到1 g/L以上.
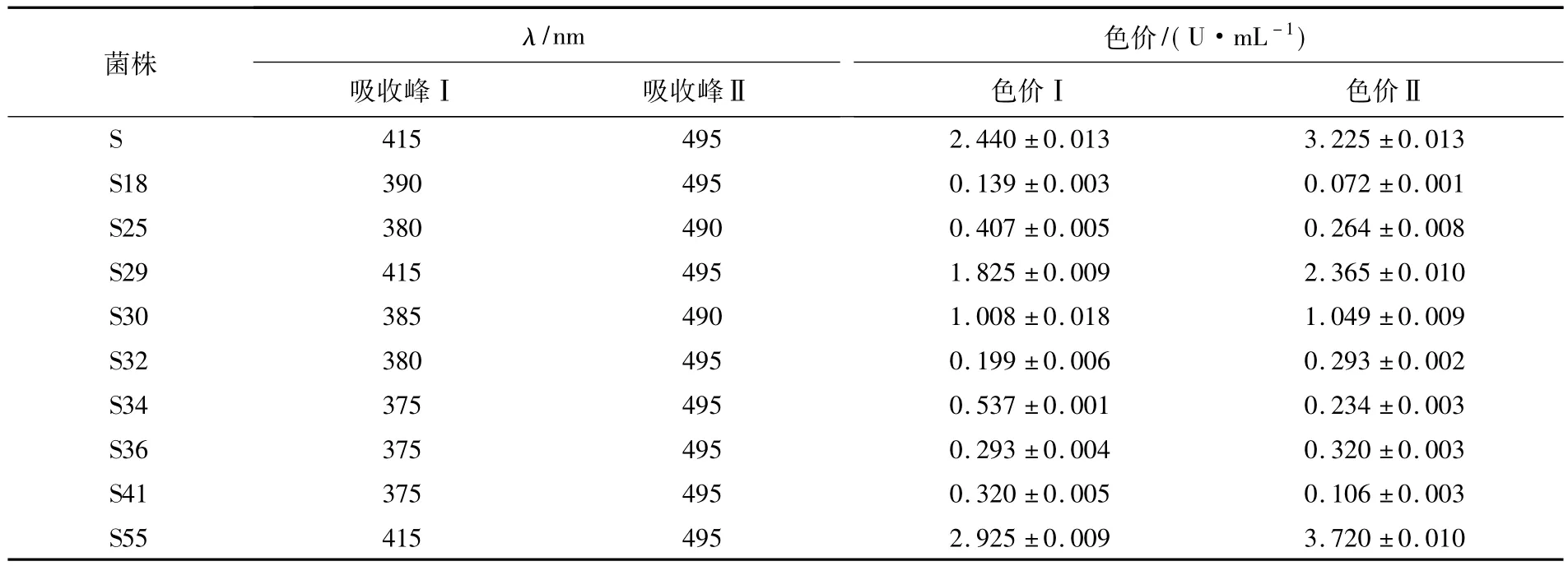
表2 9株代表性转化子红曲色素的变化

图4 9株代表性转化子培养液中GABA的纸色谱分析结果
9株转化子与出发菌株S的GABA含量的分析结果见表3.

表3 9株代表性转化子培养液中GABA含量的变化
3 讨论
T-DNA插入到红曲菌基因组之后,会影响某些基因的表达,从而引起突变,这些变化将会表现在各个方面,形态突变是比较直观的方面,而菌落形态等的直观变化又常常和其他的重要改变,如次级代谢产物的变化相关联[13].
本实验研究发现,与出发菌株相比,转化子菌落形态发生的变异主要表现在以下几个方面:菌落大小、菌落颜色、气生菌丝形态、菌体产孢子能力、菌落发生隆起突变、出现辐射纹或裂纹等.
微生物的次级代谢是指在一定的生长时期(通常在后期),以初级代谢物质为前体,合成一些对微生物的生命活动无明确功能的物质的过程.次级代谢产物的合成与相关酶催化的代谢途径有关,它们多数是菌株所特有的性质[14].红曲菌在生长过程中能产生多种次级代谢产物.尽管有学者对红曲菌部分代谢产物做了研究,如法国的Hajjaj等的研究表明红曲菌产桔霉素与红曲色素的代谢途径的起点相同[15],但是红曲菌的各种次级代谢过程及代谢途径尚不清楚.
本实验从538株转化子中挑选了9株代表性菌株,主要对9株转化子菌株与出发菌株的红曲色素与γ-氨基丁酸(GABA)的分泌能力进行了分析研究,结果表明转化子不同代谢产物的分泌能力均发生了不同程度的变化,推测可能是T-DNA插入红曲菌基因组阻断了不同的调控途径或代谢途径所致.
[1]傅金泉.中国红曲及其实用技术[M].北京:中国轻工业出版社,1997:1-3.
[2]周礼红,王正祥,诸葛健.红曲菌不同转化方法的比较[J].遗传,2006,28(4):479-485.
[3]张徐兰,吴天祥,李鹏.红曲霉有效成分应用研究进展[J].酿酒科技,2006(9):78-81.
[4]戴伟,李立,刘海波,等.红曲调节血脂作用的研究[J].上海预防医学杂志,2003,15(8):174.
[5]邢旺兴,苏国同,王晓明.关于红曲霉分类地位的认识[J].解放军药学学报,2004,20(2):119-121.
[6]叶砚,蒋冬花,嵇豪.响应面法优化红曲霉X27液态发酵产γ-氨基丁酸工艺条件[J].中国粮油学报,2010(9):106-110.
[7]李燕萍,许杨,阮琼芳,等.红曲菌Fosmid文库的构建与分析[J].北京师范大学学报:自然科学版,2008,44(2):188-192.
[8]王汝毅.根癌农杆菌介导红曲霉转化库的构建及转化子性质研究[D].武汉:华中农业大学食品科技学院,2005.
[9]赵玖,周立平,嘉晓琴.红曲菌Monacolin K合成基因的研究进展[J].中国酿造,2010(4):5-8.
[10]Stevens R.Mycology Guidebook[M].Seatle:University of Washington Press,1974.
[11]李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003.
[12]蒋冬花,后家衡,李杰,等.红腐乳中高产γ-氨基丁酸红曲菌菌株的筛选[J].浙江师范大学学报:自然科学版,2007,30(4):447-452.
[13]Wang Lu,Wang Wu,Xu Ganrong.Promotion of Monacolin K production by Agrobacterium tumefaciens-mediated transformation in Monascus albidus 9901[J].Curr Microbiol,2011,62(2):501-507.
[14]沈萍,陈向东.微生物学[M].北京:高等教育出版社,2006.
[15]季宏飞.红色红曲菌pksCT基因缺失株的构建及其固液态发酵生产红曲色素的研究[D].江西:南昌大学中德联合研究院,2009.
