血红蛋白在戊二醛膜修饰金电极上的直接电化学行为及其与氨茶碱的相互作用*
2012-12-17闵文傲王卫平袁军华陈建荣
闵文傲, 王卫平, 袁军华, 陈建荣
(浙江师范大学化学与生命科学学院,浙江金华 321004)
血红蛋白(Hb,hemoglobin)是血液中运输氧气的主要物质,因其结构确定、分布广泛,一直是研究血红素类蛋白质直接电化学及生物传感和电催化的理想模型.Hb直接电化学的研究会遇到电活性中心难以暴露、电子传输缓慢等难题,目前常用蛋白质膜技术形成适宜的蛋白-电极界面以加强Hb的电子转移,如:Hb-生物模拟膜界面[1-4]、Hb-纳米粒子界面[5-7]、Hb-聚合物膜界面[8]等,这些界面不仅能为Hb提供一个类似于其生物膜的微环境,保持其自然结构和生物活性,而且能阻止杂质及Hb变性吸附引起的电极钝化,加速Hb与电极之间直接、可逆的电子交换反应.文献[9]用鸡蛋卵磷脂包埋固定Hb于玻碳电极表面,在形成的界面上可以得到Hb可逆的氧化还原峰.
戊二醛(GA,glutaraldehyde)是一种理想的交联试剂,可以与Hb的多种氨基酸残基发生非特异性反应,使Hb形成聚合物,但不影响Hb的生物活性.文献[10]用GA作交联剂,将Hb偶联到热解石墨电极表面.GA不仅增强了Hb的刚性结构,保持了蛋白质的自身特性,而且当其吸附在电极表面时又避免了Hb的变性,因此可容易地实现电极上的直接电子转移.文献[11]将GA交联的辣根过氧化物酶纳米粒子直接固定在金电极表面,促进了辣根过氧化物酶在金电极上的电子转移.文献[12]用GA作为手臂分子偶联的方法将氨基酸修饰到金电极上,并以该修饰电极为工作电极,利用方波伏安法对痕量铜离子进行了检测.
氨茶碱是广谱的平喘药物,可松弛支气管平滑肌,也能松弛肠道、胆道等多种平滑肌,对支气管粘膜的充血、水肿有缓解作用[13].但因其安全性范围较小,常需进行临床药物监测.已报道的研究氨茶碱与蛋白质相互作用的方法有荧光光谱法[14]和高效液相色谱(HPLC)法[15].
本文通过GA将Hb修饰到金电极上,利用循环伏安法研究了该修饰电极在磷酸盐缓冲溶液中的电化学行为;并利用制备的Hb/GA膜修饰电极,研究了Hb与氨茶碱之间的相互作用,构建了氨茶碱的电化学传感器.
1 实验部分
1.1 仪器与试剂
CHI 832B型电化学工作站(上海辰华仪器公司),使用标准三电极体系:Ag/AgCl为参比电极,铂丝电极为辅助电极,金电极(或修饰金电极)为工作电极;pHS-3CT精密pH计(上海智光仪器仪表有限公司);SB-5200 DTD超声波清洗机(宁波新芝生物科技股份有限公司).
血红蛋白(Hb,上海博蕴生物科技有限公司);戊二醛(GA,上海化学试剂采购供应五联化工厂);氨茶碱(AMP,Sigma公司).其他试剂均为分析纯,实验用水为二次蒸馏水.
1.2 修饰电极的制备
将金电极在涂有Al2O3悬浊液的麂皮上抛光至镜面,依次用水和1∶1乙醇溶液超声清洗20 s左右,然后置于1 mol/L H2SO4溶液中进行循环伏安(CV)扫描直至稳定.
把经过预处理的金电极置于 5.0×10-5mol/L Hb溶液中,于1.5~2.0 V 电沉积90 min,使Hb充分吸附在电极表面,自然干燥后加1~2滴GA,室温下使溶剂挥发形成修饰膜,即可得Hb/GA膜修饰金电极.
1.3 实验方法
以Hb/GA膜修饰金电极或裸金电极为工作电极,Ag/AgCl为参比电极,铂丝电极为辅助电极,以 0.1 mol/L磷酸盐缓冲溶液(PBS,pH 6.00)为支持电解质,在一定电位范围内进行循环伏安(CV)实验,记录相应的CV曲线.每次使用后将电极用水冲洗干净.所有实验均在室温下进行.
2 结果与讨论
2.1 Hb在修饰电极上的电化学行为
分别将裸金电极(Au)、GA膜修饰金电极(GA/Au)和Hb/GA膜修饰金电极(Hb/GA/Au)置于PBS(pH 6.00)中进行CV扫描,结果见图1.由图1可知,裸金电极、GA膜修饰金电极没有氧化还原峰(见图1中b,c),Hb/GA膜修饰金电极有一对很好的氧化还原峰(见图1中a),可逆性也明显改善,说明Hb能够渗透进入GA膜中与其发生某种作用而具备了发生直接电化学反应的特定取向.在100 mV/s扫描速度下,其氧化峰电位Ep,a和还原峰电位 Ep,c分别为 0.341 V 和 0.297 V,峰电位差ΔE为44 mV,氧化还原峰电流之比Ip,a/Ip,c=1.17,说明 Hb 在 GA 膜修饰电极上的氧化还原过程是可逆过程,GA膜对Hb的吸附固定和在电极上的直接电子转移起到了重要的作用.
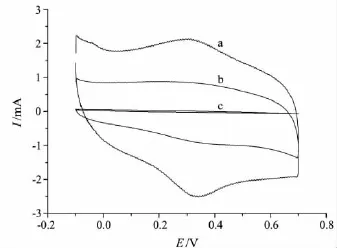
图1 不同电极的循环伏安图
2.2 底液及pH的选择
用循环伏安法考察了不同的支持电解质(Britton-Robinson(B-R),HAc-NaAc,Tris-HCl和磷酸盐缓冲溶液)对Hb在修饰电极上电化学行为的影响.从图2可以看出,Hb在0.1 mol/L磷酸盐缓冲溶液中的峰形好、峰电流高,有最好的电流响应.Hb在修饰电极上的电化学行为随磷酸盐缓冲溶液pH值的变化情况见图3.从图3可以看出:当溶液pH值为4.00~6.00时,氧化峰电流随pH值的增大而增大,表明Hb的电子转移强度逐渐增大;pH值为6.00~8.00时,氧化峰电流随pH值的增大而下降,表明Hb电子转移强度逐渐减小.这主要是因为Hb的活性依赖于溶液pH(正常人体生理pH为6.0~8.5),过低或过高的pH都会降低Hb的活性.此外,随pH值的变化,Hb的氧化峰电位变化不大.因此,考虑到Hb的生物特性,选用pH 6.00的0.1 mol/L磷酸盐缓冲溶液作为测试底液.

图2 Hb在不同缓冲溶液中的循环伏安图
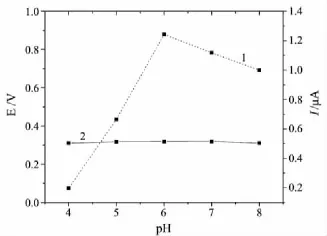
图3 pH对Hb在修饰电极上电化学行为的影响
2.3 扫描速率的影响
考察了不同扫描速率(0.2~1.0 V/s)下Hb/GA/Au电极的循环伏安行为,结果见图4.从图4可以看出,Hb/GA/Au电极的CV图具有近似对称的峰形和几乎等高的阴极峰和阳极峰,且随着扫描速率的增大,阳极峰电位正移,阴极峰电位负移.阳极峰电流与扫描速率成正比(见图5,其线性关系为:峰电流 Ip=85.609v+1.610 7,相关系数R=0.999 4).说明Hb的电极反应是受表面控制的过程.
2.4 电沉积时间的影响

图4 不同扫描速率下Hb/GA/Au电极的CV图

图5 Hb修饰电极峰电流与扫描速率间的关系
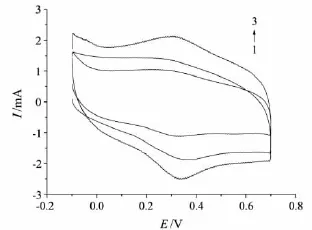
图6 不同电沉积时间下Hb修饰电极的CV图
本实验采用包埋法固定Hb分子到金电极表面得到Hb/GA/Au修饰电极,考察了电沉积时间分别为30,60,90 min时对修饰电极灵敏度的影响.由图6可见:若电沉积时间过短,则没有明显的峰电流,随着电沉积时间的增长,峰电流逐渐增大;但当电沉积时间过长(>90 min)时,峰电流也随之减小,且阳极峰电位向正方向移动.这可能是因为:当电沉积时间过短时,Hb分子还未聚合到电极表面就进行包埋;随着电沉积时间的增长,Hb固载量增加,峰电流逐渐增大;但当电沉积时间过长时,由于包埋Hb的环境发生改变,电极表面物质的分布趋于复杂,Hb在电极表面过量吸附,降低了电子的传递能力,且造成了电极响应电流下降的趋势.因此,选择电沉积时间为90 min.
2.5 修饰电极的稳定性
将Hb/GA/Au修饰电极在相同条件下反复进行CV扫描11次,测定阳极电流的变化趋势,根据所得数据求出其相对标准偏差为0.06%.将此修饰电极置于0.1 mol/L PBS(pH 6.00)中放入4℃冰箱保存,每天进行CV扫描,3 d后电流下降了约10%,表明此电极有良好的稳定性.
2.6 氨茶碱与Hb的相互作用
文献[16-17]报道电活性小分子结合生物大分子后会形成一种非电活性的配合物,不能在电极表面发生氧化还原反应,从而降低了Hb的平衡浓度,使Hb的氧化还原电流降低.本实验用CV法研究氨茶碱与Hb之间相互作用的结果表明,随着所加入氨茶碱浓度的增大,Hb的氧化还原电流呈下降趋势,当氨茶碱的浓度达到一定程度时,电流下降程度趋于平缓,说明此时Hb与氨茶碱之间的结合基本达到饱和.因此,可以认为氨茶碱与Hb形成了一种非电活性超分子化合物.
对于Hb与氨茶碱(AMP)形成的非电活性超分子化合物,可结合文献[18-19]求算出两者相互作用的结合数m.假设两者生成简单的化合物Hb-mAMP,方程式
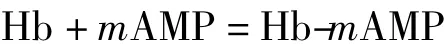
的平衡常数为
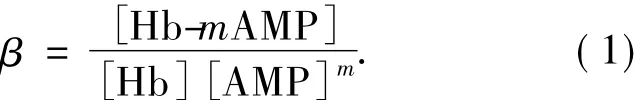
由此,可得到以下关系式:

从而,可以推出


图7 lg(ΔI/ΔImax-ΔI)与 lg[AMP]的关系
式(6)中:ΔI为有无氨茶碱的峰电流之差;ΔImax是电流变化的最大值.如果Hb与AMP形成单一的化合物,则 lg(ΔI/ΔImax- ΔI)与 lg[AMP]应呈线性关系,斜率m即为结合数.以lg(ΔI/ΔImax-ΔI)为纵坐标,lg[AMP]为横坐标,进行线性拟合(见图7),可得到拟合方程:y=0.034 9x -0.124 1,相关系数R=0.987 9,计算得结合数m=2.
3 结论
以GA作为偶联剂将Hb固定于金电极表面,制得了Hb/GA膜修饰金电极,GA膜的存在加快了Hb与金电极间的电子转移.结果表明,Hb在GA膜修饰金电极上的电子转移过程是一个受吸附控制的氧化还原过程.利用此修饰电极,用CV法研究了Hb和平喘药物氨茶碱之间的相互作用,求得Hb和氨茶碱的结合数为2.
[1]Lu Qing,Hu Chengguo,Cui Ran,et al.Direct electron transfer of hemoglobin founded on electron tunneling of CTAB monolayer[J].J Phys Chem B,2007,111(33):9808-9813.
[2]Yin Fan,Shin H K,Kwon Y S.Direct electrochemistry of hemoglobin immobilized on gold electrode by Langmuir-Blodgett technique[J].Biosens Bioelectron,2005,21(1):21-29.
[3]Xu Yanxia,Hu Chengguo,Hu Shengshui.Single-chain surfactant monolayer on carbon paste electrode and its application for the studies on the direct electron transfer of hemoglobin[J].Bioelectrochemistry,2009,74(2):254-259.
[4]后雯璟,周琳,吴霞琴,等.血红蛋白在类生物膜修饰电极上的直接电化学[J].电化学,2008,14(3):258-262.
[5]武五爱,郭满栋,尹志芬,等.血红蛋白在纳米孔径氧化铝膜修饰电极上的直接电化学[J].化学学报,2009,67(8):781-785.
[6]张敏,程发良,蔡志泉,等.血红蛋白在纳米金修饰电极上的电化学研究[J].化学研究与应用,2008,20(7):872-875.
[7]罗晓虹,妮娜,刘凯,等.血红蛋白在壳聚糖修饰碳纳米管上的电化学特性及对过氧化氢的电催化分析[J].分析测试学报,2009,28(7):809-813.
[8]李业梅,刘传银,刘慧宏.甲基纤维素膜固载血红蛋白的直接电化学[J].河北师范大学学报:自然科学版,2005,29(3):277-280.
[9]Han Xiaojun,Huang Weimin,Jia Jianbo,et al.Direct electrochemistry of hemoglobin in egg-phosphatidylcholine films and its catalysis to H2O2[J].Biosensors & Bioelectronics,2002,17(9):741-746.
[10]Wang Jing,Liang Zhiqiang,Wang Lihua,et al.Electron transfer reactivity and catalytic activity of structurally rigidized hemoglobin[J].Sensors and Actuators B:Chemical,2007,125(1):17-21.
[11]Liu Guodong,Lin Yuehe,Ostatna V,et al.Enzyme nanoparticles-based electronic biosensor[J].Chem Commun,2005(27):3481-3483.
[12]李昌安,葛存旺,刘战辉,等.戊二醛偶联组氨酸修饰金电极测定铜离子的研究[J].传感技术学报,2003(4):475-479.
[13]辛蓉.药物学基础[M].北京:高等教育出版社,2005:122-123.
[14]Parikh H H,McElwain K,Balasubramanian V,et al.A rapid spectrofluorimetric technique for determining drug-serum protein binding suitable for high-throughput screening[J].Pharmaceutical Research,2000,17(5):632-637.
[15]De Smet R,Vogeleere P,Van Kaer J,et al.Study by means of high-performance liquid chromatography of solutes that decrease theophylline/protein binding in the serum of uremic patients[J].J Chromatogr A,1999,847(1/2):141-153.
[16]Zhu Zhiwei,Li Nanqiang.Electrochemical studies of 9,10-anthraquinone interacting with hemoglobin and determination of hemoglobin[J].Microchim Acta,1999,130(4):301-308.
[17]Feng Qu,Li Nanqiang,Jiang Yuyang.Electrochemical studies of porphyrin interacting with DNA and determination of DNA[J].Anal Chim Acta,1997,344(1/2):97-104.
[18]Zhu Zhiwei,Li Nanqiang.Electrochemical studies of the interaction of 9,10-anthraquinone with DNA[J].Microchem J,1998,59(2):294-306.
[19]Matthew J B,Hanania G I,Gurd F R.Electrostatic effects in hemoglobin:hydrogen ion equilibria in human deoxy-and oxyhemoglobin A[J].Biochem,1979,18(10):1919-1928.
