单克隆IgG沉积的增生性肾小球肾炎
2012-11-26曾彩虹朱小东张明超陈惠萍刘志红
曾彩虹 陈 浩 范 芸 徐 峰 黄 倩 朱小东 张明超 陈惠萍 刘志红
单克隆IgG沉积相关肾脏疾病包括轻链沉积病、轻重链沉积病、重链沉积病、Ⅰ型冷球蛋白血症、免疫管状肾小球病和少数纤维丝状肾小球病。2004年,Nasr等[1]报道10例单克隆IgG沉积的增生性肾小球肾炎(Proliferative Glomerulonephritis with Monoclonal IgGDeposits,PGNMID),光镜下以增生性病变为突出表现,免疫荧光染色仅单一亚型IgG和单一轻链沉积,电镜下为颗粒状电子致密物沉积。此后也见个案、移植肾和较大系列报道[2-8]。虽然这一诊断名称尚有争议,但不可回避的是这类疾病临床并非少见。我们在国内首次报道了一例诊断为PGNMID的患者9],为提高对这一疾病的认识,我们总结分析9例诊断为PGNMID的患者临床病理特点。
对象和方法
研究对象 回顾性分析南京军区南京总医院全军肾脏病研究所2010年6月至2011年8月自体肾活检6 345例。入选诊断标准:光镜以肾小球增生性病变为突出表现;免疫荧光以IgG、C3沉积为主,可伴C1q沉积,IgA和IgM阴性,仅有单一IgG亚型和单一轻链在肾小球沉积,超微结构不符合轻链和重链沉积病。排除标准:存在乙型或丙型肝炎、狼疮性肾炎等自身免疫性疾病[9]。符合诊断标准的患者共9例。
临床指标 记录患者的性别、年龄、病程、临床表现及实验室检查资料,包括血常规、血清肌酐(SCr)、血清白蛋白(Alb)、血脂,血清免疫固定电泳,骨髓穿刺及活检结果;尿液检查包括尿蛋白定量(正常值 <0.4 g/d)、尿沉渣红细胞计数(>10万/ml定义为镜下血尿;肉眼可见尿色发红为肉眼血尿)、尿 N-乙酰-β-D-氨基葡萄糖苷酶(NAG)[正常值<16.5 U/(g·cr)]及尿视黄醇结合蛋白(RBP)(正常值<0.5mg/L)。
肾脏病理 所有患者均行经皮肾穿刺活检术,肾穿刺方法采用斜角进针负压吸收法,所取肾组织送光镜、免疫病理及电镜检查。光镜组织常规行HE、PAS、PASM-Masson、Masson 三色染色,免疫病理采用免疫荧光直接法观察肾组织IgG、IgA、IgM、C3、C1q的沉积强度及部位。穿刺标本光镜检查所需肾小球数均≥8个。电镜观察所取肾组织以3.75%的冷戊二醛固定,1%四氧化锇后固定,超薄切片厚70~90 nm,醋酸铀、柠檬酸铅双染色。置于Hitachi7500透射电镜下观察。
免疫荧光特殊染色
IgG亚型染色:冰冻切片3μm,干燥;小牛血清封闭10 min,滴加一抗 IgG1(1∶200,鼠抗人,8c/6-39,sigma),IgG2(1∶200,鼠抗人,HP-6014,sigma),IgG3(1∶200,鼠抗人,HP-6050,sigma),IgG4(1∶200,鼠抗人,HP-6025,sigma),室温孵育 1h;PBS洗三次,滴加FITC标记的兔抗鼠二抗,室温孵育30 min;水洗,吹干,甘油封片,荧光显微镜下观察。
肾组织κ、λ轻链染色:冰冻切片,干燥;小牛血清封闭10 min,滴加一抗 κ轻链(1∶100,兔抗人,A0100,Dako),λ 轻链(1∶100,兔抗人,A0101,Dako)室温孵育1h;PBS洗三次,滴加FITC标记的猪抗兔二抗,室温孵育30 min。水洗,吹干,甘油封片,荧光显微镜下观察。
病理指标的定义 慢性肾小管间质病变指肾小管萎缩、基膜增厚,肾间质纤维化。病变程度按皮质区病变范围分为轻度(≤25%)、中度(26%~50%)及重度(>50%)。急性肾小管间质病变是指肾小管上皮细胞及刷状缘脱落,病变分轻、中和重度,定义同前。
统计方法 采用SPSS13.0软件进行t检验,计量资料用均数±标准差表示,计数资料用Fisher精确检验,P<0.05为差异有统计学意义。
结 果
一般临床资料 患者的临床资料见表1。9例患者为6 345例自体肾活检患者中的0.14%。9例患者中男性5例,女性4例,患者肾活检时的平均年龄为49.8±10.9岁(31~69岁),肾脏病病程15.9±13.1月(1~36月)。9例患者中8例有高血压。肾脏B超提示双肾体积均无缩小,例1(左肾长径127 mm,右肾长径130 mm)和例3(左肾长径126 mm,右肾长径132 mm)肾脏体积明显增大。Alb明显减低,8例患者存在低白蛋白血症,球蛋白正常,尿蛋白定量增加,7例患者伴镜下血尿(多形型),均无肉眼血尿。平均SCr水平升高,中位值为136.1μmol/L,7例(77.8%)患者SCr升高(117.6~633.8μmol/L)。患者肾小管功能损伤明显,仅1例患者NAG正常。
8 例患者有贫血(血红蛋白76~102 g/L),且均行骨髓穿刺检查未见浆细胞异常,7例患者血清免疫固定电泳检查发现1例存在血清异常IgGκ型条带。5例患者血清 IgG水平下降(2.03~4.85 g/L),1例IgA水平升高4.55 g/L(其血清蛋白电泳正常),1例IgA下降(0.385 g/L),1例 IgM 下降(0.374 g/L)。抗核抗体、抗双链DNA、抗肾小球基膜(GBM)抗体、抗中性粒细胞胞质抗体阴性。9例患者中5例出现补体C3下降,而补体C4均正常。3例患者血清冷球蛋白略升高(221~296mg/L)(正常值≤193mg/L)。

表1 9例患者肾活检时临床表现及实验室检查结果
肾活检病理
光镜 9例患者光镜表现见表2,所有患者肾小球呈膜增生样病变,大多数肾小球呈分叶、增生性改变,肾小球弥漫内皮细胞、系膜细胞增生,袢腔内较多单个核为主的细胞浸润,有的细胞插入至内皮下区域及双层基膜间,系膜区增宽明显,基质增多(图1A)。3例患者增宽的系膜区呈现结节状,结节明显处可见袢融合扩张(图1B)。1例患者肾小球弥漫细胞增生的同时伴新月体形成(33.3%)(图1C)。特殊染色 PASMMasson下观察到GBM节段双轨,节段内皮下及系膜区嗜复红物沉积(图1D),有的沉积物呈团块样,增宽的系膜区嗜银性增强,尤其小结节处更明显,而细胞增生明显的系膜区嗜银性减弱。

图1 图1 A:肾小球系膜区明显增宽,系膜细胞及内皮细胞增生,肾小球呈分叶状,袢内见浸润细胞(PAS,×400);B:肾小球系膜区增宽,部分呈结节状(↑)(PAS,×400);C:肾小球见细胞性新月体形成(↑),袢皱缩,球周见肾小管萎缩,少量浸润细胞(PAS,×200);D:肾小球系膜区基质增多,嗜银性增强,少数外周袢分层,见“双轨”,少量节段内皮下嗜复红物沉积(↑)(PASM-Masson,×400)

表2 9例患者肾活检病理特点
肾小管间质病变程度不一,3例患者在慢性轻度病变的基础上伴急性轻度病变,1例在慢性重度病变的基础上存在急性轻度病变;单纯慢性轻度、中度和重度病变各1例;1例单纯急性轻度病变,1例单纯急性中度病变。间质浸润细胞呈灶性分布,以单个核细胞为主。
免疫荧光和免疫组化特点 9例患者均见IgG(图2A)和C3在肾小球内沉积,5例伴C1q沉积。IgG亚型染色显示 IgG3κ型3例,IgG3λ型3例,IgG1κ型2例,IgG1λ型1例(图2B~E)。肾小球单纯IgG3阳性者6例,单纯IgG1阳性3例,无1例IgG2和IgG4阳性。单纯κ轻链阳性者5例,单纯λ轻链阳性者4例,主要分布于肾小球系膜区和毛细血管袢。共8例患者进行了肾组织CD68染色,提示肾小球内浸润的细胞多为CD68阳性细胞,其中例5肾小球内见大量CD68阳性细胞(图2F),无法计数,余7例患者肾小球内平均CD68细胞计数为28.3±17.8个/球(6.4~53.8个/球),球内最高值的均值为48.1±18.3个/球(23~68个/球),CD3球内均数的均值为3.4±4.6个/球(0.8~11.5个/球),CD3球内最高值的均值为8.0±6.4个/球(4~19个/球),CD4细胞球内均数的均值为1.3±1.1个/球(0.5~2.9个/球),CD4球内最高值的均值为4.3±3.3个/球(2~9个/球),CD8细胞球内均数的均值为3.0±3.6个/球(0.8~8.4个/球),CD8球内最高值的均值为6.8±5.7个/球(3~15 个/球),肾小球内 CD3、CD4、CD8均明显少于CD68细胞,而球内CD8略高于CD4。肾间质CD3浸润细胞均值为311.5±183.6个/mm2(96~556个/mm2)。间质CD68浸润细胞均值为336±245个/mm2(64~804个/mm2)。
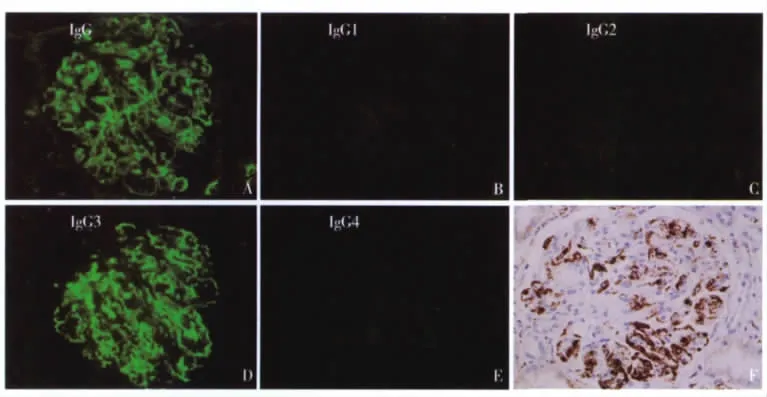
图2 A:IgG沉积于肾小球系膜区和外周袢(IF,×400);B~E:肾小球IgG亚型染色,只有IgG3阳性(例7)(IF,×400);F:肾小球内细胞CD68染色阳性(IH,×400)(例5)
超微结构特点 电镜下观察肾小球袢内细胞增生明显,见单核细胞和淋巴细胞,有的细胞侵入内皮下区域(图3),部分内皮下区域增宽、疏松,见少量或团块状电子致密物,呈短线状或不连续状,亦见系膜区电子致密物沉积,少数病例上皮侧见电子致密物,多数病例电子致密物无特殊结构,例5、例6光镜下突出表现为肾小球袢内细胞增生致袢腔堵塞,增生的细胞CD68染色阳性,电镜下观察到内皮下区域、系膜区及部分细胞胞质内见晶格状沉积物[9]。所有患者肾小管基膜未见电子致密物沉积。

图3 肾小球内皮下区域增宽,节段内皮下见高电子密度致密物(↑),见淋巴及单核细胞插入至内皮下区域,致袢腔狭小(EM)
讨 论
本研究在国内首次报道PGNMID,发现其占自体肾活检的比例为 0.14%,与 Nasr等[4]报道的0.17%的发生率相近,Masai等[5]报道占肾活检的比率为0.07%,提示临床并不罕见。由于以往IgG亚型和轻链并不作为常规染色,有相当一部分患者被诊断为膜增生性肾炎。加强对这一疾病临床病理特点的认识,有助其诊断和治疗。
国外文献报道PGNMID患者发病年龄20~81岁,平均约54.5岁,2/3的患者年龄>50岁,且女性略多。肾脏主要表现蛋白尿,半数以上甚至达肾病范围,绝大多数存在镜下血尿,2/3患者肾功能不全,个别需要透析治疗。约1/3的患者有高血压。血清白蛋白水平下降。血清补体C3、C4下降,但C3下降更多见,冷球蛋白正常,个别患者类风湿因子、丙型肝炎病毒(HCV)抗体阳性[1,2,4]。
本研究显示中国PGNMID也以中老年发病为主,男女比例相近。与Nasr等[4]报道的病例临床表现比较见表3。无论中国还是国外,PGNMID具有相类似的特点,肾脏损害的临床症状较重,大量蛋白尿和低蛋白血症突出,大多数患者伴肾功能不全和镜下血尿。不同之处在于,本组患者高血压的发生率和补体C3下降更常见,但未见补体C4减低,且无明显冷球蛋白血症。未见类风湿因子、HCV抗体阳性的患者。本组患者不仅肾小球损害明显,肾小管功能指标也明显上升,这在国外文献中未提及。
PGNMID常继发于系统性疾病。Nasr等[4]报道29.7%的患者存在异常蛋白血症,1例患者出现溶血性贫血。骨髓活检绝大多数患者浆细胞<5%,少数存在不典型骨髓瘤,个别在随访过程中出现骨髓瘤。Masai等[5]报道的病例中有一例存在骨髓瘤,浆细胞达15%~20%[5]。无肝脾肿大,少数患者存在肾外肿瘤的病史,包括肠道、乳腺和膀胱肿瘤。无系统性红斑狼疮、类风湿性关节炎、混合性结缔组织病和干燥综合征。本组9例患者仅1例存在异常蛋白血症,低于Nasr的报道[4],由于例数少,无明显统计差异。但本组患者贫血的发生率较其明显升高,且贫血的类型为正细胞正色性,未见溶血性贫血。目前这些患者尚未发现肾外肿瘤。

表3 本组患者临床特点与文献的比较
膜增生样病变是PGNMID光镜下最突出的表现,系膜区增宽,基质增多,系膜细胞明显增生,并插入外周袢形成双轨,同时内皮细胞明显增生,PASMMasson和Masson三色染色系膜区及内皮下大量嗜复红物沉积,类似“白金耳样”病变,也可伴有上皮侧沉积,占Nasr病例的56.8%[4]。部分病例突出表现为内皮细胞明显增生,伴单个核细胞和中性粒细胞浸润,致袢腔狭小,少数节段外周袢分层,也伴内皮下和上皮侧沉积物,这部分病例则称为毛细血管内增生性病变,占Nasr病例的35.1%[4]。增生性病变明显的病例可伴新月体、节段袢坏死,以细胞型新月体多见[1,4]。国外文献尚见少数病例表现为肾小球膜性病变和系膜增生性病变[1,3,4,10]。本研究 9 例患者均出现膜增生样病变,内皮细胞及系膜细胞增生,伴浸润细胞,外周袢插入致节段分层,3例出现结节性病变,这在其他文献中也见报道[5]。国外报道的膜性病变和系膜增生未列入本研究,其具体的发生率及临床病理特点尚需进一步观察。我们以往的研究发现特发膜性病变IgG亚型以IgG4沉积为主[11]
PGNMID患者不仅肾小球病变明显,也存在一定的肾小管间质损伤,包括肾小管间质灶性浸润细胞,急性期间质水肿,灶性肾小管上皮细胞扁平。晚期病例出现灶性肾小管萎缩、间质纤维化。动脉可见透明变性和(或)内膜纤维性增厚等硬化性病变。
PGNMID是以单一IgG亚型和单一轻链沉积为主要特点(表4)。Nasr等[4]报道IgG3亚型最常见(65.6%),其次为 IgG1亚型(28.1%),尚见 IgG2亚型(6.25%);Masai等[5]报道的4例中有3例明确为 IgG3κ 型[5]。Albawardi等[6]报道的 4 例移植肾PGNMID患者,3例为IgG3κ型,1例为IgG1λ型。Guiard报道12例表现为MPGN的单克隆IgG沉积病患者,IgG3亚型占80%[12]。本研究也以IgG3最常见(66.7%),其次为IgG1(33.3%),未见IgG2亚型,可能本研究病例数相对少有关。值得关注的是两组均未见IgG4亚型。在Nasr等[4]的研究中κ轻链占绝大多数75%,而本研究中也以κ轻链占多数(55.4%),这种差别是本研究的特点,还是由于例数相对少有关,需要增加病例来进一步阐述。
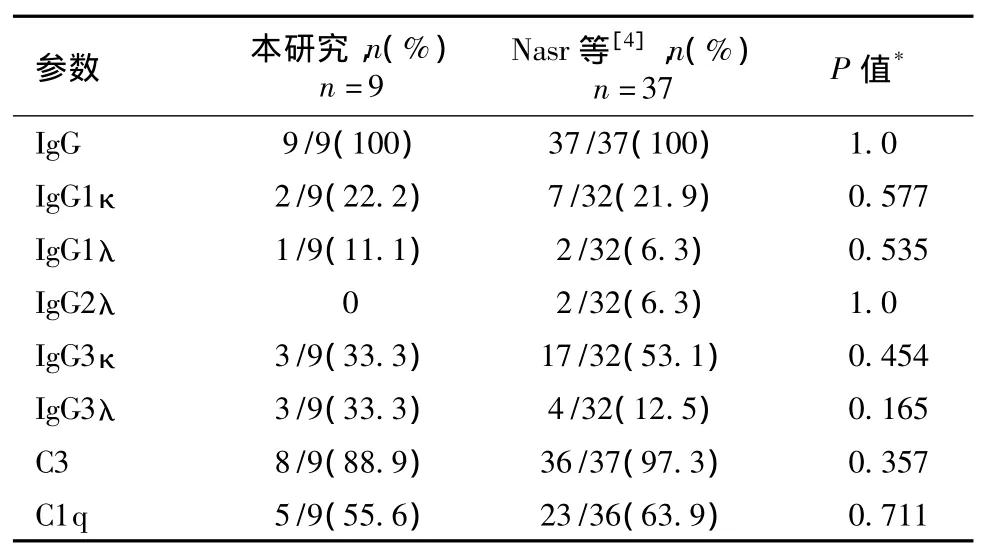
表4 肾小球免疫荧光特点与文献的比较
PGNMID电镜下可见电子致密物沉积,以内皮下沉积最常见,少数位于上皮侧和基膜内。致密物呈细颗粒状,有时见散在分布15~21 nm的细纤维丝或微管状物。GBM可见分层,伴上皮侧电子致密物的患者见钉突形成,致密物溶解后出现虫蚀样病变。袢腔内见内皮细胞增生,中性粒细胞、淋巴细胞和单核细胞浸润,造成袢腔狭小,甚至闭塞。与以往文献报道不同的是,有2例患者沉积物具有晶格状结构,且单一IgG亚型和单一轻链阳性[9]。
PGNMID的发生机制目前并不十分清楚,认为是机体在内源或外源性抗原刺激下的一种免疫反应,一个或多个B细胞克隆增生产生单克隆免疫球蛋白(尤其是IgG3),能自我聚集在肾小球中沉积。人体IgG有四个亚型,IgG3仅占8%。但其理化特性决定其具有致肾病性:(1)在四个亚型中等电点最高(PI 8.2~9.0),与GBM具有较强的亲和性;(2)分子量最大,不易通过滤过屏障,而在肾小球内沉积;(3)通过自身的Fc-Fc段结合易自我聚集;(4)补体激活特性最强。沉积后通过激活炎症介质,刺激肾小球细胞增生和白细胞浸润。这可能是PGNMID以IgG3沉积为主的主要原因。PGNMID患者重链的CH1无缺失[1],Masai对4例儿患者肾组织均行 CH1,CH2,CH3 染色,也未发现有缺失[5]。
以上研究表明单克隆免疫球蛋白肾脏沉积性疾病的光镜和超微结构表现多样。确诊主要依赖免疫球蛋白染色,肾组织仅有单一免疫球蛋白沉积,多数为IgG,可伴有C3和(或)C1q沉积。对于这类病例,需进一步进行IgG亚型和轻链的染色,若仅有单一IgG亚型和单一轻链亚型沉积,则单克隆免疫球蛋白IgG肾脏沉积性疾病诊断成立,那么光镜和超微结构特点则有助鉴别[8],必要时免疫电镜对进一步明确诊断有帮助。因此IgG亚型和轻链的染色对诊断及鉴别诊断具有非常重要的作用。
PGNMID一旦确诊,寻找系统性原因也很重要,如骨髓活检、血清免疫固定电泳,血清免疫球蛋白水平及血尿轻链等检查,多数患者继发于单克隆免疫球蛋白病(MGUS)或骨髓瘤,有的患者伴发自身免疫性溶血性贫血。也有患者诊断时无明确继发原因,在随访中出现MGUS或骨髓瘤。因此诊断后的随访非常必要。
PGNMID临床预后变异较大约1/4的患者在两年半的时间进展为终未期肾病[4]。文献报道用免疫抑制剂如泼尼松,吗替麦考酚酯和利妥昔单抗治疗的报道,达部分缓解。少量蛋白尿者可用肾素-血管紧张素系统阻滞剂等。也有报道移植后复发[8]。本组患者为近期诊断病例,其预后如何还需随访观察。
PGNMID以往常被诊断为MPGN,重视IgG亚型和转链染色有助于诊断。
1 Nasr SH,Markowitz GS,Stokes MB,et al.Proliferative glomerulonephritis with monoclonal IgG deposits:a distinct entity mimicking immunecomplex glomerulonephritis.Kidney Int,2004,65(1):85 -96.
2 Evans DJ, Macanovic M, Dunn MJ, et al. Membranous glomerulonephritis associated with follicular B-cell lymphoma and subepithelial deposition of IgG1-kappa paraprotein.Nephron Clin Pract,2003,93(3):c112 -118.
3 Komatsuda A,Masai R,Ohtani H,et al.Monoclonal immunoglobulin deposition disease associated with membranous features.Nephrol Dial Transplant,2008,23(12):3888 -3894.
4 Nasr SH, Satoskar A, Markowitz GS, et al. Proliferative glomerulonephritis with monoclonal IgG deposits.J Am Soc Nephrol,2009,20(19):2055 -2064.
5 Masai R,Wakui H,Komatsuda A,et al.Characteristics of proliferative glomerulo-nephritis with monoclonal IgG deposits associated with membranoproliferative features.Clin Nephrol,2009,72(1):46 -54.
6 Albawardi A,Satoskar A,Von Visger J,et al.Proliferative glomerulonephritis with monoclonal IgGdeposits recurs or may develop de novo in kidney allografts.Am JKidney Dis,2011,58(2):276 -281.
7 Barbour SJ,Beaulieu MC,Zalunardo NY,et al.Proliferative glomerulonephritis with monoclonal IgG deposits secondary to chronic lymphocytic leukemia.Report of two cases.Nephrol Dial Transplant,2011,26(8):2712 -2714.
8 Nasr SH,Sethi S,Cornell LD,et al.Proliferative glomerulonephritis with monoclonal IgG deposits recurs in the allograft.Clin J Am Soc Nephrol,2011,6(1):122 -132.
9 曾彩虹,朱小东.增生性肾小球肾炎伴晶格状结构的单克隆IgG沉积.肾脏病与透析肾移植杂志,2011,20(4):384-390.
10 Yamada T,Arakawa Y,Mii A,et al.A case of monoclonal immunoglobulin G1-lambda deposition associated with membranous feature in a patient with hepatitis Cviral infection.Clin Exp Nephrol,2012,16(3):468 -472.
11 吴义超,刘志红,苏 健,等.特发性膜性肾病的分子病理特征.肾脏病与透析肾移植杂志,2003,12(2):153-155.
12 Guiard E,Karras A,Plaisier E,et al.Patterns of noncryoglobulinemic glomerulonephritis with monoclonal Ig deposits:correlation with IgG subclass and response to rituximab.Clin J Am Soc Nephrol,2011,6(7):1609-1616.
