IgA肾病患者系膜区C3沉积强度与临床病理特征的相关性分析
2017-03-20郑爱萍罗明华熊祖应
郑爱萍,侯 霜,罗明华,熊祖应,罗 琼
IgA肾病(IgA nephropathy, IgAN)是指肾小球系膜区以IgA1为主的免疫复合物沉积,伴系膜细胞和基质增生为病理特征的一组临床综合征,临床表现轻重不一,呈不同程度的血尿、蛋白尿、高血压和肾功不全等;病理上亦表现复杂多样。除IgA外,补体C3等膜攻击复合物(MAC)在系膜区沉积也是IgAN常见的伴随现象[1],提示补体系统活化参与IgAN发病,而补体C1q沉积少见,表明在IgAN发病过程中,补体系统激活可能主要通过旁路途径,而非经典途径[1-2]。Liu等[3]发现,IgAN患者尿和肾组织中活化C3和C5以及C3aR、C5aR在肾组织中的表达与肾损伤的活动性和严重程度显著相关。近年来,有关补体活化过程中C3是否参与IgAN临床及病理过程研究较多。Zhang等[4]研究证实,在中国IgAN患者中,部分进展为终末期肾病患者,除传统高危因素外,血清IgA/C3比值可较好地判断IgAN预后;Caliskan等[5]证实,高尿酸血症和C3系膜区沉积是IgAN进展的独立危险因素。这些研究结果提示,IgAN患者系膜区C3是否沉积及沉积强度可能与IgAN患者临床严重程度及预后相关。本文收集了北京大学深圳医院2013年1月1日~2015年12月31日行肾穿刺明确为IgAN患者的临床病理学资料,回顾性分析不同强度补体C3系膜区沉积患者的临床病理学特点。
1 材料与方法
1.1材料纳入IgAN患者共423例,占同期肾活检(966例)43.8%。其中,男性235例,年龄16~61岁,女性188例,年龄17~65岁。男女比为1.43 ∶1,平均年龄(32.7±8.5)岁。入选标准:(1)免疫荧光肾小球系膜区以IgA沉积为主(强度及以上),符合IgAN病诊断;(2)肾组织光镜下肾小球数≥10个。排除标准:(1)紫癜性肾炎、狼疮性肾炎、肝病性肾小球硬化症和乙肝相关性肾炎等继发性肾小球疾病;(2)糖尿病肾病、原发性高血压、肥胖相关性肾病、间质性肾炎等疾病。
1.2方法
1.2.1临床资料整理 收集整理所有病例的一般情况及临床资料,包括患者性别、年龄、首发症状、收缩压、舒张压、血常规、24 h尿蛋白定量、血肌酐、血尿酸、血总胆固醇、血甘油三酯、血糖、白蛋白、血IgA、血C3。肾小球滤过率(eGFR)采用MDRD公式估算,eGFR/[mL/(min·1.73 m2)]=186×血肌酐-1.154×年龄-0.203×0.742(女)×1.233(中国人)。
1.2.2病理学检查 所有肾活检标本均包括:(1)光镜检查:分别行HE、Masson、PASM、PAS染色;(2)免疫荧光检查:直接免疫荧光法检测IgA、IgG、IgM、C1q、C3、Fib,间接免疫荧光法检测HBsAg及HBcAg。荧光显微镜下半定量统计:(-)为0分,(+~4+)分别为1~4分;(3)电镜检查。
1.2.3病理资料 IgAN分级采用Haas分级[6]:Ⅰ级:轻微病变型;Ⅱ级:局灶节段性肾小球硬化症型;Ⅲ级:局灶增生型;Ⅳ级:弥漫增生型;Ⅴ级:进行性慢性肾炎型。按照C3系膜区沉积强度不同分为3组:(-~±)为阴性组(A组,图1、2),(+~2+)为弱阳性组(B组,图3、4),(3+~4+)为强阳性组(C组,图5、6)。
根据肾活检病理切片中肾小球总数、新月体总数、肾小球节段硬化数、肾小球硬化总数、系膜增生程度、肾小管萎缩、间质纤维化、间质炎细胞浸润及血管病变严重程度不同分别进行半定量积分。(1)根据系膜增生的严重程度分为无增生(0分)、轻度增生(1分)、中度增生(2分)和重度增生(3分)[7]。(2)新月体、节段硬化、硬化小球以其数值与小球数的比值记分后加入肾小球积分;(3)肾小管及间质按受累面积计分:无受累为0分,<25%为1分,25%~50%为2分,>50%记为3分[8]。
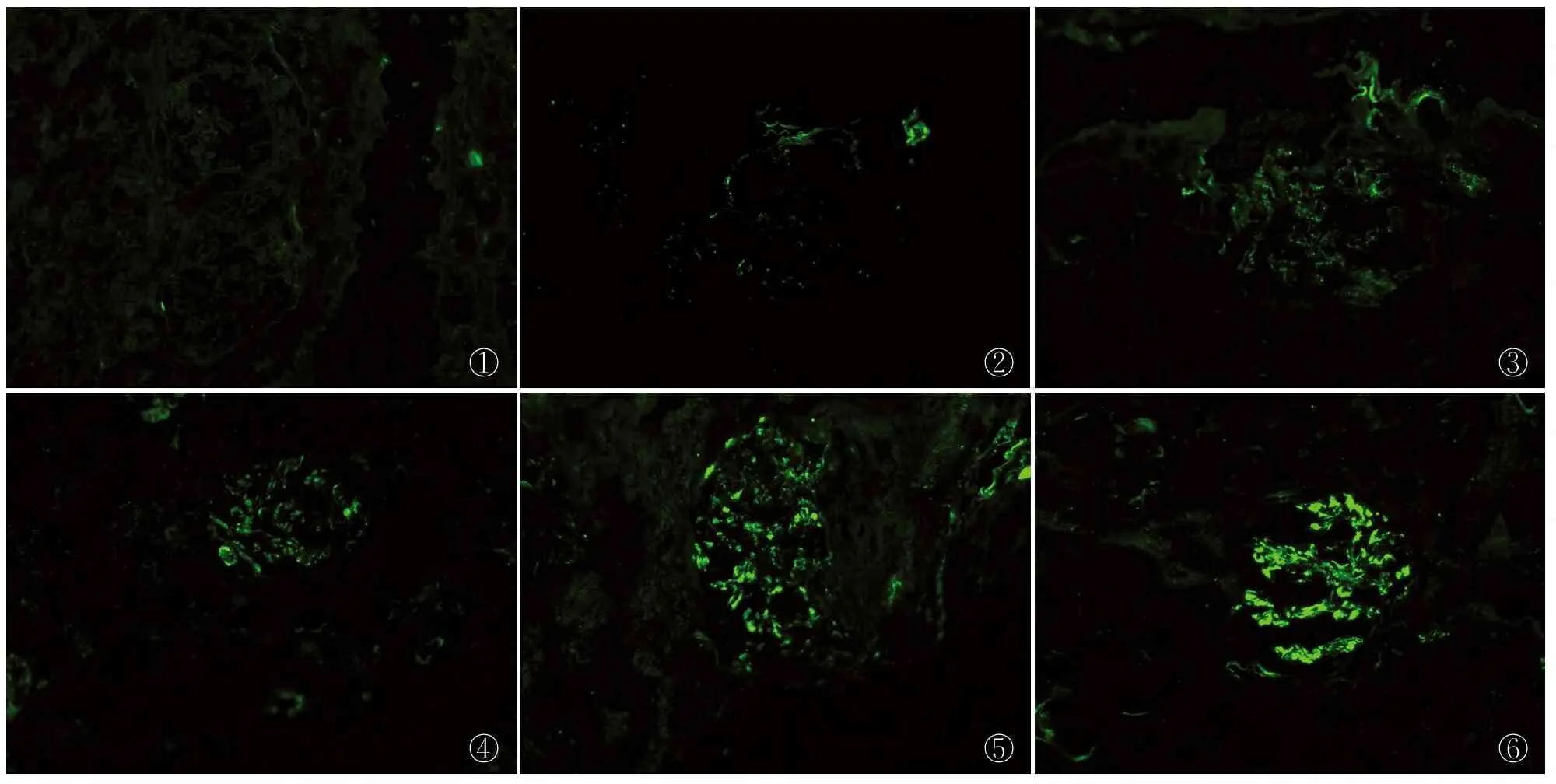
①②③④⑤⑥
图1IgA肾病患者系膜区补体C3呈(-),免疫荧光图2IgA肾病患者系膜区补体C3呈(±),免疫荧光图3IgA肾病患者系膜区补体C3呈(+),免疫荧光图4IgA肾病患者系膜区补体C3呈(2+),免疫荧光图5IgA肾病患者系膜区补体C3呈(3+),免疫荧光图6IgA肾病患者系膜区补体C3呈(4+),免疫荧光
1.3统计学方法采用SPSS 15.0软件进行统计学分析。分别比较不同强度C3沉积分组间的各项临床及病理指标。计量资料采用描述,两样本均数间比较则分别采用两样本独立t检验;计数资料以百分率描述,组间采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.13组患者临床预后指标比较实验对象根据C3沉积强度分为3组:阴性组(A组)64例(15.1%),弱阳性组(B组)136例(32.2%)及强阳性组(C组)223例(52.7%),组间性别、年龄差异无统计学意义。随着C3沉积强度加重,血肌酐、尿酸、甘油三酯水平升高,eGFR降低,差异有统计学意义(P<0.05);其余指标组间相比差异无统计学意义(P>0.05,表1)。
2.23组患者前驱感染症状比较423例患者均有血尿和蛋白尿,伴前驱感染症状者69例,占16.3%,其中呼吸道感染占感染总数的65.2%(45/69),随着C3沉积的加重,呼吸道感染率及总感染率明显增加,差异有统计学意义(P<0.05),其他伴随感染还有皮疹、胃肠炎、泌尿感染等(表2)。
2.33组患者肾组织病变分级比较Haas分级与C3沉积强弱关系采用非线性参数χ2检验,结果显示P>0.05,不能认为3组之间的Haas级别与C3沉积的强弱有关系(表3)。
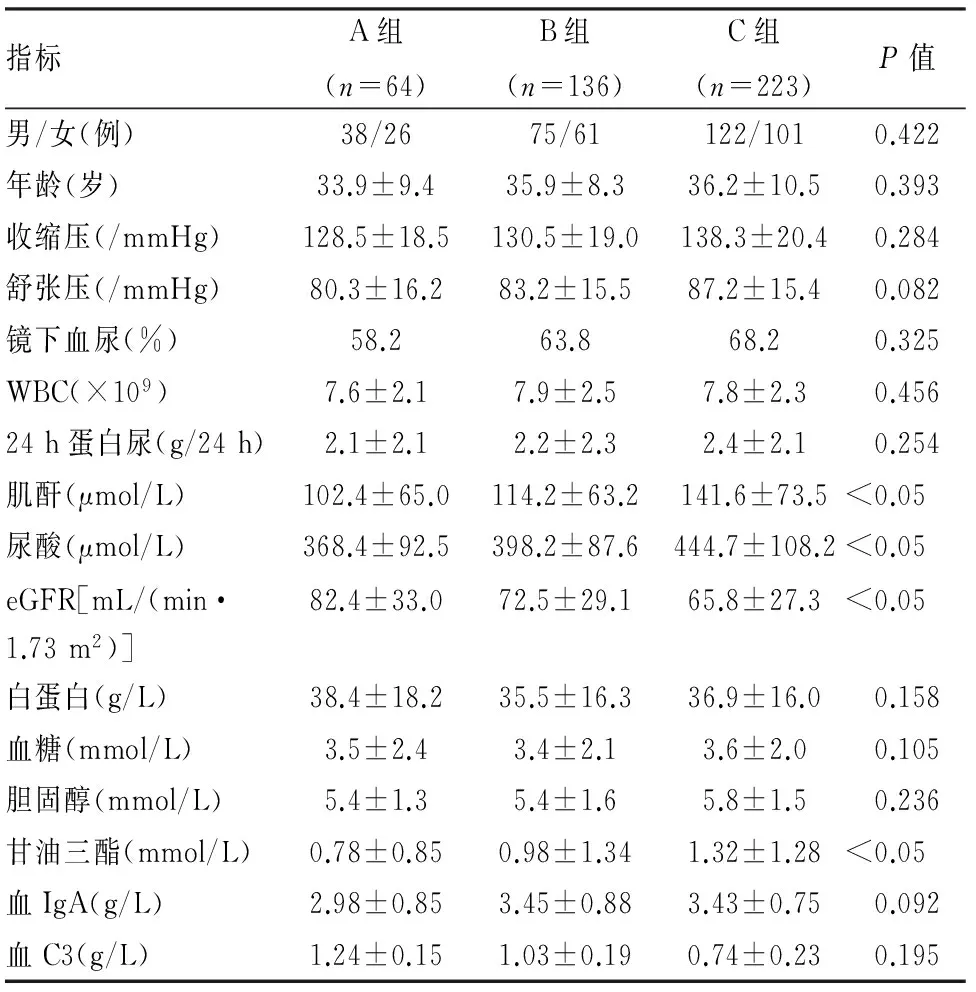
表1 3组临床预后指标比较

表2 3组前驱感染症状比较
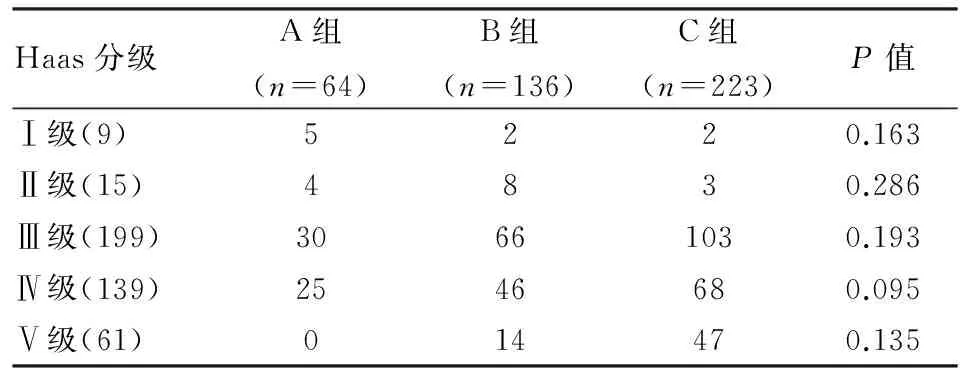
表3 3组肾组织病变Haas分级比较
2.43组患者病理积分比较C3沉积强度不同的各组间在肾小球积分、肾动脉积分及肾小球数差异无统计学意义,但在肾小管积分、肾间质积分及总积分3项指标中,随着C3沉积强度加重,组间差异有统计学意义(P<0.05,表4)。
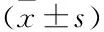
表4 3组患者肾组织病理半定量积分比较
3 讨论
IgAN是一组以IgA和补体C3为主的沉积于肾小球系膜区的肾小球疾病。IgAN在我国发病率高,是终末期肾病的首要原因之一。目前,IgAN的发病机制不明,临床表现呈复杂多样性,预后差异性亦很大;病理上,其不仅可表现为同一患者不同肾小球镜下表现差异较大,且同一肾小球的不同部位也可有完全迥异的病理改变,这些都为临床诊治带来很大困难。若活检时伴有微量蛋白尿、高尿酸血症的IgAN患者,免疫荧光检测提示补体C3在系膜区沉积,这类患者临床及病理表现更重,预后不容乐观,应在早期积极干预治疗[9-10]。因此,准确预测IgAN患者的预后对于临床治疗至关重要。
C3在系膜区呈不同强度的沉积为IgAN常见的伴随现象之一,提示补体活化可能参与IgAN的致病机制,目前国内外很多研究支持这一论据。Daha等[11]研究发现,病毒或细菌感染能刺激循环中自身抗GD-IgA1(半乳糖缺陷的IgA1)升高,继而产生针对GD-IgA1的自身抗体形成IgG-GD-IgA1或IgA-GD-IgA1免疫复合物,这导致补体旁路途径异常激活,造成肾脏损伤;另一方面,多聚IgA也能直接激活旁路途径,导致C3沉积并形成膜攻击复合物而损伤肾脏。这些研究结果均提示补体系统激活在IgAN的致病机制中起重要作用。Espinosa等[12]将283例IgAN患者分成C4d阳性组和C4d阴性组,通过20年研究观察发现,C4d阳性是IgAN进展的独立风险因素,这进一步证明补体激活与IgAN进展密切相关。此外,Kim等[13]对343例原发性IgAN患者的研究表明,低C3血症和系膜区C3沉积为患者肾功能进展的独立危险因素,认为补体活化参与IgAN致病过程。因此,通过各种途径使补体旁路途径异常激活致补体C3活化并沉积,同时免疫调节异常、糖基化缺陷的IgA1等其他因素的共同作用是疾病发生、发展的重要原因。
近几年,肾小管和肾间质病变对肾疾病的预后影响引起了肾脏病理学界的高度重视。一项针对中国人群IgAN开展的研究结果显示:肾小球节段硬化、肾小管萎缩和间质纤维化是IgAN患者进入终末期肾病的独立危险因素[8]。有研究运用Oxford评分标准对187例IgAN患者进行多中心的临床跟踪随访,认为包括系膜细胞增生,毛细血管内皮细胞增生、肾小球节段硬化、肾小管萎缩及肾间质纤维化均对肾脏临床预后有明显预测作用[14]。
本组423例IgAN中补体C3阳性率为84.8%。临床方面,随着C3补体沉积加重,3组IgAN患者的尿酸、肌酐及甘油三酯水平呈正相关,与eGFR呈负相关,差异均有统计学意义(P<0.05);并且还观察到,C3在系膜区沉积程度与前驱感染史比率呈正相关,差异有统计学意义。最常见的呼吸道感染,其次还包括口腔感染、皮肤感染、泌尿系统感染、发热等,这表明在IgAN患者中,前驱感染可能也会加重激活补体。病理方面,3组患者在肾小管积分、肾间质积分及肾小球总积分比较差异有统计学意义(P<0.05),肾小球积分及肾小动脉积分与C3沉积的加重呈正相关,差异无统计学意义(P>0.05)。本组分析结果表明,随着C3沉积加重,临床预后、肾小球总体病变、肾小管萎缩及肾间质纤维化等慢性病理改变进一步加重,提示肾组织C3沉积患者肾脏损伤更为严重、预后可能则更加不容乐观,应引起重视。另外,实验亦发现,3组患者中随着C3补体沉积加重,血清C3浓度也呈降低趋势,但无显著相关性,但血清C3浓度低于正常值比例远远低于伴有C3系膜区沉积比例,以此推测IgAN时患者局部补体旁路途径占主导,而补体旁路途径主要调节因子在这个过程中表达是否变化且与疾病严重程度及预后是否有关,有待进一步研究。
综上所述,IgAN时常伴随不同程度C3系膜区沉积,提示局部系统处活化状态,随着C3沉积加重,患者预后较差。因此,应重视IgAN患者肾组织活检免疫荧光补体C3在系膜区表达特征。
[1] Onda K, Ohsawa I, Ohi H,etal. Excretion of complement proteins and its activation marker C5b-9 in IgA nephropathy in relation to renal funtion[J]. BMC Nephrol, 2011,12:64.
[2] Roos A, Rastaldi M P, Calvaresi N,etal. Glomerular activation of the lectin pathway of complement in IgA nephropathy is associated with more severe renal disease[J]. J Am SocNephrol, 2006,17(6):1724-1734.
[3] Liu L, Zhang Y, Duan X,etal. C3a, C5a renal expression and their receptors are correlated to severity of IgA nephropathy[J]. J Clin Immunol, 2014,34(2):224-232.
[4] Zhang J, Wang C, Tang Y,etal. Serum immunoglobulin A/C3 ratio predicts progression of immunoglobulin A nephropathy[J]. Nephrology (Carlton), 2013,18(2):125-131.
[5] Caliskan Y, Ozluk Y, Celik D,etal. The clinical significance of uric acid and complement activation in the progression of IgA nephropathy[J]. Kidney Blood Press Res, 2016,41(2):148-157.
[6] Donadio J V, Grande J P. IgA nephropathy[J]. N En J Med, 2002,347(10):738-748.
[7] 邹万忠. 肾活检病理学[M]. 3版. 北京: 北京大学医学出版社, 2014:46.
[8] Shi S F, Wang S X, Jiang L,etal. Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy: validation of the oxford classification[J]. Clin J Am Soc Nephrol, 2011,6(9):2175-2184.
[9] 郭宗运, 周生国, 王营营, 等. 微量白蛋白尿IgA肾病伴补体C3沉积患者的临床病理特征及预后分析[J]. 中华医学杂志, 2016,96(9):707-711.
[10] Caliskan Y, Ozluk Y, Celik D,etal. The clinical significance of uric acid and complement activation in the progression of IgA nephropathy[J]. Kidney Blood Press Res, 2016,41(2):148-157.
[11] Daha N A, Nda N K, Roos A,etal. Complement activation by (auto-)antibodies[J]. Mol Immunol, 2011,48(14):1656-1665.
[12] Espinosa M, Ortega R, Sánchez M,etal. Association of C4d deposition with clinical outcomes in IgA nephropathy[J]. Clin J Am Soc Nephrol, 2014,9(5):897-904.
[13] Kim S J, Koo H M, Im B J,etal. Decreased circulating C3 levels and mesangial C3 deposion predict renal outcome in pations with IgA nephropathy[J]. PLoS One, 2012,7:e40495.
[14] Herzenberg A M, Fogo A B, Reich H N,etal. Validation of the oxford classification of IgA nephropathy[J]. Kidney Int, 2011,80(3):310-317.
