抗中性粒细胞胞质抗体相关性血管炎的临床及肾脏病理分析
2012-11-26牟翠萍邢昌赢张承宁任海滨俞香宝赵秀芬毛慧娟
牟翠萍 邢昌赢 刘 佳 孙 彬 张 莉 张 波 张承宁 任海滨俞香宝 赵秀芬 钱 军 毛慧娟
抗中性粒细胞胞质抗体(ANCA)相关性血管炎(AAV)是一类由遗传、环境及免疫等诸多因素共同作用导致的系统性疾病,主要包括显微镜下多血管炎(MPA)、韦格纳肉芽肿(WG)、变应性肉芽肿性血管炎(CSS)和肾脏局限性血管炎(RLV)。AAV临床表现为多系统损害,最常累及肾脏和肺部,伴血清ANCA阳性,其典型肾脏病理表现为寡免疫复合物沉积的肾小球纤维素样坏死或新月体形成。肾脏病理对AAV肾损害的病情预测作用已被广为认可,2010年由多国肾脏病理学家组成的国际协作组根据肾穿刺标本中肾小球受累的程度将AAV肾脏损害大致分为局灶型、新月体型、混合型和硬化型,并通过研究验证上述病理分型对病情的预测作用[1],目前国内关于该病理分型对AAV肾脏损害预测作用的临床研究尚不多见。以往普遍认为AAV发病是由于ANCA激活中性粒细胞导致血管损伤,免疫复合物和补体不参与AAV发病,因为免疫复合物和补体几乎不沉积于受累血管壁,近年来有动物实验研究提示,补体激活参与AAV肾脏损害的发病机制[2-4]。国内目前关于伴有补体沉积的AAV临床研究不多,对其临床特征、治疗及预后等方面尚未达成共识。本文总结96例AAV患者的临床及肾脏病理特征,探讨伴补体沉积AAV的临床特点,以加强对该病的认识,提高临床诊疗水平。
对象和方法
研究对象 选取南京医科大学第一附属医院2006年1月至2012年1月间,结合临床表现、实验室检查、病理活检(包括肾活检及肺组织活检、支气管黏膜活检、鼻黏膜活检及皮肤活检)明确诊断为AAV的患者共96例,其中51例有完整肾活检资料。所有患者符合下列条件:(1)ANCA阳性,临床上有AAV多器官受累表现(如急进性肾小球肾炎、肺出血、五官和皮肤损害),有或无病理活检支持;(2)ANCA阴性,但有AAV多系统受累,肾活检或其他部位活检有典型AAV损害表现;(3)排除自身免疫性疾病(如系统性红斑狼疮、类风湿关节炎)、过敏性紫癜、肿瘤、冷球蛋白血症等疾病所致继发性血管炎;(4)有完整的临床记录。临床诊断参照1994年美国Chapel Hill会议制定的血管炎分类标准[5]。
观察指标
临床资料 起病年龄、性别、病程(首次出现AAV的临床表现至确诊)。
肾脏及肾外表现 肾脏受累包括肉眼或镜下血尿、蛋白尿、急慢性肾功能不全。肾外全身症状包括发热、乏力、消瘦等非特异性表现。皮肤受累包括皮疹、皮下结节、皮肤溃疡、坏疽等;肌肉关节受累包括肌无力、肌痛、肌酶升高、关节炎/关节痛等;眼部受累包括葡萄膜炎、视网膜血管炎等;上呼吸道受累包括鼻窦炎、鼻肉芽肿、过敏性鼻炎等,下呼吸道受累包括咯血、肺部阴影、肺部结节/空洞、肺间质纤维化等;耳部受累包括听力下降、耳鸣等;胃肠道受累包括溃疡、腹痛、黑便等。
实验室检查 血红蛋白(Hb)、血白细胞(WBC)、血小板(PLT)、血沉(ESR)、C 反应蛋白(CRP)、血清补体C3、尿红细胞计数、24h尿蛋白定量、血清肌酐(SCr)及尿素氮(BUN)等指标。
有关指标定义 ESR增快:>15 mm/H;CRP增高:>10mg/L;肾功能不全:SCr≥133μmol/L;严重肾功能不全:SCr>442μmol/L;蛋白尿:尿蛋白定量持续>0.15 g/24h;大量蛋白尿:尿蛋白定量≥3.5 g/24h;肾病综合征(NS):大量蛋白尿伴低白蛋白血症(Alb<30 g/L);急性肾损伤(AKI):48h内出现肾功能的突然减退,SCr升高绝对值≥26.4μmol/L,或SCr较基础值升高≥50%,或尿量减少[尿量<0.5 ml/(kg·h),时间 >6h];终末期肾病(ESRD):估算的肾小球滤过率<15 ml/(min·1.73m2),或SCr>530.4 μmol/L,或行维持性肾脏替代治疗>3月。
血清自身抗体 所有患者均检测ANCA,同时采用间接免疫荧光法(IIF)和酶联免疫吸附试验(ELISA)检测ANCA。IIF法根据免疫荧光特征分为胞质型(c-ANCA)和核周型(p-ANCA)。ELISA法检测抗蛋白酶3(PR3)和抗髓过氧化物酶(MPO)抗体。抗肾小球基膜(GBM)抗体和抗核抗体(ANA)均采用IIF测定。所有试剂均购自德国欧蒙公司。
肾脏病理 所有肾活检患者均在B超引导下行经皮肾穿刺术,肾组织标本石蜡切片经HE、PAS、PASM、Masson染色后行光镜检查,观察肾小球及肾小管间质病变。冰冻切片行免疫荧光检查,观察肾组织中 IgG、IgA、IgM、Clq、C3的沉积强度及部位。肾小管萎缩程度、肾间质炎症细胞浸润程度、肾间质纤维化程度用半定量方法表示。根据邹万忠主编的《肾活检病理学》(第2版)[6],以病变面积为分级依据,肾小管萎缩、肾间质炎症细胞浸润、肾间质纤维化分为无病变、局灶性(<25%)、多灶状(25%~49%)、大片状(50%~75%)及弥漫性(>75%),分别对应程度分级无(0)、轻度(1)、中度(2)、重度(3)、极重度(4)。补体沉积定义为直接免疫荧光法测定肾组织中C3c或C1q的沉积≥1+(0~4+)[7]。本研究中免疫荧光测定结果均为同一病理技术人员出具报告。
治疗 诱导缓解期用泼尼松(或甲泼尼龙)1mg/(kg·d)治疗4~6周,病情控制后逐步减量;环磷酰胺一般在使用泼尼松(或甲泼尼龙)10~14d后开始使用,0.5~1.0 g/(m2·月),共6月;>65岁者环磷酰胺(CTX)剂量减少25%;对有急性肾衰竭或肺出血者在诱导治疗初期使用甲泼尼龙冲击治疗,0.2~0.5 g/d,3次为一疗程,1~2个疗程;严重肺出血、ANCA持续高滴度或合并抗GBM抗体阳性者辅以血浆置换治疗;对肾功能急剧进展者辅以血液透析、腹膜透析治疗。维持缓解期多为口服小剂量泼尼松及硫唑嘌呤或吗替麦考酚酯治疗。
疗效判定 参考美国风湿病学会的标准:(1)完全缓解(CR):肾功能改善或稳定,无活动性受累;肾外体征稳定;无系统性炎症表现,ESR恢复正常或轻度升高(与本病无直接关联);(2)部分缓解(PR):肾功能和尿检指标稳定,肾外体征好转或趋向稳定,无进行性恶化;(3)无效(NR):上述各指标有l项不符即归入本类。
统计学方法 应用SPSS 13.0统计软件进行数据处理与分析。计量资料用均数±标准差或中位数(四分位数标准差)表示,计数资料以百分比表示。组间计量资料比较用独立样本t检验,百分比的比较采用χ2检验或Fisher精确概率法,样本均数间的多重比较采用方差分析。P<0.05为差异有统计学意义。
结 果
一般资料 96例AAV患者中男53例,女43例,年龄15~83岁,平均起病年龄58.4±16.6岁,中位年龄62岁,其中42.3%的患者年龄≥65岁(图1)。病程3d~3.5年,中位病程为57d(30~115d)。62例(65.3%)患者在发病后3月内确诊。临床诊断为MPA 80例,WG 13例,CSS 3例。
血清抗体 IIF测血清ANCA阳性91例,单纯p-ANCA阳性者74例(81.3%);抗原特异性ELISA均识别MPO,其中3例同时识别PR3;单纯c-ANCA阳性者17例(18.7%),抗原特异性ELISA均识别PR3,其中1例同时识别MPO。5例ANCA阴性而肾活检或支气管黏膜活检证实为AAV。3例合并抗GBM抗体阳性。
肾脏及肾外表现 本组AAV患者出现多系统受累的临床表现(表1)。其中46例(47.9%)患者以发热、乏力、消瘦等非特异性症状为首发症状,其中发热(45.8%)、咳嗽咳痰(36.5%)、咯血/痰中带血(21.9%)出现的比例最高(表2)。器官受累以肾脏及肺部最常见,84例(87.5%)患者入院时即出现肾脏受累,31例(32.3%)需即时肾脏替代治疗。28例(29.2%)患者出现咯血/痰中带血,46.9%的患者胸片或CT检查可见肺部浸润阴影。有2例患者出现有较严重的副鼻窦受累,75例(78.1%)患者出现不同程度贫血(图2),另外可见ESR增快和CRP升高(表3)。有5例患者在诊断AAV前已进入ESRD并行规律血液透析或腹膜透析>2年,其中3例在最初诊断ESRD时血清ANCA阴性,2例检查情况不详,后出现发热、咯血、鼻出血等临床表现,查血清ANCA阳性,确诊为AAV。
肾脏病理 51例有完整肾活检资料者,每例平均可见19.34±9.03个肾小球,44例(86.3%)见新月体形成(平均新月体比例41.8% ±28.5%),28例(54.9%)伴毛细血管袢纤维素样坏死,33例(64.7%)伴球性硬化(平均肾小球硬化比例21.5%±27.1%)。所有患者均有肾间质炎细胞浸润,27例(52.9%)有肾小管萎缩,33例(64.7%)有肾小管间质纤维化(图3)。其中44例病理诊断为系统性血管炎肾损害,2例为膜性病变,2例为局灶节段性肾小球硬化性病变伴IgM沉积,另外2例合并急性肾小管坏死,1例表现为慢性间质性肾炎伴局灶节段性肾小球硬化。
除肾活检外,另有3例行鼻黏膜活检病理示慢性肉芽肿性炎伴纤维素性坏死性血管炎;2例行肺穿刺组织病理提示大片炎性坏死伴肉芽肿形成;2例行皮肤活检提示真皮小血管纤维素样变性,白细胞碎裂性血管炎;1例行支气管黏膜活检提示黏膜下炎性肉芽组织增生,小灶坏死,血管及血管周围炎性细胞浸润;1例行咽喉部黏膜活检提示咽部黏膜急慢性炎,伴肉芽组织及肉芽肿性炎;1例行颌下腺病理活检提示双颌下腺肉芽肿性炎。

图1 96例AAV患者的年龄分布

表1 96例抗中性粒细胞胞质抗体相关性血管炎患者系统受累的临床表现及发生率

表2 96例抗中性粒细胞胞质抗体相关性血管炎患者的临床首发症状

图2 抗中性粒细胞胞质抗体相关性血管炎患者的贫血程度构成

表3 96例抗中性粒细胞胞质抗体相关性血管炎患者的实验室检查特点

图3 肾间质炎细胞浸润、肾小管萎缩及肾间质纤维化程度的构成
不同病理分型的AAV患者临床特征 根据其光镜下肾小球病理改变的程度将44例AAV肾脏损害病理分为局灶型(15例)、新月体型(7例)、混合型(12例)、硬化型(10例)。四组在年龄、病程、肺出血、24h尿蛋白定量等方面均无统计学差异;新月体型的AAV患者肉眼血尿的发生率明显高于局灶型、混合型和硬化型(Pa1<0.05、Pb1<0.05、Pc2<0.01);四组中发病时肾功能不全的发生率硬化型最高(100%),其次为新月体型(85.7%);急性肾损伤的发生率以新月体型最高(85.7%);局灶型的AAV患者发病时的SCr水平明显低于新月体型、混合型和硬化型(P <0.01、P <0.05、P <0.05),后三者之间发病时的SCr水平无统计学差异;经过免疫抑制治疗后,新月体型AAV患者SCr下降幅度最大,较局灶型、混合型、硬化型有统计学差异(P<0.01、P <0.01、P <0.05);新月体型和硬化型需即时肾脏替代治疗的患者比例较局灶型明显升高(pa1<0.05);随访半年以上的患者有40例,其中8例进入ESRD,分别为局灶型1例、新月体型2例、混合型2例、硬化型3例(表4)。获得CR者18例,上述四型分别为9例、4例、4例、1例。获得PR者11例,上述四型分别为3例、0例、4例、4例。死亡3例,2例死于重症肺部感染,1例死于消化道大出血。
伴补体沉积AAV的临床病理特征 ANCA阳性且肾活检病理诊断为AAV肾脏损害者共39例,肾组织免疫荧光检测伴补体沉积者22例(56.4%),无补体沉积的有17例(43.6%)。两组在年龄、性别、病程及ANCA等方面均无统计学差异;补体沉积组发病时ESR明显增快(P=0.023),补体C3水平明显降低(P=0.005)(表5)。补体沉积组发病时的SCr和BUN明显高于阴性组(P=0.021、P=0.012),而估算肾小球滤过率(eGFR)水平低于阴性组(P=0.033)(表6)。补体沉积组肾脏病理中纤维性新月体和球性硬化比例明显升高(P=0.009、P=0.028),而正常肾小球比例减少(P=0.016),两组在细胞性新月体比例无统计学差异(表7)。四种病理类型中伴补体沉积的例数分别为局灶型(5例)、新月体型(4例)、混合型(5例)、硬化型(8例),四种病理类型在临床表现、尿液及肾功能检查等方面未见显著统计学差异。
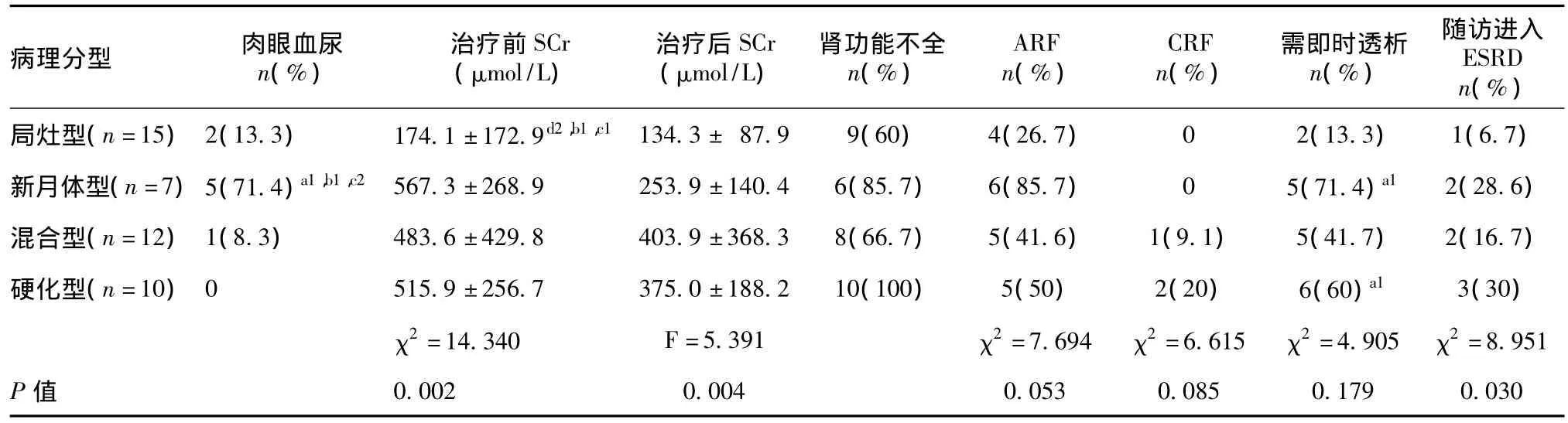
表4 不同病理分型抗中性粒细胞胞质抗体相关性血管炎患者的临床特点

表5 补体沉积阳性组和阴性组患者的肾外表现及实验室检查
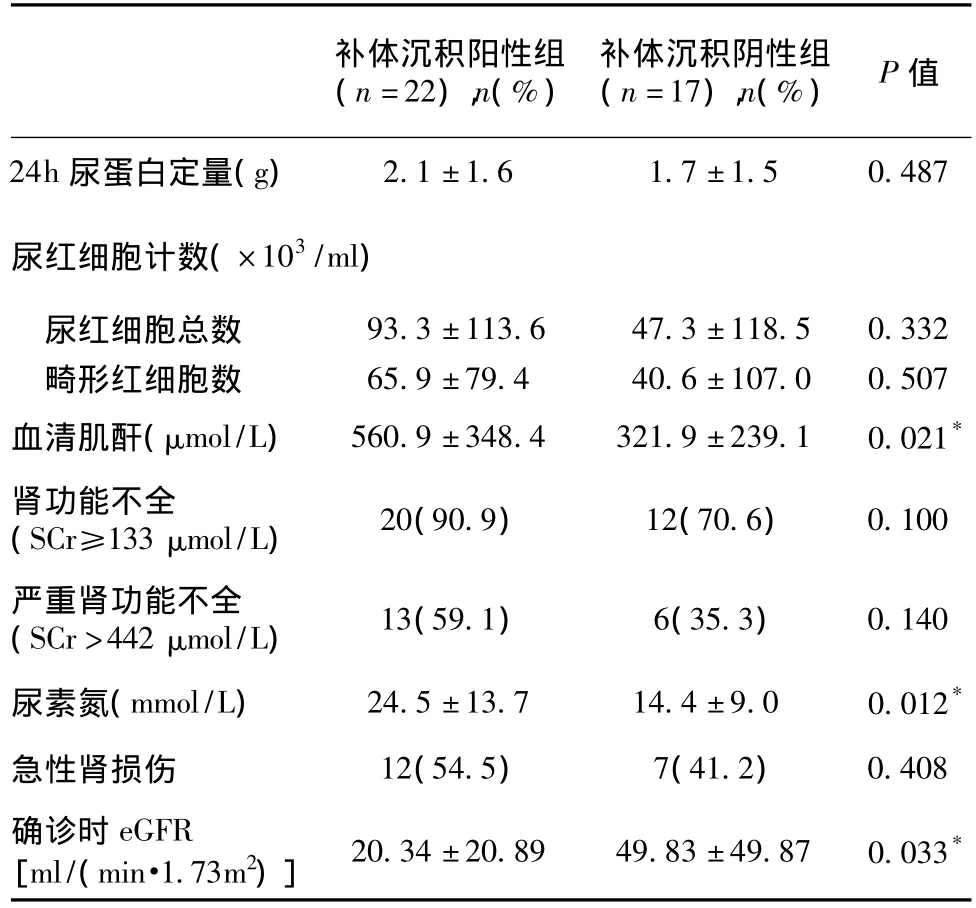
表6 补体沉积阳性组和阴性组患者的尿检及肾功能比较
讨 论
AAV临床特点 AAV是一类少见疾病,据最近一项来自英国的流行病学调查显示,欧洲AAV的发病率约为10~20/百万人,多见于中老年人,发病的高峰年龄在 65~74 岁[9],陈旻等[10]报道 426 例AAV的平均发病年龄为56.1岁,>65岁者占41.3%。本组AAV患者的平均起病年龄为58.4±16.6岁,年龄≥65岁的老年患者占42.3%,与国内外研究结果基本一致。欧洲的多中心研究提示,PR3-ANCA阳性者与MPO-ANCA阳性者大致相等,而本组研究中 71例 MPO-ANCA阳性,16例PR3-ANCA阳性,两者之比为4.2∶1,国内其他研究也发现类似现象[10,11],这表明我国的AAV以MPO-ANCA阳性为主,造成此种差异的原因可能与遗传、环境、地域等因素有关[9,12]。

表7 补体沉积阳性组和阴性组患者的肾脏病理比较
AAV临床表现缺乏特异性,常出现全身多系统损害。本组96例患者中,以发热乏力消瘦等非特异性症状起病者占47.9%;首发症状中以发热、咳嗽咳痰、咯血/痰中带血为表现者分别占45.8%、36.5%、21.9%,由于症状不具有特异性,极易被忽视,出现漏诊或误诊。肾脏和肺部最易受累,可能由于这两个器官小血管较为丰富。出现严重肾功能不全的患者占34.3%,有31例需即时肾替代治疗,表明这部分AAV患者就诊时病情发展已较重,未能得以早期诊治。实验室检查中以不同程度的贫血(78.1%)、ESR增快(97.3%)和CRP(81.2%)最为突出。
AAV肾脏病理分型及与临床联系 组织活检是确诊AAV的重要手段。Frankel等[13]分析,由于本病发病率较低而不易确诊,组织活检(如经支气管镜肺活检、肾活检、皮肤黏膜活检等)有助诊断及鉴别诊断。国内外报道AAV的肾脏累及率达80%~90%[10,14],且多进展迅速,因此及时肾活检对明确诊断、指导治疗和提示预后都有重要作用。2010年,由多国的肾脏病理学家组成的国际协作组,根据肾穿刺标本中肾小球受累的程度将AAV肾损害大致分为四型,分别是局灶型(≥50%正常肾小球)、新月体型(≥50%肾小球出现细胞性新月体)、混合型(<50%正常肾小球、<50%肾小球出现细胞性新月体、<50%肾小球出现球性硬化)和硬化型(≥50%肾小球出现球性硬化),并且通过验证研究证实按照上述四种病理分型的顺序(局灶型、新月体型、混合型、硬化型),肾功能下降的程度逐渐加重,进展至ESRD终点事件的发生率逐渐增高;局灶型较其他三种病理分型的AAV肾损害残余肾功能较多、肾脏预后相对较好;新月体型肾脏血管炎病情活动较重、起病时肾功能损害重,但肾功能恢复的可能性大;病理表现为硬化型的AAV肾功能不恢复的风险最大,且诊断后一年内死亡的风险较高[1]。本研究中通过对不同病理类型AAV患者临床特征的比较,提示局灶型患者肾功能损害相对较轻,新月体型患者肉眼血尿的发生率明显高于局灶型、混合型和硬化型;发病时肾功能不全的发生率较高,对免疫抑制治疗反应较好;硬化型患者起病时肾功能不全的发生率最高,进展为ESRD的比例较其余三者增高,与文献中的结论基本相符。
伴补体沉积AAV的临床特点 AAV的发病机制尚未完全阐明,既往普遍认为AAV的典型肾脏病理表现中肾小球免疫荧光呈现寡免疫复合物和补体沉积,但随着对AAV认识与诊断的不断完善及该类疾病患者例数的不断积累,已有许多临床研究发现在肾脏病理组织中有补体的沉积[15,16],在 33%的AAV肾损伤患者中发现有B因子、C3及膜攻击复合物沉积于肾小球毛细血管袢或系膜区,而这与蛋白尿的增加和肾损害的加重直接相关[17]。在人类的补体系统中,补体C3是血清中最为丰富的补体蛋白,具有核心作用,支持补体活化的所有途径,包括经典途径、旁路途径和凝集素途径,从而促使C3向C3a和C3b转化[18]。肾小球中C3a的出现提示持续的免疫复合物沉积和补体激活,C1q的沉积提示经典途径的激活[19]。
本研究中根据39例肾组织标本直接免疫荧光有无补体沉积,将其分为补体沉积阳性组(22例)和补体沉积阴性组(17例),可见补体沉积组所占比例>50%,该数据稍高于Haas等[16]所报道的126例AAV肾损害患者1/3患者出现肾小球补体沉积的比例,可能与本研究统计的病例数较少有关。两组在年龄、性别、病程及肺、关节、肌肉、眼、耳等肾外脏器受累等方面无统计学差异。与补体沉积阴性组相比,补体沉积组发病时SCr和BUN明显升高,ESR明显增快,补体C3水平和eGFR明显降低,肾脏病理中新月体形成、纤维性新月体和球性硬化比例明显升高,而正常肾小球比例减少。这些数据提示伴补体沉积的AAV肾脏损害更显著,与Xing等[17]的报道基本相符。补体沉积阳性组血清补体C3水平明显下降,而肾小球中出现补体沉积,提示补体可能参与AAV的发病,应引起临床重视。本研究中四种病理类型(局灶型、新月体型、混合型、硬化型)中伴有补体沉积的,在临床表现、尿液及肾功能检查等方面无显著统计学差异。鉴于观察例数较少,可能结论不够确切,有待增加样本量进一步研究。
小结:本组AAV以MPO-ANCA阳性的MPA为主,局灶型患者肾功能损害相对较轻,新月体型的患者对免疫抑制治疗反应较好,硬化型进展为ESRD的比例较其余三者增高,提示预后不佳。AAV患者肾脏病理中出现补体沉积并不少见,伴补体沉积的AAV患者肾脏损害较重,应引起临床重视;不明原因的肾功能异常伴多系统临床表现(如发热、乏力加重,肺部表现等)时,需警惕AAV发生的可能,及时检查,避免漏诊、误诊。
1 Berden AE,Ferrario F,Hagen EC,et al.Histopathologic classification of ANCA-associated glomerulonephritis.J Am Soc Nephrol,2010,21(10):1628-1636.
2 Xiao H,Schreiber A,Heeringa P,et al.Alternative complement pathway in the pathogenesis of disease mediated by anti-neutrophil cytoplasmic autoantibodys.Am J Pathol,2007,170(1):52 - 64.
3 Huugen D,van Esch A,Xiao H,et al.Inhibition of complement factor C5 protects against anti-myeloperoxidase antibody-mediated glomerulonephritis in mice.Kidney Int,2007,71(7):646 -654.
4 van Timmeren MM,van der Veen BS,Stegeman CA,et al.IgG glycan hydrolysis attenuates ANCA-mediated glomerulonephritis.J Am Soc Nephrol,2010,21(7):1103 -1114.
5 Jennette JC,Falk RJ,Andrassy K,et al.Nomenclature of systemic vasculitides.Proposal of an international consensus conference.Arthritis Rheum,1994,37(2):187 -192.
6 肾活检病理检查的常见病变∥邹万忠,王海燕.肾活检病理学.第2版.北京:北京大学医学出版社,2009:52-54.
7 Chen M,Xing GQ,Yu F,et al.Complement deposition in renal histopathology of patients with ANCA-associated pauci-immune glomerulonephritis. Nephrol Dial Transplant, 2009, 24(4):1247-1252.
8 Ma YC,Zuo L,Chen JH,et al.Modified glomerular filtration rate estimating equation for Chinese patients with chronic kidney disease.J Am Soc Nephrol,2006,17(10):2937 - 2944.
9 Ntatsaki E,Watts RA,Scott DG.Epidemiology of ANCA-associated vasculitis.Rheum Dis Clin North Am,2010,36(3):447 -461.
10 陈 旻,于 峰,张 颖,等.426例抗中性粒细胞胞浆抗体相关性小血管炎患者多系统临床表现和肾脏病理分析.中华内科杂志,2005,44(11):828 -831.
11 梅洁卉,胡伟新,刘春蓓,等.抗中性粒细胞胞浆抗体相关血管炎肾损害的临床病理分析.肾脏病与透析肾移植杂志,2007,16(2):127-133.
12 Bosch X,Guilabert A,Font J.Antineutrophil cytoplasmic antibodys.Lancet,2006,368(9533):404 - 418.
13 Frankel SK,Cosgrove GP,Fischer A,et al.Update in the diagnosis and management of pulmonary vasculitis.Chest,2006,129(2):452 -465.
14 Jennette JC,Falk RJ.Small-vessel vasculitis.N Engl JMed,1997,337(21):1512-1523.
15 Neumann I,Regele H,Kain R,et al.Glomerular immune deposits are associated with increased proteinuria in patients with ANCA-associated crescentic nephritis.Nephrol Dial Transplant,2003,18(3):524-531.
16 Haas M,Eustace JA.Immune complex deposits in ANCA-associated crescentic glomerulonephritis:a study of 126 cases.Kidney Int,2004,65(6):2145-2152.
17 Xing GQ,Chen M,Liu G,et al.Complement activation is involved in renal damage in human antineutrophil cytoplasmic autoantibody associated pauci-immune vasculitis.J Clin Immunol,2009,29(3):282-291.
18 Sahu A,Lambris JD.Structure and biology of complement protein C3,a connecting link between innate and acquired immunity.Immunol Rev,2001,180:35 -48.
19 Schulze M,Pruchno CJ,Burns M,et al.Glomerula C3c localization indicates ongoing immune deposit formation and complement activation in experimental glomerulonephritis.Am J Pathol,1993,142(1):179-187.
