促红细胞生成素对骨髓间充质干细胞移植修复小鼠急性肾损伤的作用机制
2012-11-26刘楠梅韩国锋张金元
刘楠梅 田 军 韩国锋 程 劲 黄 健 张金元
急性肾损伤(AKI)是临床常见病,尚无特异性治疗方法可以阻止其疾病进展。随着干细胞治疗技术的发展,为肾脏疾病的治疗研究提供了新的途径。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是骨髓中一大类具有多向分化潜能的多能干细胞,研究表明BM-MSCs移植是一种很有潜力的AKI治疗方法,归巢至肾脏的BM-MSCs可通过其分化及旁分泌功能促进AKI的修复[1-3],但其改善能力有限,移植细胞向损伤肾脏的归巢数量有限是影响修复效率的原因之一。在BM-MSCs的定向归巢机制中,目前研究较多的是基质细胞衍生因子 1(stromal cell derived factor-1,SDF-1)/CXCR4轴[4]。促红细胞生成素(EPO)是一种能调节红系祖细胞生长分化的糖蛋白,其治疗AKI的有效性已被广泛证明[5-7],但尚无相关研究表明这种药物是否会对BM-MSCs移植的定向肾脏归巢有益,从而增强移植治疗效果。本实验即构建缺血再灌注(I/R)诱导的AKI小鼠模型,行BM-MSCs移植,观察外源性EPO干预对移植BM-MSCs的AKI修复效应的影响,并探讨其可能机制。
材料与方法
动物与试剂 实验用C57BL/6小鼠由第二军医大学实验动物中心提供[动物生产许可证号SCXK(沪)2007-0003],实验在第二军医大学实验动物中心完成[动物使用许可证号SYXK(沪)2007-0003]。C57BL/6小鼠BM-MSCs细胞株购自ATCC公司,5溴脱氧尿嘧啶核苷(BrdU)及BrdU单克隆抗体购自Sigma公司,SDF-1单克隆抗体购自Santa Cruz公司,免疫组化检测试剂盒购自Jackson公司。
BM-MSCs的BrdU标记 大量传代BM-MSCs细胞,当细胞铺满瓶底60%(即达对数生长期)时,倾去DMEM培养液,加入含10μmol/L BrdU标记液的DMEM培养液继续孵育72h,免疫组化法对BrdU标记率进行鉴定。标记好的BM-MSCs备用。
小鼠AKI模型的制备、实验分组及处理 选取体重(20±2)g的C57BL/6小鼠100只,预养3d,随机分为5组,每组20只,2%戊巴比妥钠溶液(30mg/kg)腹腔注射麻醉。正常对照组:麻醉后暴露肾脏30 min关闭,尾静脉注射生理盐水0.2 ml;模型组(AKI组):麻醉后夹闭双侧肾蒂30 min后开放,关闭腹腔,建立AKI模型,尾静脉注射生理盐水0.2 ml;BM-MSCs移植组:AKI建模后尾静脉注射0.2 ml含有2×106个BrdU-BM-MSCs的PBS液;EPO干预组:AKI建模后予3 000 U/kg EPO皮下注射3d;EPO干预+BM-MSCs移植组:AKI建模后尾静脉注射0.2 ml含有2 ×106个 BrdU-BM-MSCs的 PBS液,同时予3 000 U/kg EPO皮下注射3d。各组小鼠均在温度、湿度适宜的环境下饲养,自由饮食、饮水。分别于建模后 1d、3d、7d、14d处死部分小鼠(每次每组均处死5只),摘眼球取血,分离血清后-20℃冰箱保存备用。0.01 mmol/L PBS液100 ml经心脏冲洗血液后取双侧肾脏,再用上述浓度的PBS液对获取的肾脏进行冲洗,10%甲醛固定备作病理及免疫组化等检查。
血液指标 收集的血清采用Beckman自动生化仪检测尿素氮(BUN)及血清肌酐(SCr)。
病理改变 石蜡切片,HE染色后对肾小管坏死程度进行评分(盲法):每张切片200倍镜下取15个视野,0=正常、1=轻微损伤(受损肾小管 <5%)、2=轻度损伤(受损肾小管5%~25%)、3=中度损伤(受损肾小管26%~75%)、4=重度损伤(受损肾小管>75%),半定量分析并计算其均值,作为肾小管坏死的评分指数(ATN评分)。
免疫组化法检测BrdU表达 10%中性甲醛溶液固定24h,常规石蜡包埋。切片置于二甲苯脱蜡和梯度乙醇脱水,0.3%H2O2室温阻断内源性过氧化物酶后,放入盛有枸橼酸盐缓冲液的容器中,加抗原修复液,微波加热暴露抗原(98℃,3 min)。切片与BrdU单克隆抗体4℃孵育16h。PBS液洗片后加辣根过氧化酶(HRP)标记抗小鼠IgG,37℃孵育1h,洗片后加DAB底物显色液15 min,苏木素衬染,常规树脂封片,室温保存。测量方法:每份标本分别选取15个髓质部非重叠视野(×200倍),计数肾小管上皮组织中BrdU+细胞所占百分比,取其均数纳入统计。
Western印迹法检测肾组织SDF-1水平 肾组织80~100mg加入1 ml三去污裂解液,4℃ 20 000 r/min离心10 min,取上清再次4℃ 12 000 r/min离心10 min,测蛋白浓度,取25μg蛋白进行 SDSPAGE电泳。蛋白转移至NC膜上,含1%BSA的TBST 为封闭液(10 mmol/l Tris-HCl,pH 7.14,150 mmol/L NaCl,1%Tween-20),室温封闭 4h,加入SDF-1单抗,4℃孵育过夜,TBST洗涤液洗膜3次×15 min,加入HRP标记的对应二抗,室温摇动1h,洗膜3次×15 min,置于柯达活体成像仪中观察结果,曝光3 min,CCD自动获取图片结果。测量条带的灰度值,β-actin为内参,各蛋白的表达强度为两者灰度的比值。
统计学处理 用SPSS 15.0统计软件进行分析,计量数据采用均数±标准差表示,多组间差异显著性检验采用单因素的方差分析,两组间比较用t检验,P<0.05为差异有统计学意义。
结 果
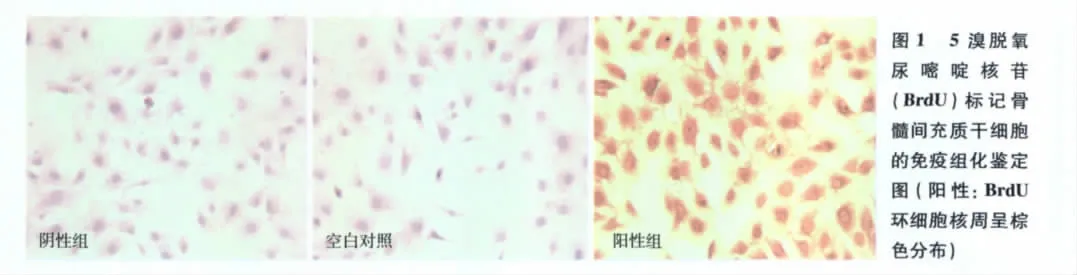
BM-MSCs的BrdU标记 本实验采用BrdU标记液对BM-MSCs标记,该方法简便易行,标记阳性率高,经免疫组化证实阳性为BrdU环细胞核周呈棕色分布(图1),半定量分析证实其标记阳性率达98.71% ±0.32%。
BUN、SCr及ATN评分情况 与正常对照组比,AKI组小鼠的BUN、SCr及ATN评分于术后显著升高,以建模后第1d达到最高峰(P<0.01),此后有降低趋势(图2~4)。
BM-MSCs移植后,AKI小鼠 BUN、SCr、ATN 评分有不同程度降低,与AKI组相比,以移植后第3d及第7d差异最为显著(P<0.05),但与同时间点正常对照组相比,其BUN、SCr水平仍显著升高,且随着移植时间延长,BUN、SCr及ATN评分下降趋势逐渐减弱(图2~4)。
EPO干预也同样可以轻度降低 AKI小鼠的BUN、SCr水平及ATN评分,但差异不具有统计学意义。而在BM-MSCs移植的基础上联合EPO干预,AKI小鼠的BUN、SCr以及ATN评分则有更为显著地降低(P <0.05或 P <0.01);与单纯 BM-MSCs移植组比,该组小鼠建模后第7d、第14d的BUN、SCr及ATN评分降低更为显著(P<0.05或P<0.01);亦显著低于同时间点的EPO干预组;且随着移植时间的延长,BUN、SCr及ATN评分下降趋势并未减弱,至建模后第14d小鼠的BUN、SCr水平甚至接近正常对照组(图2~4)。
肾小管组织病理变化 HE染色见模型鼠肾小管上皮细胞(RTECs)空泡变性、刷状缘脱落明显,部分肾小管基膜裸露形成裸膜,管腔中可见脱落的RTECs,以建模后第1天最严重,随着建模时间延长AKI组小鼠的肾小管损伤有一定的自身修复。BM-MSCs移植组及EPO干预组于肾髓质中均可见胞核深染、胞体较大的再生RTECs。在BM-MSCs移植的基础上联合EPO干预,较同时间点BM-MSCs移植组和EPO干预组比,其肾小管损伤的修复显著加快。

图2 各组小鼠血尿素氮(BUN)水平

图3 各组小鼠血清肌酐(SCr)水平

图4 各组小鼠ATN评分
BM-MSCs在肾组织的分布 光镜下细胞核呈棕褐色为BrdU+细胞,免疫组化染色时,正常对照组、AKI组、EPO干预组小鼠肾小管上皮组织的细胞核均呈蓝色,但BM-MSCs移植组小鼠肾小管上皮组织中,有部分细胞的细胞核呈现棕褐色,以建模后第7天最多,其占RTECs的比例为11.32% ±1.38%。在BM-MSCs移植的基础上联合EPO干预,可增加肾小管上皮组织中BrdU+细胞的比例,以建模后第3d、第7d差异最为显著(P <0.05或 P <0.01)(图5、6)。

图5 两组小鼠BrdU+细胞分布(IH,×100:细胞核呈棕褐色为阳性)
肾组织中SDF-1的表达 Western印迹检测表明,建模后肾组织中SDF-1水平显著升高(P<0.01),于建模后第7天达高峰(图7)。选第7天为观察时间点,与AKI组比,BM-MSCs移植组肾组织中SDF-1表达无明显差异,而外源性EPO可增加SDF-1的表达,实验中EPO干预组及EPO干预+BMMSCs移植组的SDF-1水平均显著升高(P<0.01),但这两组之间的SDF-1表达差异无显著性(图8)。

图6 两组小鼠的Brd U+细胞百分比
讨 论
AKI的干细胞移植是一种新兴的细胞生物工程技术,BM-MSCs是比较理想的移植用“种子细胞”,许多研究均已证实BM-MSCs的这一功效,但研究也同时观察到单纯BM-MSCs移植的肾脏修复能力是非常有限,从而限制了其临床推广应用。本研究也观察到AKI小鼠经BM-MSCs移植后其BUN、SCr值及ATN评分虽均降低,但仍显著高于正常对照组,且随着移植时间延长,上述指标的下降趋势逐渐减弱。移植细胞向靶器官的归巢数量有限以及AKI微环境不利于归巢干细胞的存活是目前备受关注的两大原因。

图7 对照组及模型组不同时间点肾组织中SDF-1的表达

图8 建模7d后各组小鼠肾组织中SDF-1的表达
目前认为,EPO不但是红细胞生成的调节因子,而且还可通过EPO受体(EPOR)对多种非造血细胞及组织发挥调节作用。前期我们已经通过体外细胞实验证实BM-MSCs表达EPOR,EPO可通过EPOR减轻体外模拟AKI微环境下培养BM-MSCs的凋亡,促进其增生,从而减轻AKI微环境对归巢干细胞存活的不利影响[8]。那么 EPO对移植BM-MSCs的肾向归巢是否同样具有有利地靶向调控作用呢?
SDF-1/CXCR4轴在调控干细胞迁移/归巢方面发挥重要作用[4]。SDF-1 是 1994 年Nagasawa等[9]在小鼠骨髓基质细胞pA6分泌的细胞因子中发现的,已有报道证明其能组成性地在大脑、心、肾、肝、肺和脾中广泛表达[10],缺血微环境将上调其表达[11,12],本研究中观察到模型小鼠肾组织中 SDF-1水平升高,与文献报道一致[13]。SDF-1的受体CXCR4,是一个有7个跨膜结构域的G蛋白偶联受体,其结构高度保守,在人体内编码基因位于第4号染色体。文献报道,BM-MSCs可表达 CXCR4[14],SDF-1对表达CXCR4的BM-MSCs具有强大的化学吸引作用,其与CXCR4的特异结合有利于BM-MSCs的定向趋化。增强受损肾组织SDF-1的表达,将有助吸引移植干细胞的肾脏归巢。
已有文献报道EPO干预可增强急性心肌梗塞模型大鼠缺血组织中 SDF-1的表达[15,16]。本研究中移植组与 AKI组 SDF-1水平无差异,表明BM-MSCs移植本身对肾组织SDF-1表达无影响,但在移植基础上结合EPO皮下注射,可见SDF-1蛋白水平显著升高,且与单纯EPO干预组相比无显著差异,文献报道EPO可能是通过EPOR增强损伤组织中 SDF-1的分泌[17]。这将有助增强对表达有CXCR4的移植BM-MSCs的定向趋化。
既然EPO可以促进移植BM-MSCs的肾向归巢,那么在植入有限数量BM-MSCs治疗AKI时,联合EPO干预,势必可以增加肾脏中移植细胞的数量,从而有更多BM-MSCs通过分化及旁分泌作用发挥促进肾脏修复效能[18,19]。我们的实验证实了这一推测,BM-MSCs移植+EPO干预组小鼠肾小管上皮组织中BrdU+细胞的比例显著高于单纯BM-MSCs移植组,部分时间点差异具有统计学意义。但有趣的是术后第14d EPO干预 +BM-MSCs移植组BrdU+细胞百分比反而降低,我们推测这是因为随着移植时间延长,移植细胞的旁分泌效应导致自身修复的RTECs增多,使得百分比减小。
因此,我们认为在BM-MSCs移植治疗AKI时,联合EPO干预将放大其移植修复效果。我们的研究也证实了这一点,单纯BM-MSCs移植组移植后第3d,小鼠BUN、SCr及ATN评分显著低于AKI组,但随移植时间延长,下降趋势逐渐减弱;但EPO干预+BM-MSCs移植组在移植后第3d起的各时间点BUN、SCr及ATN评分均显著低于AKI组小鼠。随着移植时间延长,联合治疗组小鼠的BUN、SCr水平及ATN评分均显著低于单纯BM-MSCs移植组及EPO干预组,其对肾脏修复效应并非BM-MSCs移植及EPO干预两者作用的简单叠加。
综上,我们认为联合EPO注射和BM-MSCs移植可能是治疗AKI一种新的有效手段,加速推动BM-MSCs移植在临床的应用。
1 Yeagy BA,Cherqui S.Kidney repair and stem cells:a complex and controversial process.Pediatr Nephrol,2011,26(9):1427-1434.
2 Chhabra P,Brayman KL.The use of stem cells in kidney disease.Curr Opin Organ Transplant,2009,14(1):72-78.
3 Morigi M,Introna M,Imberti B,et al.Human bone marrow mesenchymal stem cells accelerate recovery of acute renal injury and prolong survival in mice.Stem Cells,2008,26(8):2075-2082.
4 Shen L,Gao Y,Qian J,et al.A novel mechanism for endothelial progenitor cells homing:The SDF-1/CXCR4-Rac pathway may regulate endothelial progenitor cells homing through cellular polarization.Med Hypotheses,2011,76(2):256-258.
5 Rjiba-Touati K,Boussema IA,Belarbia A,et al.Protective effect of recombinant human erythropoietin against cisplatin-induced oxidative stress and nephrotoxicity in rat kidney.Int J Toxicol,2011,30(5):510-517.
6 Yang FL,Subeq YM,Chiu YH,et al.Recombinant human erythropoietin reduces rhabdomyolysis-induced acute renal failure in rats.Injury,2012,43(3):367-373.
7 Rathod DB,Salahudeen AK.Nonerythropoietic properties of erythropoietin:implication for tissue protection.J Investig Med,2011,59(7):1083-1085.
8 Liu N,Tian J,Wang W,et al.Effect and mechanism of erythropoietin on mesenchymal stem cell proliferation in vitro under acute kidney injury microenvironment.Exp Biol Med(Maywood),2011,236(9):1093-1099.
9 Nagasawa T,Kilkutani H,Kishimoto T.Molecular cloning and structure of a pre-B-cell growth-stimulating factor.Proc Natl Acad Sci USA,1994,91(6):2305-2309.
10 Horuk R.Chemokines beyond inflammation.Nature,1998,393(6685):524-525.
11 Li N,Lu X,Zhao X,et al.Endothelial nitric oxide synthase promotes bone marrow stromal cell migration to the ischemic myocardium via upregulation of stromal cell-derived factor-1alpha.Stem Cells,2009,27(4):961-970.
12 Lai P,Li T,Yang J,et al.Upregulation of stromal cell-derived factor 1(SDF-1)expression in microvasculature endothelial cells in retinal ischemia-reperfusion injury.Graefes Arch Clin Exp Ophthalmol,2008,246(12):1707-1713.
13 Ohnishi H,Mizuno S,Nakamura T.Inhibition of tubular cell proliferation by neutralizing endogenous HGF leads to renal hypoxia and bone marrow-derived cell engraftment in acute renal failure.Am J Physiol Renal Physiol,2008,294(2):F326-335.
14 Ji JF,He BP,Dheen ST,et al.Interations of chemokines and chemokine receptors mediate the migration of mesenchymal stem cells to the impaired site in the brain after hypoglossal nerve injury.Stem Cells,2004,22(3):415-427.
15 Lin JS,Chen YS,Chiang HS,et al.Hypoxic preconditioning protects rat hearts against ischaemia-reperfusion injury:role of erythropoietin on progenitor cell mobilization. J Physiol,2008,586 (Pt 23):5757-5769.
16 Klopsch C,Furlani D,Gäbel R,et al.Intracardiac injection of erythropoietin induces stem cell recruitment and improves cardiac functions in a rat myocardial infarction model.JCell Mol Med,2009,13(4):664-679.
17 Brunner S,Winogradow J,Huber BC,et al.Erythropoietin administration after myocardial infarction in mice attenuates ischemic cardiomyopathy associated with enhanced homing of bone marrowderived progenitor cells via the CXCR-4/SDF-1 axis.FASEB J,2009,23(2):351-361.
18 刘楠梅,田 军,王巍巍,等.急性肾损伤微环境对培养骨髓间充质干细胞分化及分裂增殖的影响.肾脏病与透析肾移植杂志,2010,19(5):435-439.
19 刘楠梅,田 军,程 劲,等.骨髓间充质干细胞干预对缺血再灌注致小鼠肾小管上皮细胞损伤的保护作用.中华实验外科杂志,2011,28(6):883-886.
