轻链检测在慢性肾脏病中的应用评估
2022-07-13史德宝潘亚萍王中新徐元宏吕礼应
史德宝,卢 敏,潘亚萍,李 聪,王中新,徐元宏,吕礼应
轻链可与重链组装生成免疫球蛋白,根据其结构和恒定区抗原性差异分为κ和λ轻链,少量轻链可以游离状态释放入血,称为血游离轻链(serum free light chain, sFLC)。总轻链是指血或尿中结合和游离的轻链总和,总轻链及游离轻链常用于浆细胞疾病的辅助诊断及治疗监测。sFLC通过肾小球滤过而从血中快速清除,后被近端小管重吸收分解,轻链水平较为恒定。而日常工作中,常发现慢性肾脏病(chronic kidney disease, CKD)患者,轻链异常率较高。研究[1]指出CKD中,可观察到sFLC的积累。因此,排除单克隆sFLC对肾脏的损害外,多克隆的sFLC在CKD中也有重要价值。目前,研究多关注sFLC与CKD分期及病死率的相关性[1-3],而与血总轻链(serum total light chain, sTLC)、尿总轻链(urine total light chain, uTLC)的联合比较,以及在CKD分期预测性能差异少有文献提及。该研究旨在分析CKD患者各分期轻链水平的差异及其与肾功能指标的相关性及评估各轻链指标预测CKD分期的价值差异。
1 材料与方法
1.1 病例资料回顾性分析安徽医科大学第一附属医院高新院区2018年1—12月期间住院的CKD患者292例,其中男性169例,女性123例,年龄21~86岁(中位年龄52岁),入选患者排除急性肾损伤、肿瘤性疾病、感染性疾病、免疫系统疾病,其中浆细胞疾病通过免疫分型检测结合临床诊断联合排除。将所有病例根据估算肾小球滤过率(estimated glomerular filtration rate, eGFR)分为5组:CKD1期[eGFR≥90 ml/(min·1.73 m2)]62例,CKD2期[eGFR 60~89 ml/(min·1.73 m2)]26例,CKD3期[eGFR 30~59 ml/(min·1.73 m2)]87例,CKD4期[eGFR 15~29 ml/(min·1.73 m2)]47例,CKD5期[eGFR<15 ml/(min·1.73 m2)]70例。以CKD1~2期合并为对照组,CKD3~5期合并为病例组,分析各轻链指标在CKD分期预测价值。
1.2 仪器与试剂轻链检测包括sTLC、uTLC及sFLC,采用德国Siemens BN Ⅱ SYSTEM特殊蛋白分析仪测定;总蛋白(total protein, TP)、白蛋白(albumin, ALB)、血肌酐(serum creatinine, Scr)及尿素氮(blood urea nitrogen,BUN)采用美国Beckman AU5800全自动生化分析仪检测;免疫球蛋白免疫分型采用法国sebia毛细管电泳检测。所有患者采集清晨空腹肘部静脉血及晨尿进行检测。检测试剂、质控及校准均为仪器配套。eGFR计算采用CKD-EPI 4种族公式中适合亚洲人群(Asia)[4]的评估公式。研究方案通过安徽医科大学第一附属医院伦理委员会批准(编号:PJ2019-04-16)。

2 结果
2.1 研究个体的临床及生物学特征表1结果显示,CKD1~5期组,多组间比较,sTLC κ、sTLC λ、sTLC κ/λ、sFLC κ/λ差异无统计学意义(P>0.05);而TP、ALB、Scr、BUN、eGFR、sFLC κ、sFLC λ、uTLC κ、uTLC λ、uTLC κ/λ差异有统计学意义(P<0.05)。随着CKD分期期次的增加,sFLC κ、sFLC λ、uTLC κ、uTLC λ水平也逐渐增高。见图1。

表1 CKD患者的临床及生物学特征[M(P25,P75)]
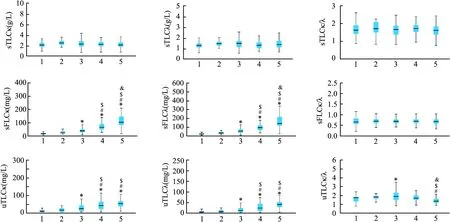
图1 CKD各分期血尿轻链及游离轻链水平箱线图
2.2 轻链结果与肾功能指标相关性分析表2结果显示,尿轻链(uTLC κ、uTLC λ)、血游离轻链(sFLC κ、sFLC λ)与Scr、BUN呈正相关(P<0.001),与eGFR负相关(P<0.001)。且sFLC κ、sFLC λ与Scr、BUN、eGFR的相关性(sFLC κ:rs=0.839、0.799、-0.862;sFLC λ:rs=0.837、0.812、-0.862,P<0.001)优于uTLC κ、uTLC λ(uTLC κ:rs=0.657、0.582、-0.662;uTLC λ:rs=0.665、0.592、-0.674,P<0.001)。总轻链(sTLC κ、sTLC λ)、sTLC κ/λ、sFLC κ/λ与肾功能指标无显著相关性。

表2 轻链与肾功能指标间相关性分析(r)
2.3 ROC曲线以CKD1~2期合并作为对照组,sFLC κ、sFLC λ预测CKD3~5期病例组,ROC曲线分析最佳临界点为35.4、52.8 mg/L,AUC分别为0.916(0.883~0.949)、0.915(0.881~0.949),敏感度分别为0.825、0.799,特异度分别为0.886、0.899。 uTLC κ、uTLC λ预测CKD3~5期病例组,最佳临界点为26.3、15.1 mg/L,AUC分别为0.811(0.754~0.869)、0.787(0.728~0.846),敏感度分别为0.698、0.651,特异度分别为0.835、0.835。见表3和图2。

图2 血尿轻链及游离轻链预测CKD分期的ROC曲线

表3 轻链指标预测CKD分期的ROC曲线分析
3 讨论
轻链及游离轻链检测常用于浆细胞疾病的辅助诊断及治疗评估[5]。研究显示,sFLC能够通过抑制自发凋亡来调节多形核白细胞的功能[6],也能降低中性粒细胞的趋化性和葡萄糖摄取[7]。多克隆sFLC在CKD患者中可出现累积,可能的机制包括多克隆产物增多、肾脏清除减少,或两种机制的共同作用,较高的sFLC水平与CKD患者较高的病死率和终末期肾病风险独立相关[8]。以往文献少有将血轻链、尿轻链及游离轻链联合分析,以及评估轻链指标在CKD分期预测价值差异。流行病学调查显示,每年中国CKD的发病率约为5%左右,而患病率已达10.8%,接近发达国家水平[9],其防治已成为世界各国所面临的重要公共卫生问题[10]。该研究综合评估了血轻链、尿轻链及游离轻链在CKD中差异及在CKD分期预测中价值。
该研究显示,CKD1~5期,随着CKD分期期次的增加,sFLC κ、sFLC λ逐渐增高,与以往研究[1-2,11]结果近似。该研究也显示uTLC κ、uTLC λ也随着CKD分期期次的增加而增加,其可能的机制是完整的免疫球蛋白分子无法通过完整的肾小球滤过屏障,而游离的免疫球蛋白及轻链可通过肾小球滤过,并在肾小管重吸收,而随着CKD疾病进展,肾小球基底膜受损增加,尿液中轻链排出增加导致。然而,CKD1~5期多组间比较,sTLC κ、sTLC λ差异无统计学意义,推测其机制为血总轻链包括免疫球蛋白重链结合的轻链以及未结合的游离轻链,而结合状态的轻链浓度要远高于游离轻链,因此,总轻链血清浓度是由完整的免疫球蛋白分子浓度决定,其克隆性增殖(多克隆或单克隆性质)或减少会导致轻链的浓度升高或降低,故血总轻链与CKD分期相关性差。该研究中,CKD1~5期多组间比较分析显示,sTLC κ/λ、sFLC κ/λ差异均无统计学意义(P=0.284、0.946)。
轻链结果与肾功能指标相关性分析结果表明,血游离轻链(sFLC κ、sFLC λ)、尿轻链(uTLC κ、uTLC λ)与Scr、BUN呈正相关(P<0.001),与eGFR负相关(P<0.001),并且血游离轻链与肾功能指标相关性要高于尿轻链结果。sTLC κ/λ、sFLC κ/λ与肾功能指标相关性差异无统计学意义(P>0.05)。虽然尿轻链比值uTLC κ/λ与肾功能指标呈弱相关(r=-0.238、-0.227、0.246,P<0.001),但相关性系数较小,在CKD分期预测价值有限,可见轻链比值在CKD分期中价值不显著。当多克隆免疫球蛋白增多和(或)肾脏功能受损时,血清中的κ和λ型轻链会同时增加,因此κ/λ不变,而肿瘤性浆细胞会过量产生一种单克隆免疫球蛋白轻链,而同时骨髓对于另一种轻链的生成不变,因此κ/λ会明显异常。而尿液中κ/λ值因为非肿瘤细胞产生的轻链量很低不能持续地通过肾单位,而不如血清可靠。
CKD是各种原因引起的肾脏结构和功能障碍引起肾小球滤过率下降,其中CKD1~2期患者,eGFR正常或轻度下降,而CKD3期患者,eGFR轻到中度下降,是临床干预及进行相关治疗的关键节点。故该研究以CKD1~2期作为对照组,CKD3~5期为病例组,来比较各指标在CKD分期中的预测价值,sFLC κ、sFLC λ最佳临界点为35.4、52.8 mg/L,AUC分别为0.916、0.915,要高于uTLC κ、uTLC λ(AUC:0.811、0.787),其最佳临界点26.3、15.1 mg/L。以上研究表明sFLC κ、sFLC λ在CKD分期中的预测价值高于uTLC κ、uTLC λ。因此,当sFLC κ>35.4 mg/L、sFLC λ>52.8 mg/L时,相当于CKD进展至CKD3期,应当给予相应的临床干预。
综上所述,随着CKD分期期次的增加,sFLC、uTLC水平逐渐增加;sFLC、uTLC能够有效预测出CKD3期以上患者,对CKD患者分层管理具有重要参考价值。sFLC在肾功能相关性及CKD分期预测价值上均高于uTLC。sTLC、各轻链比值与肾功能指标相关性差,在CKD分期预测方面价值有限。
