尿中肾损伤分子1水平升高对大鼠早期肾损伤的预测作用
2012-11-12张金晓高绪聪张建军张宗鹏
申 俊,刘 妍,张金晓,高绪聪,周 飞,姜 凌,张建军,张宗鹏
(1.天津中医药大学研究生部,天津 300193;2.天津市新药安全评价研究中心毒理学研究室,天津 300193)
肾是体内最重要的排泄器官,也是外源性毒物在体内的主要代谢器官之一。很多化合物或药物进入体内,通过某种或几种机制对肾脏产生毒性作用。目前,传统并常规用来检测肾损伤的生物标志物是血清肌酐(serum creatinine,SCr)和血尿素氮(blood urea nitrogen,BUN),但两者只有在肾损伤达一定程度时才会明显升高。SCr和BUN的这种不敏感性可能会使药物顺利通过临床前安全性评价,而在临床试验阶段或者上市后临床应用阶段导致患者肾损伤。因此,寻找早期、敏感和可量化的肾损伤生物标志物是新药开发和临床治疗的迫切需求。
肾损伤分子1(kidney injury molecule-1,KIM-1)又被称为T细胞免疫球蛋白和黏蛋白分子1或A型肝炎病毒细胞受体1,是一种Ⅰ型跨细胞膜糖蛋白,存在于CD4+T细胞和肾近曲小管上皮细胞内[1]。在正常肾组织中,KIM-1表达非常低,但是在不同的药物或者环境毒物导致的肾功能损伤模型中,KIM-1会在去分化的肾脏近曲小管上皮细胞中高表达,并可以在尿中排出[2]。目前,KIM-1是研究较多的早期预测肾损伤的生物标志物[3-4]。2008年美国食品药品监督局和欧洲医药评价署宣布可将KIM-1用于药物临床前研究[5],但仍需广泛验证。本研究制备顺铂、庆大霉素和环孢素诱导肾损伤大鼠模型,检测尿 KIM-1、尿肌酐(urine creatinine,UCr)、SCr和BUN以及肾脏组织病理变化,评价尿KIM-1作为早期预测肾损伤敏感生物标志物的可能性,为其作为临床前肾损伤的评价指标提供依据,并为临床前新药的安全性评价提供参考。
1 材料与方法
1.1 动物、试剂和仪器
健康雄性SD大鼠,SPF级,体质量250~300 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SCXK(京)2006-0009,自由摄食和饮水,室温20~26℃,湿度40%~70%,光照条件:12 h明/12 h暗。顺铂(cisplatin)和硫酸庆大霉素(gentamicin sulfate),Sigma公司;环孢素(ciclosporine)软胶囊,诺华制药公司;大鼠KIM-1 ELISA试剂盒,美国R&D公司;SCr,BUN和UCr检测试剂,北京中生北控生物技术科技股份有限公司。Sunrise酶标仪,奥地利TECAN公司;Olympus BX51普通光学显微镜,日本Olympus公司;Canon power shat S45病理显微摄影,日本Canon公司;7080全自动生化分析仪,日立公司。
1.2 顺铂肾损伤模型的制备[6]和标本采集
大鼠48只,经适应性饲养4 d后,随机分为8组(每个时间点对应1个正常对照组和1个顺铂肾损伤模型组,共4个时间点),每组6只,正常对照组ip给予生理盐水,模型组 ip给予顺铂7.5 mg·kg-1,给药1次,给药体积为5 ml·kg-1。于单次给药后第2,4,5和6天置于代谢笼内收集24 h尿液,隔日ip给予苯妥英钠麻醉取全血。
1.3 庆大霉素肾损伤模型的制备[1,6]及标本采集
大鼠48只,经适应性饲养18 d后,随机分为8组(每个时间点对应1个正常对照组和1个庆大霉素肾损伤模型组,共4个时间点),每组6只,正常对照组ip给予生理盐水,模型组ip给予庆大霉素120 mg·kg-1,每天给药 1 次,连续给药12 d,给药体积为5 ml·kg-1。于首次给药后第 2,6,9 和 12 天置于代谢笼内收集24 h尿液,隔日ip给予苯妥英钠麻醉后取全血。
1.4 环孢素肾损伤模型的制备[6-7]及标本采集
大鼠48只,经适应性饲养5 d后,随机分为8组(每个时间点对应1个正常对照组和1个环孢素肾损伤模型组,共4个时间点),低盐饮食,第1~22天ig给予环孢素(取适当的橄榄油溶解环孢素配制成所需浓度)3 mg·kg-1,给药体积为 10 ml·kg-1;第23~43天改为sc给予环孢素 7 mg·kg-1;第44~52天 sc 给 予 环 孢 素 12 mg·kg-1,给 药 体 积 为2.5 ml·kg-1,正常对照组 ig 给予橄榄油。于首次给药后第7,14,35和52天置于代谢笼内收集24 h尿液,隔日ip给予苯妥英钠麻醉后取全血。
1.5 SCr,BUN,UCr和尿 KIM-1的检测
大鼠尿液和血标本,于1500×g离心10 min,分别取上清用于UCr、尿KIM-1、SCr和BUN的检测。SCr,BUN和UCr使用自动生化仪进行检测;尿液KIM-1使用KIM-1 ELISA试剂盒检测,操作步骤按试剂盒说明书进行,经酶标仪检测并读取450 nm波长的吸光度(absorbance,A)值,以 A450nm值为纵坐标,标准品浓度为横坐标绘制曲线,根据样品的A450nm查找其浓度范围。尿KIM-1含量用尿KIM-1/UCr比值(mg·mol-1)表示,即每排出 1 mol肌酐排出 KIM-1 的毫克数[8]。
1.6 大鼠肾组织病理学观察
顺铂组大鼠于单次给药后第3,5,6和7天;庆大霉素组大鼠于首次给药后第3,7,10和13天;环孢素组大鼠于首次给药后第8,15,36和53天处死大鼠,摘取肾,10%中性甲醛固定,常规石蜡包埋、切片和HE染色,于普通光学显微镜下观察肾组织病理变化。
1.7 统计学分析
2 结果
2.1 顺铂对大鼠SCr,BUN和尿KIM-1水平的影响
表1结果显示,与正常对照组比较,于单次给顺铂后第3,5和6天,SCr,BUN和尿KIM-1均明显升高(P<0.05);第7 天,BUN 明显升高(P<0.05),SCr和尿KIM-1由于标准差较大,虽有升高趋势但无统计学差异。尿KIM-1随药后时间延长,其升高幅度大于SCr和BUN,4个时间点分别升高为正常对照组的5.7,11.0,9.7 和17.5 倍;SCr为正常对照组的1.3,2.9,4.3 和 2.2 倍;BUN 为正常对照组的 1.7,4.0,6.1 和 4.0 倍。由图 1 显示,SCr,BUN和尿KIM-1给药后不同时间点ROC的曲线下面积(area under curve,AUC)分别为 0.934,0.953 和0.979。可以看出,尿KIM-1与SCr和BUN相比在顺铂所致肾损伤模型中具有较好的灵敏度和特异性。
2.2 庆大霉素对大鼠SCr,BUN和尿KIM-1水平的影响
首次给药后第7天,SCr和BUN未见明显升高,尿KIM-1有升高趋势;第10和13天,模型组分别仅1只和2只大鼠SCr和BUN与正常对照组相比明显升高,而尿KIM-1均较正常对照组明显升高(P<0.05);且尿KIM-1随给药时间的延长,与SCr和BUN比较升高幅度更为明显,3个时间点升高倍数分别为正常对照组的2.6,13.5和34.9倍;SCr为正常对照组的 1.1,1.7 和 1.6 倍,BUN 为正常对照组的1.0,2.0和1.9 倍(表2)。由图2 显示,SCr,BUN和尿KIM-1给药后不同时间点ROC曲线的 AUC 分别为0.877,0.713和 0.932。可以看出尿KIM-1与SCr和BUN比较在庆大霉素所致肾损伤大鼠模型中具有更好的灵敏度和特异性。

Tab.1 Changes of serum creatinine(SCr),blood urea nitrogen(BUN)and urinary kidney injury molecule-1(KIM-1)levels in rats with kidney injuries induced by cisplatin

Fig.1 Receiver operating characteristic(ROC)curve for SCr,BUN and urinary KIM-1 at different times after ip given cisplatin 7.5 mg·kg -1.See Tab.1 for rat treatments.AUC:area under curve.
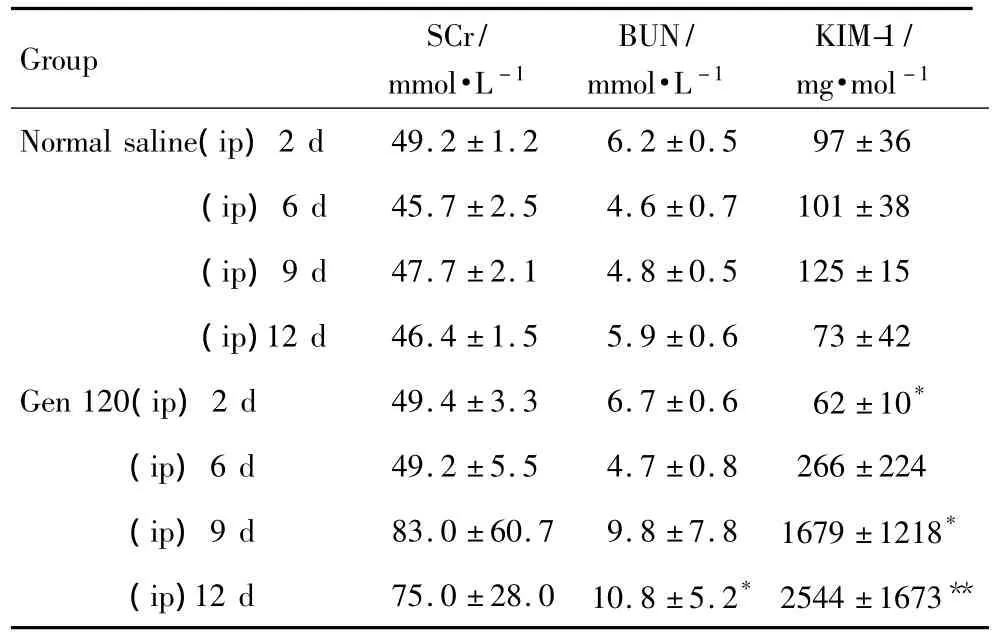
Tab.2 Changes of SCr,BUN and KIM-1 levels of rats with kidney injuries induced by gentamicin(Gen)

Fig.2 ROC curve for SCr,BUN and urinary KIM-1 at different times injected with 120 mg·kg-1gentamicin for 12 d.See Tab.2 for rat treatments.
2.3 环孢素对大鼠SCr,BUN和尿KIM-1水平的影响
由表3看出,首次给药后第8天,SCr和BUN水平均未见明显改变,尿KIM-1明显高于正常对照组(P<0.05);第15和36天,BUN和尿KIM-1显著高于正常对照组,SCr未见明显改变;第53天,SCr,BUN和尿KIM-1均明显升高(P<0.01)。尿KIM-1随给药时间延长,比SCr和BUN升高幅度更为明显,4个时间点升高倍数分别为正常对照组的 1.6,2.7,5.3和10.3倍,SCr分别为正常对照组的 1.1,1.0,1.0 和1.2 倍,BUN 分别为正常对照组的0.8,1.4,1.6 和2.2倍。由图3所示,SCr,BUN和尿KIM-1给药后不同时间点ROC曲线的AUC分别为0.668,0.766和0.976。可见尿KIM-1与SCr和BUN相比具有更好的灵敏度和特异性。

Tab.3 Changes of SCr,BUN and KIM-1 levels of rats with kidney injuries induced by ciclosporine(Cyc)

Fig.3 ROC curve for SCr,BUN and urine KIM-1 at different times after administrated with ciclosporine for 52 d.See Tab.3 for rat treatments.
2.4 顺铂对大鼠肾组织病理变化的影响
图4 显示,正常对照组大鼠肾组织无明显病理改变(图4A),模型组单次给药后第5天(图4B),第6天(图4C)和第7天(图4D)肾组织均出现程度不等的皮髓交界处部分肾小管扩张,肾小管上皮细胞变性、坏死脱落,基底膜裸露,腔内有大量红染无结构的颗粒状物质,较多肾小管腔内有蛋白管型。
2.5 庆大霉素对大鼠肾组织病理变化的影响
图5显示,正常对照组大鼠肾组织无明显病理改变(图5A);而模型组首次给药后第10天(图5B)和第13天(图5C),肾脏组织可见肾小管扩张、变性、坏死和蛋白管型等病理改变。
2.6 环孢素对大鼠肾组织病理变化的影响
图6显示,正常对照组大鼠肾组织无明显病理改变(图6A);而模型组首次给药后第53天所有大鼠肾组织可见较多肾小管变性,胞浆疏松淡染,严重者出现空泡样,较多肾小管嗜碱性变,胞浆淡染,胞核增大嗜碱性增强。

Fig.4 Effect of cisplatin on histopathological changes of kidneys in rats(HE ×400).See Tab 1 for rat treatments.A:normal control group;B:model group,on the 5th day after cisplatin was once ip treated(Arrow shows:tubular degeneration and necrosis);C:model group,on the 6th day after cisplatin was once ip treated(Arrow shows:protein casts);D:model group,on the 7th day after cisplatin was once ip treated(Arrow shows:tubular regeneration and dilatation).

Fig.5 Effect of gentamicin on histopathological changes of kidneys in rats(HE ×400).See Tab 2 for rat treatments.A:normal control group;B:model group,on the tenth days after gentamicin was first ip treated(Arrow shows:tubular degeneration and necrosis);C:model group,on the thirteenth days after gentamicin was first ip treated(Arrow shows:protein casts).

Fig.6 Effect of ciclosporine on histopathological changes of kidneys in rats(HE ×400).See Tab 3 for rat treatments.A:normal control group;B:model group,on the 53rd day after ciclosporine was first ip treated(Arrow shows:tubular degeneration);C:model group,on the 53rd day after ciclosporine was first ip treated(Arrow shows:tubular regeneration).
3 讨论
SCr和BUN是反映肾损伤最主要的生物标志物[9-10],是临床前安全性评价中常规的检测指标[6],但有下列局限:① SCr易受年龄、性别、种族、饮食和机体内环境等因素影响;②SCr常于肾组织学改变达50%以上时升高,无法预测早期病变;③SCr血液蓄积只与肾小球滤过率降低相关,不能反映肾小管损伤和坏死;④ BUN不仅受肾功能的影响,还受肾外因素的影响,如高蛋白饮食、消化道出血及高分解代谢等。因此,SCr和BUN在检测肾功能方面显示出明显的不准确性和滞后性。
KIM-1是肾脏近曲小管上皮细胞表达的一种跨膜蛋白,在正常肾组织中表达水平极低,但在肾损伤因素的作用下,可特征性升高,表达于肾损伤的肾小管上皮细胞顶膜并持续到细胞损伤完全修复。KIM-1的胞外功能区受金属基质蛋白酶的调节,可裂解并释放入尿。KIM-1的上述特性,使它可能成为一种检测肾损伤的理想生物标志物。尿中KIM-1水平采用UCr加以校正,可以校正因尿量变化对KIM-1含量的影响。
顺铂的肾毒性机制包括引起肾血管收缩,使肾血流量及肾小球滤过率下降,从而引起蛋白尿和肾功能损伤等症状;引起近端肾小管上皮细胞缺血、缺氧甚至坏死[3]。庆大霉素的肾毒性机制有溶酶体损伤学说和线粒体损伤学说等,主要表现为近端肾小管S1段和S2段的上皮细胞变性坏死,坏死多成局灶性,坏死灶周围可有炎症细胞浸润[4]。环孢素是一种强效的免疫抑制剂,肾毒性是其严重的不良反应之一,主要通过前列腺素代谢失衡和肾素-血管紧张素系统激活等导致肾细胞、组织和器官的损伤[6]。
在本实验顺铂所致的肾损伤模型中,于单次给药后第3天,病理显示除部分大鼠肾小管腔内有蛋白管型外,未见其他明显病变,此时SCr和BUN水平略有升高,而KIM-1明显升高,表明在肾组织发生轻微病变时,KIM-1较SCr和BUN相比即表现出明显的升高;第5天,肾组织皮髓交界处开始出现部分肾小管扩张,肾小管上皮细胞变性、坏死脱落,基底膜裸露,并随药后时间延长,损伤程度加重,SCr和BUN随病变的加重表现为先高后低的趋势,而KIM-1随药后时间延长,持续大幅度升高,与肾损伤程度呈一致性。庆大霉素所致的肾损伤模型中,在第10天,肾组织出现明显病变,表现为部分大鼠肾小管变性、坏死、蛋白管型和肾小管扩张,间质较多炎症细胞浸润等,此时SCr和BUN也开始明显升高,而KIM-1在给药后第7天,已经开始有升高趋势;随着给药时间的延长,肾组织病变加重,KIM-1持续明显升高,至第13天时,升高到正常对照组的34.9倍,而SCr和BUN升高水平与第10天时持平。环孢素所致的肾损伤模型中,于首次给药后第53天,肾组织出现明显的病理改变,表现为肾小管变性,胞浆疏松淡染,严重者出现空泡样,较多肾小管嗜碱性变;SCr和BUN分别于第15天和第53天出现升高,而KIM-1在第8天时开始明显升高,早于SCr和BUN升高及病理改变,并随给药时间延长持续明显升高。根据上述结果可以认为,在不同药物造成的肾损伤中,尿KIM-1在未出现或仅出现轻微病理改变时即明显升高,与肾损伤程度表现出良好的正向相关性。与SCr和BUN相比,尿KIM-1升高更早且升高幅度更为明显。
本研究采用ROC曲线下AUC分析SCr,BUN和尿KIM-1的灵敏度和特异性,显示3个药物模型组尿KIM-1的AUC值均最高,在0.9以上,表明尿KIM-1在灵敏度和特异性方面优于SCr和BUN。
综上所述,KIM-1相比于传统的生物标志物SCr和BUN,在评估药物诱导的肾毒性中,不仅具有更好的灵敏度和特异性,而且能够对肾损伤进行早期预测,并有助于确定肾损伤部位。在新药的临床前开发阶段,可更准确地预测候选药物的肾毒性,有利于早期鉴别、尽快淘汰有潜在肾毒性的化合物,减少新药开发中不必要的时间和成本的耗费。
[1]Zhou YZ,Vaidya VS,Brown RP,Zhang J,Rosenzweig BA,Thompson KL,et al.Comparison of kidney injury molecule-1 and other nephrotoxicity biomarkers in urine and kidney following acute exposure to gentamicin,mercury,and chromium[J].Toxicol Sci,2008,101(1):159-170.
[2]Ichimura T,Bonventre JV,Bailly V,Wei H,Hession CA,Cate RL,et al.Kidney injury molecule-1(KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury[J].J Biol Chem,1998,273(7):4135-4142.
[3]Liangos O,Tighiouart H,Perianayagam MC,Kolyada A,Han WK,Wald R,et al.Comparative analysis of urinary biomarkers for early detection of acute kidney injury following cardiopulmonary bypass[J].Biomarkers,2009,14(6):423-431.
[4]Han WK,Bailly V,Abichandani R,Thadhani R,Bonventre JV.Kidney Injury Molecule-1(KIM-1):a novel biomarker for human renal proximal tubule injury[J].Kidney Int,2002,62(1):237-244.
[5]Bonventre JV,Vaidya VS,Schmouder R,Feig P,Dieterle F.Next-generation biomarkers for detecting kidney toxicity[J].Nat Biotechnol,2010,28(5):436-440.
[6]Vaidya VS,Ozer JS,Dieterle F,Collings FB,Ramirez V,Troth S,et al.Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies[J].Nat Biotechnol,2010,28(5):478-485.
[7]Feria I,Pichardo I,Juárez P,Ramírez V,González MA,Uribe N,et al.Therapeutic benefit of spironolactone in experimental chronic cyclosporine A nephrotoxicity[J].Kidney Int,2003,63(1):43-52.
[8]Qin XG.Several attentive problems during application of urine creatinine ratio[J].Chin J Lab Med(中华医学检验杂志),1991,14(5):279-282.
[9]Ozbek E,Cekmen M,Ilbey YO,Simsek A,Polat EC,Somay A.Atorvastatin prevents gentamicin-induced renal damage in rats through the inhibition of p38-MAPK and NF-kappaB pathways[J].Ren Fail,2009,31(5):382-392.
[10]Zhou D,Sun W.The research status of kidney toxicity mechanism of cisplatin and its prevention[J].Chin J Integrated Tradit West Nephrol(中国中西医结合肾病杂志),2004,5(10):617-618.
