当归多糖对幼年大鼠染铅所致贫血的治疗作用
2012-11-12刘佩意让蔚清
田 丹,王 敏,李 程,王 穆,谭 伟,刘佩意,让蔚清
(南华大学公共卫生学院环境医学与放射卫生研究所卫生毒理学研究室,湖南衡阳 421001)
铅中毒是发病率高、影响人群广的几种职业病和公害病之一,而且铅中毒人群有幼龄化的倾向,目前倍受关注。铅对人体的损害主要表现在造血系统、神经系统、肝、肾和骨骼等[1-2],其中血液系统是对铅毒性最为敏感的靶系统之一[2],铅对血液系统的毒性作用主要表现为贫血,其发生机制有多种学说,主要与血红蛋白(hemoglobin,Hb)合成障碍和红细胞(red blood cell,RBC)寿命缩短有关。铅毒性所致的贫血治疗主要集中在营养素驱铅法、抗氧化剂驱铅法和吸附剂肠道驱铅法等,但这些常规方法疗效单一,不能排除RBC的铅,治疗效果有限。国内外对铅中毒临床治疗药物以络合剂为主,药物作用特异性低,排铅同时还非特异性地排泄内源性必需微量元素钙和锌及维生素,影响机体正常生理和生化功能,且对肾有一定损害。当归是常见治疗贫血的传统中药,当归多糖(Angelica polysaccharide,APS)是当归中促进造血的有效活性成分之一,来源为伞形科植物当归〔Angelica sinensis(Oliv.)Diels〕的干燥根。APS可以改善大鼠RBC功能,增加Hb的含量[3]。本研究制备幼年大鼠中度铅中毒贫血模型后在APS干预,检测血铅(blood lead,BPb)含量、Hb、RBC、血细胞比容(hematocrit,Hct)和锌原卟啉(zinc original porphyrin,ZPP)及 δ-氨基乙酰丙酸脱水酶(δ-aminolevulinic acid dehydratase,ALAD)活性,为开发防治铅性贫血药物提供实验依据。
1 材料与方法
1.1 动物、药物、试剂和仪器
清洁级健康雄性SD大鼠56只,4周龄,体质量77~97 g,由南华大学动物部提供,动物合格证号:SCXK2010-0004,观察3 d无异常后开始实验。APS由陕西慈缘生物技术有限公司提供,来源为甘肃岷县当归〔Angelica sinensis(Oliv.)Diels〕,采用水煮-醇沉法从干燥当归中提取当归粗多糖,经反复冻融、离心、沉淀去除蛋白成分,进一步得到纯化的APS,所得APS为浅米灰色,无甜味,用苯酚-硫酸法测定总糖含量,纯度95%,采用凝胶渗透色谱-激光光散射联用技术分析多糖的分子质量,相对分子质量为1.2×104~1.1 ×105,采用 HPLC 鉴定多糖的单糖组分,APS主要由葡萄糖、阿拉伯糖、半乳糖、鼠李糖和木糖组成,用时以生理盐水溶解。间二巯基丁二酸(meso-2,3-dimercaptosuccinic acid,DMSA)分析纯,纯度99%,成都格雷西亚化学技术有限公司。醋酸铅,分析纯,纯度98%,北京红星化工厂生产;铅标准液,北京恒元启天化工技术研究院;肝素钠注射液,天津市生物化学制药厂生产。AB-204N型电子分析天平,上海瑞亿仪器公司;MM-200型显微镜,日本尼康公司;VIS-723G型分光光度计,北京瑞利分析仪器公司;TAS-986型原子吸收分光光度计,美国Perkin Elmer公司;雅培3700型血球分析仪,美国雅培公司;ZPP-3800型血液锌原卟啉测定仪,南京德旭仪器仪表公司;HI-3型磁力搅拌器,常州国华电器公司。
1.2 动物分组、模型制备和给药
大鼠按体质量随机分为7组,每组8只,分别为正常对照组、模型组、模型 +APS 15,30,60和120 mg·kg-1组及模型 +DMSA120 mg·kg-1组。除正常对照组外,各组大鼠 ip给予醋酸铅30 mg·kg-1,隔天1次,连续7次,建立染铅性贫血模型。APS和DMSA治疗组于末次给予醋酸铅后第2天分别ip给予APS和DMSA;APS为每天1次,连续14次;DMSA治疗组为每天1次,给3 d停4 d,共14 d。正常对照组和模型组均ip给予生理盐水。常规实验条件下饲养,各组大鼠均饲普通饲料,自由饮水。室温20~22℃,自然昼夜。实验时间共计28 d,以给予药物治疗当天为第1天,分别于给药前、给药第7天和给药第14天大鼠尾端取血,肝素钠抗凝,测定BPb和Hb含量及RBC数目。第14天处死大鼠股动脉取血,测定Hct、ALAD活性和ZPP浓度。
1.3 血铅含量的测定
血样用Triton X-100作基体改进剂,溶血后用硝酸处理,波长 283.3 nm,狭缝 1.3 nm,灯电流7.5 mA,用石墨炉原子吸收光谱法测定[4]。
1.4 血红蛋白含量测定和红细胞计数
采用氰化高铁血红蛋白法[5]测定。取肝素钠抗凝血20 μl加到5 ml氰化高铁血红蛋白试剂中,充分混匀,静置5 min,于分光光度计540 nm处,1 cm光径比色杯,以蒸馏水作空白管,测测定管吸光度(absorbance,A),Hb 浓度(g·L-1)=A540nm×367.7。红细胞计数用细胞计数板,在光学显微镜下计数。
1.5 血细胞比容和锌原卟啉浓度的测定
大鼠颈动脉取血,肝素钠抗凝,取抗凝血0.5 ml,用血球分析仪检测Hct。ZPP浓度测定用血液荧光剂法[6]。
1.7 全血ALAD活性的测定
采用二甲氨基苯甲醛比色法[7],于155 nm波长下测A值。以蒸馏水为空白管调零,1 cm比色皿。ALAD活性(U)=〔(A样品管-A空白管)/40%〕×50×10。
1.8 统计学分析
2 结果
2.1 当归多糖对染铅大鼠血铅水平的影响
由表1可见,给药前,与正常对照组比较,模型组BPb含量显著升高,各给药组与模型组基本相近。与给药前相比,第7和14天各组BPb含量均明显降低(P<0.01),第14天明显低于第7天(P<0.01),模型组约降低了46%,APS 15,30,60和120 mg·kg-1和DMSA治疗组降低了60%~70%。第7和14天,与正常对照组相比,模型组BPb含量明显升高(P<0.01),各给药组与模型组比较均明显降低(P<0.01)。APS 15,30,60 和120 mg·kg-1组之间及APS组与DMSA组之间无显著性差异。

Tab.1 Effect of Angelica polysaccharides(APS)on blood lead(BPb)in rats exposed to lead
2.2 当归多糖对染铅大鼠血红蛋白和红细胞的影响
由表2和表3可以看出,给药前,与正常对照组比较,模型组Hb含量和RBC数目显著降低,APS和DMSA组与模型组基本相近;给药第7天和给药第14天模型组Hb含量和RBC数目与给药前相比无明显差异,各给药组与给药前相比明显增加(P<0.01);给药第14天与第7天相比亦明显增加(P<0.01)。在给药第7和14天,与正常对照组相比,模型组Hb含量和RBC数目明显降低(P<0.01),各给药组与模型组比较均明显升高(P<0.01)。APS 15,30,60 和120 mg·kg-1组之间及APS组与DMSA组之间无显著性差异。

Tab.2 Effect of Angelica polysaccharide on hemoglobin(Hb)content in rats exposed to lead

Tab.3 Effect of Angelica polysaccharides on red blood cell(RBC)number in rats exposed to lead
2.3 当归多糖对染铅大鼠血细胞比容的影响
由表4可见,给药第14天,与正常对照组相比,模型组大鼠Hct明显降低(P<0.01);与模型组相比,APS 15,30,60 和120 mg·kg-1组和 DMSA 治疗组 Hct明显增高(P<0.01)。APS 15,30,60和120 mg·kg-1组之间及各APS与DMSA治疗组之间无显著性差异。

Tab.4 Effect of Angelica polysaccharide on hematocrit(Hct)of rats exposed to lead
2.4 当归多糖对染铅大鼠δ-氨基乙酰丙酸脱水酶活性和锌原卟啉浓度的影响
由表5可见,给药第14天,与正常对照组相比,模型组大鼠ALAD活性明显降低(P<0.01);大鼠ZPP含量明显升高(P<0.01),与模型组相比,APS组和DMSA组ALAD活性均升高(P<0.01),而APS 15,30,60 和120 mg·kg-1组和 DMSA 组较模型组均降低(P<0.01)。
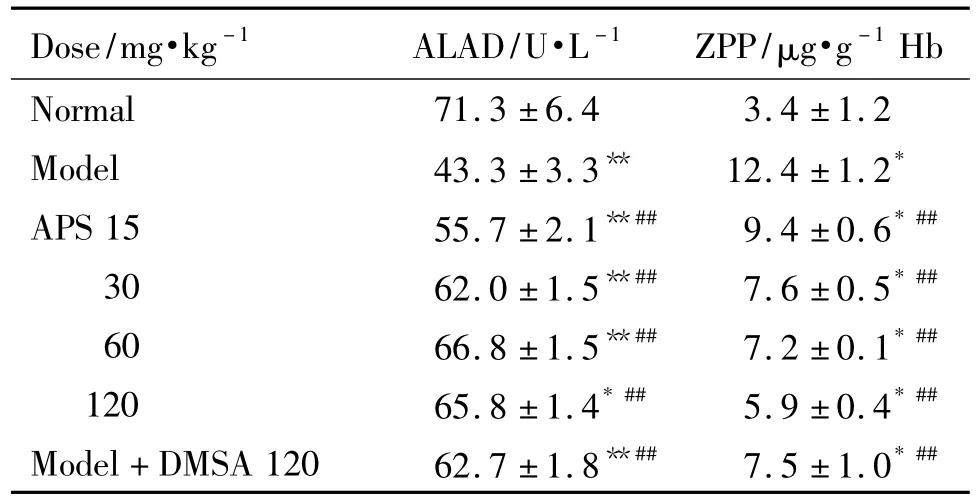
Tab.5 Effect of Angelica polysaccharide on δ-aminolevulinic acid dehydratase(ALAD)activity and zinc original porphyrin(ZPP)content of rats exposed to lead
3 讨论
儿童中度铅中毒可导致贫血,血铅超过250 μg·L-1的儿童,建议进行临床治疗[8]。本研究采用4周龄SD大鼠,相当于人幼年时期。给药第14天,各APS治疗组BPb水平和ZPP含量明显降低,表明APS对血液中的铅有促排作用,并且其作用与DMSA相当。此外,给药第14天各APS剂量治疗组BPb水平与给药第7天相比亦明显降低。APS中主要是果胶类物质[9],果胶类物质与铅离子结合,结合物不能被胃肠吸收,随粪便被排泄,造成胃肠道内铅浓度下降,促使组织和细胞中的铅向肠腔转运,从而导致BPb浓度降低。另外,果胶类物质与铅结合是有选择性的,还可以避免传统驱铅药物的非选择性络合作用所导致的微量元素丢失[10]。目前有研究表明,铅与铁在肠道有共同蛋白结合位点,具有竞争性抑制作用。APS可促进肠黏膜细胞对铁的吸收[11],拮抗机体对铅的吸收。
本研究结果还发现,给药第14天各APS剂量治疗组Hb,RBC,Hct和ALAD活性均明显升高,其作用与DMSA 120 mg·kg-1相近。另外,给药第14天与与给药第7天相比,各APS剂量治疗组Hb和RBC亦明显升高。上述结果提示,APS有可能可通过降低血铅水平,保护合成Hb的酶活性,并保护RBC使之不因铅毒性导致溶血而缩短寿命,从而对染铅所致贫血具有一定的治疗作用。APS对血液系统的修复作用可能通过以下途径:①APS通过诱导巨噬细胞集落刺激因子、白细胞介素6和红细胞生成素等造血因子的分泌,间接促进骨髓造血,增加晚期红系祖细胞的产生[12];② 通过增加内源性脾结节数并促进骨髓有核细胞DNA合成,从而刺激脾脏和骨髓造血功能[13];③通过抑制体内铁代谢的负调节蛋白而提高血浆中铁的水平[14],降低血铅水平,拮抗血铅导致的贫血。APS的排铅作用和对贫血的治疗作用无明显的剂量效应关系,其原因有待进一步研究。
[1]Abelsohn AR,Sanborn M.Lead and children:clinical management for family physicians[J].Can Fam Physician,2010,56(6):531-535.
[2]Janus J,Moerschel SK.Evaluation of anemia in children[J]. Am Fam Physician,2010,81(12):1462-1471.
[3]Hatano R,Takano F,Fushiya S,Michimata M,Tanaka T,Kazama I,et al.Water-soluble extracts from Angelica acutiloba Kitagawa enhance hematopoiesis by activating immature erythroid cells in mice with 5-fluorouracilinduced anemia[J].Exp Hematol,2004,32(10):918-924.
[4]Li TX, Liu WD,Cai MS.Quality control analysis of whole blood lead determination[J].Occup Health(职业与健康),2008,24(18):1895-1896.
[5]Zhao XF,Yin SA.Comparison of HemoCue with cyanmethemoglobin method for estimating hemoglobin[J].J Hyg Res(卫生研究),2003,32(5):495-497.
[6]He BZ, Wang SQ, Hao W, Wang GF,Xian YL.Blood-determination of zinc protoporphyrin-hematofluorometer method[S].The Ministry of Health of China(中国卫生部),WS/T20-1996.
[7]Li QL. The ameliorative effects of the taurine on the lead exposed rats and the mechanism research[D].Huazhong University of Science and Technology,2005.
[8]Zhang Y, Li YY, Jin CH, Yang ML,Yang RH,Wang CX,et al.A clinical analysis of blood lead levels in children younger than 3 years old[J].J Clin Pediatr(临床儿科杂志),2008,26(11):967-969.
[9]Sun YL,Shen RL,Cai BY,Tang J.The preparation,purification and composition analysis of Angelica sinensis polysaccharides[J].J Henan Univ Tech(Nat Sci Edition)〔河南工业大学学报(自然科学版)〕,2005,26(2):40-43,47.
[10]Khotimchenko MY,Kolenchenko EA.Efficiency of lowesterified pectin in toxic damage to the liver inflicted by lead treatment[J].Bull Exp Biol Med,2007,144(1):60-62.
[11]Wang KP, Chen ZX, Zhang Y, Wang JH,Hu MH,Dai LQ.Experimental study of Angelica sinensis polysaccharide-iron complex on rats with iron deficiency anemia[J].Chin J New Drugs Clin Rem(中国新药与临床杂志),2007,26(6):413-416.
[12]Wang PP, Zhang Y, Dai LQ, Wang KP.Effect of Angelica sinensis polysaccharide-iron complex on iron deficiency anemia in rats[J].Chin J Integr Med(中国结合医学杂志),2007,13(4):297-300.
[13]Shan JJ,Wang Y,Wang SC,Liu D,Hu ZB.Effect of Angelica sinensis polysaccharides on lymphocyte proliferation and induction of IFN-γ[J].Acta Pharm Sin(药学学报),2002,37(7):497-500.
[14]Wang KP,Zeng F,Liu JY,Guo D,Zhang Y.Inhibitory effect of polysaccharides isolated from Angelica sinensis on hepcidin expression[J].J Ethnopharmacol,2011,134(3):944-948.
