NR1I2基因多态性对华法林维持剂量个体差异的影响
2012-11-12郑绮姗赵立子曾武涛岑菡婧王雪丁李嘉丽冷秀玉
郑绮姗,赵立子,曾武涛,岑菡婧,王雪丁,李嘉丽,冷秀玉,黄 民
(1.中山大学临床药理研究所,广东广州 510006;2.中山大学附属第一医院心血管医学部,广东广州 510080)
华法林是目前使用最广泛的口服抗凝药,但华法林治疗窗窄,个体差异大,临床上通过检测国际标准化比值(International Normalized Ratio,INR)调整剂量,以减少发生栓塞或致命性出血。然而,目前国内主要采用传统给药方案[1],未能快速达到预期治疗效果。现今,国内外相关研究致力于寻找对华法林维持剂量个体差异有影响的因素,建立可预测华法林维持剂量的模型,指导华法林的个体化用药。影响华法林维持剂量个体差异性的因素主要分为临床因素和遗传因素两方面。遗传因素则包括在华法林作用与代谢过程中起关键作用的受体与酶:维生素K环氧化物还原酶(vitamin K epoxide reductase,VKOR)、细胞色素 P450氧化酶(cytochrome P450,CYP)CYP2C9和CYP4F2等,其相应基因的遗传多态性会改变受体与酶的活性,影响华法林维持剂量。多项研究显示VKORC1-1639 G>A,CYP2C9*2/*3,CYP4F2 rs2108622 C>T是对华法林维持剂量个体差异贡献较大的3个因素,相应可解释20%~40%[2],3%~26%[2-3]与 2%~7%[2,4]的剂量个体差异。但即使加上临床因素,目前已建立的华法林维持剂量预测模型也只能解释30%~60%的个体差异[2-4],仍有大部分的个体差异未能得到解释。因此探索新的影响因素对华法林个体化用药有着重要的临床意义,而核受体是其中极具研究意义的对象之一。
孕烷 X 受体(pregnane X receptor,PXR)由NR1I2基因编码,可调控CYP酶、药物转运体和胆汁酸的表达[5]。NR1I2的多个单核苷酸多态性(Single nucleotide polymorphism,SNP)对CYP3A4表达的影响已有报道,其中位于上游的NR1I2-25385 C>T与CYP3A4的表型相关,位于5号内含子的NR1I27635 G>A则与CYP3A4的蛋白量相关,且二者在亚洲人中突变频率为20%~40%[6],突变较常见,是影响PXR调控CYP3A4的重要SNPs。然而,目前尚未见 NR1I2相关 SNPs对 CYP2C9以及NR1I2与华法林维持剂量个体差异相关性的报道。
本课题组前期已进行华法林维持剂量与CYP2C9*3,VKORC1-1639 G>A,CYP4F2 rs2108622 C>T相关联的研究,VKORC1-1639 G>A,CYP2C9*3分别解释 40.1%,26.3%的个体差异[2]。但华法林维持剂量仍有将近一半的个体差异未能得到解释,剂量预测模型还有很大的待完善空间。本研究以VKORC1-1639 G>A,CYP2C9*3不同基因型分组,排除此二者对剂量的影响后,进一步探究NR1I2-25385 C>T,NR1I27635 G>A对华法林维持剂量的影响。
1 材料与方法
1.1 受试对象
共纳入2008年3月至2009年12月期间在中山大学附属第一医院进行复查的机械瓣膜置换术后患者179名。均经抗凝治疗一个月以上,肝肾功能指标正常;使用华法林三个月以上且期间连续测得INR值都在1.5~3.0范围内。本研究获得中山大学医学伦理委员会批准,入选患者均已阅读并签订知情同意书。
1.2 试剂与仪器
CoaguChek®康固全凝血监测仪(瑞典Roche公司),引物(中国 Sangon公司),ExTaqTM酶系统、限制性内切酶(日本TaKaRa公司),Eppendorf MasterCycler® epGradient PCR仪(德国 Eppendorf公司),EC3凝胶成像系统(美国 UVP公司),ABI 3730xl DNA Analyzer测序仪(美国Applied Biosystems公司)。
1.3 华法林维持剂量的测定
在本研究中,INR为患者定期复诊时使用凝血监测仪快速测定而得,根据使用说明,抽取患者约100 μl外周血,滴在嵌入在监测仪上的专用试纸上,1 min内即可读出INR值;记录相应的检测日期及INR值。华法林剂量则通过查阅患者的医院电子病历中的药物开具情况,以及回访而得;记录患者每次复诊的日期及开具的华法林剂量,观察其调整情况,追踪其何时达稳。满足连续三个月以上华法林剂量不变,且INR值在1.5~3.0范围内的,此时的剂量方为维持剂量。
1.4 基因组DNA提取
参照并优化Loparev等[7]的方法。(1)取EDTA抗凝全血 100 μl,加无菌双蒸水 200 μl混匀;(2)加入 6 mol·L-1NaI 200 μl,混匀;(3)加入氯仿/异戊醇(24∶1)400 μl,混匀,静置 10 min,于10000 × g离心10 min,吸取上清液至另一离心管;(4)向上清液加入异丙醇 300 μl,混匀,静置 3 min,于 10000 × g离心 10 min,弃上清;(5)加入 70% 乙醇 500 μl,10000×g离心3 min,弃乙醇;(6)重复步骤(5)一次,倒置片刻;(7)管壁晾干后,加入TE缓冲液40 μl溶解DNA,-80℃保存。
1.5 基因检测方法的建立与验证
基因型的检测,CYP2C9*3和VKORC1-1639 G>A使用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP);NR1I2-25385 C>T,NR1I27635 G>A使用直接测序法,由上海美吉生物医药科技有限公司完成,引物见表1。
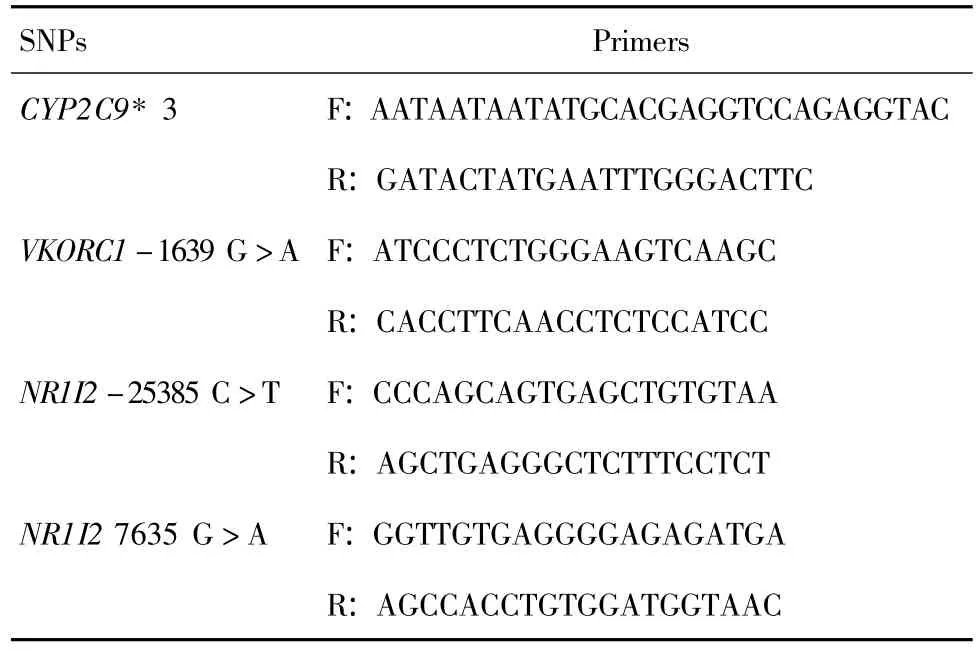
Tab.1 Primers and restriction enzymes for the target SNPs
所有SNPs的PCR体系为:DNA 50 ng,10×Taq缓冲液(buffer)2.5 μl,dNTPs(0.25 mmol·L-1)2 μl,上下游引物 10 μmol·L-1各 1 μl,ExTaqTM0.75 U,加灭菌双蒸水补足至 25 μl。
PCR-RFLP酶切体系及条件如下:CYP2C9*3:10× 缓冲液 2 μl,限制性内切酶 5 U,PCR 产物10 μl,补足灭菌双蒸水至 20 μl;37℃孵育 3 h,3% 琼脂糖凝胶电泳检测酶切图谱。VKORC1-1639 G>A:10 × 缓冲液 2 μl,BSA 2 μl,限制性内切酶 5 U,PCR产物10 μl,补足灭菌双蒸水至20 μl;37℃孵育5 h;2.5%琼脂糖凝胶电泳检测酶切图谱。
1.6 数据处理
采用分层分析法考察NR1I2-25385 C>T和NR1I27635 G>A对华法林维持剂量个体差异的影响,因此将分别组合固定VKORC1-1639 G>A与CYP2C9*3的基因型,在不同的组合基因型组内分析NR1I2-25385 C>T,NR1I27635 G>A对华法林维持剂量的影响。采用 ANOVA及 t检验对NR1I2-25385 C>T,NR1I27635 G>A在各组合基因型组内的基因型间log剂量进行比较。
1.7 统计学分析
实验结果数据采用SPSS 17.0软件分析。由于华法林剂量呈偏态分布,先对数转换,使用t检验及ANOVA对基因型间维持剂量进行比较。
2 结果
2.1 受试对象的一般情况
本研究共纳入179名机械瓣膜置换术后患者,男79 例(44.6%),女 100 例(55.4%);年龄 17~77岁,年龄(45.0±12.4)岁;身高(161.7±7.5)cm;体质量(55.7±9.6)kg;BSA(1.54±0.15)m2;109 例患者使用国产华法林,占60.8%,70例患者使用进口华法林,占39.2%,INR 值为2.13±0.27;华法林维持剂量的几何均数为(2.85±0.94)mg,最低剂量为1.1 mg,最高剂量为 8.75 mg。
2.2 基因型分布频率
179名患者中,NR1I2-25385 C>T CC基因型112例(62.6%),CT 基因型56 例(31.3%),TT 基因型11例(6.1%);NR1I27635G>A GG基因型55例(30.7%),GA 基因型88 例(49.2%),AA 基因型36例(20.1%)。VKORC1-1639G>A GG基因型有4例(2.2%),GA 基因型 40 例(22.3%),AA 基因型135例(75.4%);CYP2C9*3有 CYP2C9*1*1型161 例(89.9%),CYP2C9*1*3 型17 例(9.5%),CYP2C9*3*3型1例(0.6%)。以上各基因型均符合Hardy-Weinberg平衡;分布频率在性别之间没有统计学差异(表2)。
2.3 NR1I2-25385 C>T,NR1I27635 G>A 对华法林维持剂量的影响
179名机械瓣膜置换术患者中,各SNP对华法林维持剂量的影响见表2。
如表2所示,携带NR1I2-25385C>T各基因型组患者的华法林维持剂量分别为:CC型(3.0±1.2)mg、CT 型(3.0±1.2)mg、TT 型(2.8±0.8)mg,各基因型组间华法林维持剂量的差异无统计学意义。携带NR1I27635 G>A各基因型组患者的华法林维持剂量,从野生型、突变杂合子、突变纯合子组依次增加,分别为:GG 型(2.7±1.0)mg、GA 型(3.1±1.1)mg、AA 型(3.1±1.4)mg,组间剂量差异有统计学意义(P<0.05);两两比较结果显示,GG基因型组与GA,AA基因型组间维持剂量有统计学差异(P<0.05),GG基因型组的维持剂量均比GA,AA基因型组低,而GA基因型与AA基因型组间剂量差异则无统计学意义。
2.4 VKORC1-1639 G>A和CYP2C9*3对华法林维持剂量的影响
携带VKORC1-1639 G>A各基因型组患者的华法林剂量:GG 型(5.8±1.3)mg、GA 型(3.8±1.3)mg、AA 型(2.6±0.8)mg,差异有统计学意义(P<0.05);CYP2C9*3将CYP2C9*1*3与CYP2C9*3*3合并,华法林维持剂量在CYP 2 C 9*1*1组、CYP2C9*1*3及CYP2C9*3*3组中分别为(3.1±1.1)mg,(2.1±0.6)mg,两组的维持剂量差异有统计学意义(P<0.05)。
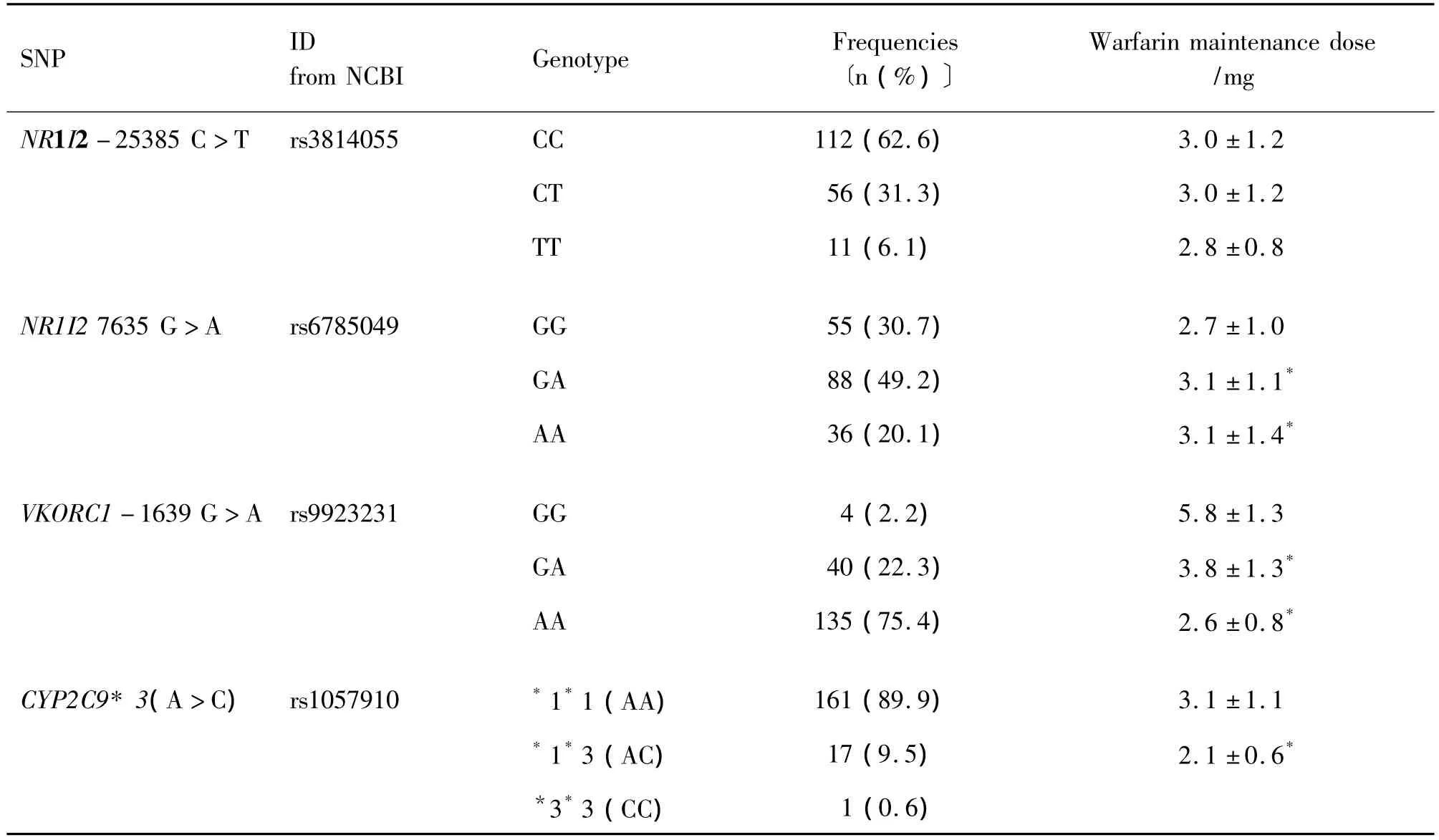
Tab.2 Mutation frequency of SNPs and their impact on warfarin maintenance dose
2.5 NR1I2-25385 C>T和NR1I27635 G>A对携带相同VKORC1-1639和CYP2C9*1*1患者的华法林维持剂量的影响
本课题前期研究结果[2]及本次研究初步分析结果,均显示VKORC1-1639 G>A及CYP2C9*3对华法林维持剂量个体差异贡献最大,在初步分析时极可能作为混杂因素干扰NR1I2-25385 C>T及NR1I27635 G>A对华法林维持剂量的真正影响;因此进一步采用分层分析,即分别固定VKORC1-1639 G>A及CYP2C9*3的基因型,进行组合分组,考察不同分组中NR1I2-25385 C>T及NR1I27635 G>A对维持剂量的影响。
2.5.1 NR1I2-25385 C>T 对携带 VKORC1-1639和CYP2C9*1*1患者的华法林维持剂量的影响
NR1I2-25385 C>T各基因型对华法林维持剂量的影响见图1和表3。
仅考察例数较多的VKORC1-1639 G>A的GA基因型(n=40)及 AA基因型(n=135),CYP2C9*3的*1*1基因型(n=161)组合的分组:CYP2C9*1*1/VKORC1-1639GA,CYP2C9*1*1/VKORC1-1639AA。图1及表3中,NR1I2-25385 C>T在CYP2C9*1*1/VKORC1-1639 GA和CYP2C9*1*1/VKORC1-1639 AA中,CT基因型与TT基因型的例数分别为9与1,41与8,将突变杂合子CT与突变纯合子TT合并,再与野生型CC作比较,考察野生型CC组与突变等位基因T携带CT+TT组的维持剂量。由图1及表3结果可知,NR1I2-25385 C>T野生型 CC组与突变等位基因T(CT+TT)组的维持剂量,CYP2C9*1*1/VKORC1-1639 GA和CYP2C9*1*1/VKORC1-1639 AA,差异均无统计学意义。
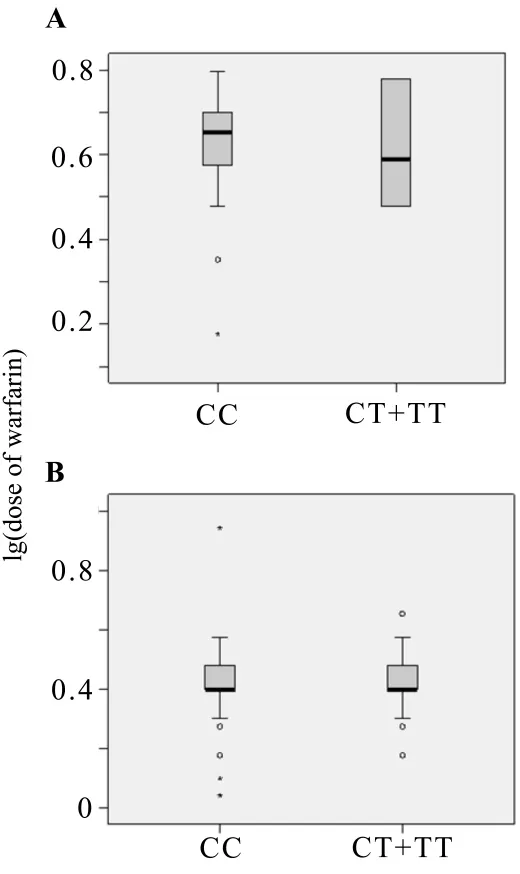
Fig.1 Effect of NR1I2-25385 C>T genotypes on maintenance warfarin dose in patients with VKORC1-1639GA(A)and VKORC1-1639AA(B).
2.5.2 NR1I2 7635 G>A 对携带 VKORC1-1639和CYP2C9*1*1患者的华法林维持剂量的影响
由图2及表3所示,NR1I27635 G>A在携带相同CYP2C9*1*1/VKORC1-1639GA亚组中,各基因型GG,GA,AA的例数分别为9,21,1,将GA与AA组合并,野生型GG组与携带突变等位基因A GA+AA组的维持剂量无统计学差异,但GA+AA组(4.2±1.3)mg比 GG 组(3.6±1.4)mg维持剂量要高;在CYP2C9*1*1/VKORC1-1639AA患者中,NR1I27635 G>A各基因型,其中GA,AA基因型组的维持剂量(2.7±1.0)mg、(2.9±1.0)mg分别与GG基因型组(2.3±1.0)mg相比,均比GG基因型组高,且差异有统计学意义(P<0.05),而GA与AA基因型组间差异则无统计学意义,提示NR1I27635 G>A的突变等位基因A携带患者须上调华法林维持剂量。
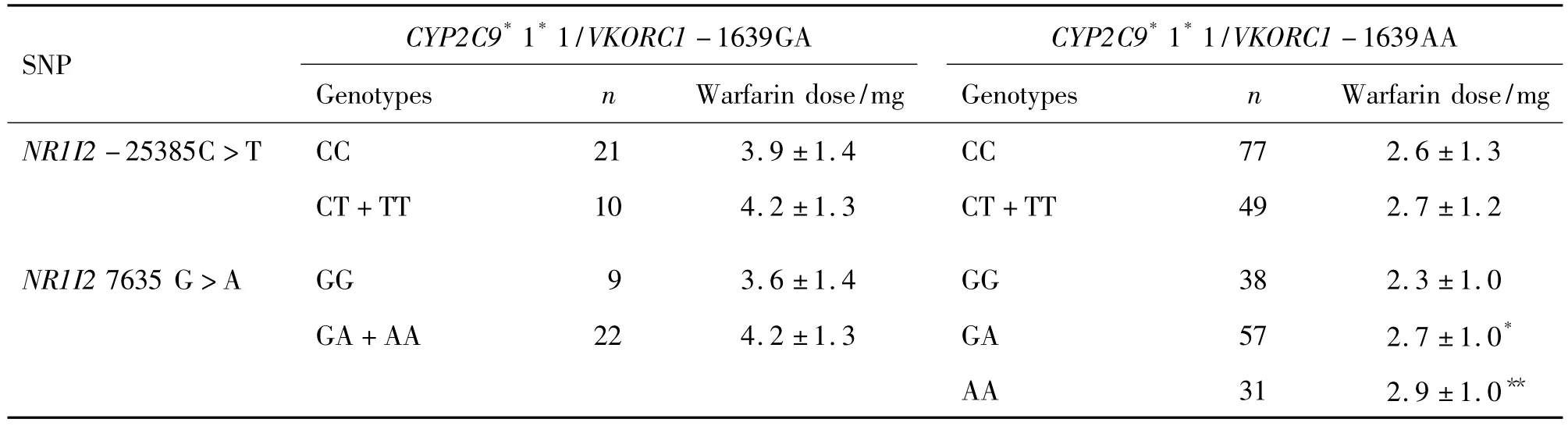
Tab.3 Effect of NR1I2-25385 C>T,NR1I27635 G>A on warfarin manitenance dose in patients with CYP2C9*1*1/VKORC1-1639GA and CYP2C9*1*1/VKORC1-1639AA
进一步考察VKORC1-1639 GA/CYP2C9*1*1组与 VKORC1-1639 AA/CYP2C9*1*1组,分析其中NR1I2-25385 C>T与NR1I27635 G>A各基因型的剂量关系,发现:NR1I27635 G>A在VKORC1-1639 AA/CYP2C9*1*1组中,仍然是GG型比A等位基因携带者低(P<0.05),而GA型与AA型剂量无统计学差异;(图2B);然而在VKORC1-1639 GA/CYP2C9*1*1组中,虽然GG型与GA型的剂量无统计学差异,但呈现GG型剂量低的趋势(图2A)。NR1I2-25385 C>T在两个亚组中各基因型的剂量均无统计学差异(图1A,B)。
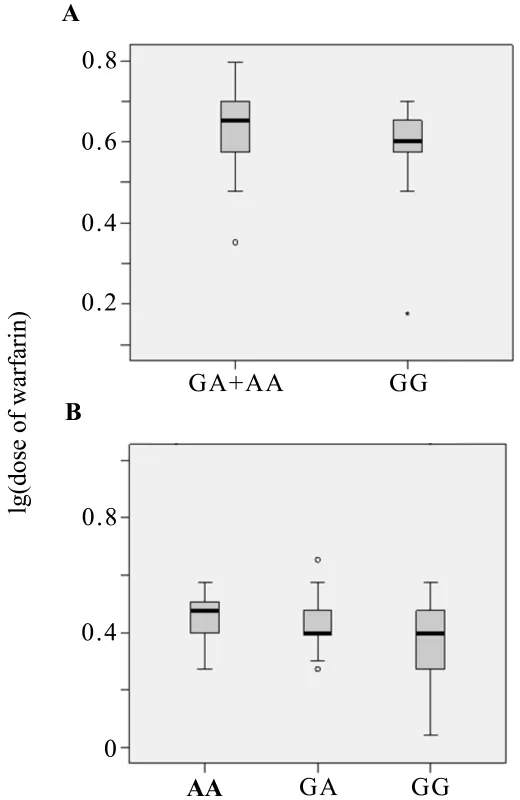
Fig.2 Effect of NR1I27635 G>A genotypes on warfarin maintenance dose in patients with VKORC1-1639 GA(A)and with VKORC1-1639 AA(B).
3 讨论
PXR作为CYP酶的调控因子,目前国内外尚无研究将其作为影响华法林维持剂量个体差异的因素进行考察。已有研究多集中在华法林抗凝通路中其他的酶、受体的遗传多态性上,如GGCX,EPHX1,CALU,PROC和APOE等;但众多研究显示这些因素对模型的贡献很低,甚至无贡献[10],因此新影响因素,尤其通路以外与相关基因表达的上下游调控因素很值得研究。PXR作为众多CYP酶表达的上游调控因子,其基因多态性很可能会通过改变其对CYP2C9的诱导,从而解释部分华法林维持剂量个体差异。本研究首次将NR1I2中对CYP2C9诱导影响可能性较大的位点与华法林维持剂量相关联,结果显示NR1I27635 G>A野生GG型的华法林维持剂量比A等位基因携带者要低,在分层考虑VKORC1-1639 G>A,CYP2C9*3等较大因素的影响后,仍然保持此趋势,呈现NR1I27635 G>A突变后PXR对CYP2C9诱导增强,提示NR1I27635 GA/AA基因型需上调华法林剂量,在维持剂量预测模型中有正向贡献。然而有研究表明NR1I27635 AA型与GG型相比,可降低利福平对 CYP3A4的诱导[8];虽然CYP2C9与CYP3A4有相似的经PXR/CAR诱导的特征[6],但PXR遗传多态性对CYP2C9的诱导影响是否与其对CYP3A4诱导有相似的趋势,目前仍未见报道。因此,本研究在推进指导华法林用药个体化的同时,也为相关PXR诱导CYP2C9机制的研究提供一定的理论依据。
今后,继续探索影响华法林维持剂量个体差异的新因素,考察它们与华法林维持剂量的相关性,完善剂量预测模型,并以前瞻性研究对模型进行验证,更好地指导华法林个体化用药。
[1]Huang SW,Chen HS,Wang XQ,Huang L,Xu DL,Hu XJ,et al.Validation of VKORC1 and CYP2C9 genotypes on interindividual warfarin maintenance dose:a prospective study in Chinese patients[J].Pharmacogenet Genomics,2009,19(3):226-234.
[2]Cen HJ,Zeng WT,Leng XY,Huang M,Chen X,Li JL,et al.CYP4F2 rs2108622:a minor significant genetic factor of warfarin dose in Han Chinese patients with mechanical heart valve replacement[J].Br J Clin Pharmacol,2010,70(2):234-240.
[3]Yoshizawa M,Hayashi H,Tashiro Y,Sakawa S,Moriwaki H,Akimoto T,et al.Effect of VKORC1-1639 G>A polymorphism,body weight,age,and serum albumin alterations on warfarin response in Japanese patients[J].Thromb Res,2009,124(2):161-166.
[4]Borgiani P,Ciccacci C,Forte V,Sirianni E,Novelli L,Bramanti P, et al. CYP4F2 genetic variant(rs2108622)significantly contributes to warfarin dosing variability in the Italian population[J].Pharmacogenomics,2009,10(2):261-266.
[5]Cerveny L, Svecova L,Anzenbacherova E,Vrzal R,Staud F,Dvorak Z, et al. Valproic acid induces CYP3A4 and MDR1 gene expression by activation of constitutive androstane receptor and pregnane X receptor pathways[J].Drug Metab Dispos,2007,35(7):1032-1041.
[6]Lamba J, Lamba V, Schuetz E.Genetic variants of PXR(NR1I2)and CAR(NR1I3)and their implications in drug metabolism and pharmacogenetics[J].Curr Drug Metab,2005,6(4):369-383.
[7]Loparev VN, Cartas MA, Monken CE,Velpandi A,Srinivasan A.An efficient and simple method of DNA extraction from whole blood and cell lines to identify infectious agents[J].J Virol Methods,1991,34(1):105-112.
[8]Pautas E,Moreau C,Gouin-Thibault I,Golmard JL,Mahé I,Legendre C,et al.Genetic factors(VKORC1,CYP2C9,EPHX1,and CYP4F2)are predictor variables for warfarin response in very elderly,frail inpatients[J].Clin Pharmacol Ther,2010,87(1):57-64.
