朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝脏细胞色素P450酶的影响
2012-11-12时京珍
杨 虹,彭 芳,刘 杰,吴 芹,时京珍
(贵阳中医学院1.实验中心基础医学实验室,2.生理教研室,贵州贵阳 550002;3.遵义医学院药理研究室贵州省基础药理重点实验室,贵州遵义 563003)
朱砂为硫化物类辰砂族矿石辰砂,主要成分为硫化汞(HgS),尚含有少量可溶性汞,具有清心镇惊以及安神等功效,为中医临床常用,2005版《中国药典》收载的564种中成药中,含朱砂制剂约占总数的7.6%。然而因朱砂中含重金属汞,各国药品标准均以总汞含量衡量其毒性,致使朱砂及其复方汞含量超标的问题严重。汞在自然界中有多种存在形式,其吸收分布均有很大的差异,将汞的毒性等同于朱砂的毒性,以总汞含量评价朱砂及其复方的毒性是否合理?肝是药物代谢的主要脏器,也是汞的毒性靶器官之一。本文采用短期给药临床剂量,探讨朱砂及其复方朱砂安神丸、对比 HgS和氯化汞(HgCl2)对大鼠肝及对金属硫蛋白、细胞色素P450酶(cytochrome P450,CYP)、结构型雄烷受体(constitutive and rostane receptor,CAR)等基因表达的影响。
1 材料与方法
1.1 动物
清洁级SD大鼠,雄性,体质量200~226 g,购自重庆腾鑫比尔实验动物销售有限公司,动物许可证号:SCXK(渝)2007-0008。
1.2 药品与试剂
朱砂(亳州市京晥中药饮片厂,水飞炮制品)、HgCl2(贵州省万山特区矿产公司)、朱砂安神丸水蜜丸(哈药集团世一堂制药厂)、HgS(美国Sigma公司)、Trizol和RNA纯化试剂盒(北京Tiangen)、High capacity RT试剂盒和POWER SYBR®GREEN PCRMaster Mix(美国ABI公司)、引物设计与合成(上海捷瑞生物工程有限公司)。
1.3 主要仪器
F732-V型冷原子吸收测汞仪(上海华光仪器仪表厂),RealTime-PCR(美国 Bio-Rad 公司),TU-1810紫外-可见分光光度计 (北京通用分析仪器公司)。Master Cycler Gradient PCR仪(德国eppendorf公司)。
1.4 动物分组给药
健康雄性SD大鼠30只,随机分为5组,正常对照组、HgS组、朱砂组、朱砂安神丸组和HgCl2组,每组6只。按照分组分别ig给予等量生理盐水、HgS 0.15 g·kg-1(含汞 0.13 g·kg-1)、朱砂0.15 g·kg-1(含汞 0.13 g·kg-1)、朱砂安神丸1.4 g·kg-1(含汞0.13 g·kg-1,为临床 0.2 g·kg-1等效剂量)、HgCl20.02 g·kg-1(含汞 0.015 g·kg-1),每天 1 次,连续21 d,断头取血,取肝组织。
1.5 大鼠一般情况观察和体质量测定
给药期间观察大鼠精神状态、毛发质量、活动情况和进食情况。于给药第1,6,13和21天称取大鼠体质量,绘制体质量变化曲线。
1.6 肝指数的测定
取肝称湿重,计算肝指数。肝指数=肝质量(mg)/体质量(g)。
1.7 血清谷丙转氨酶(alanine transaminase,ALT)的检测
断头取大鼠血,以900×g,4℃离心10 min后吸取血清,全自动生化分析仪测定ALT含量。
1.8 大鼠肝汞蓄积量的检测
冷原子吸收光谱法检测大鼠肝组织中汞蓄积量。绘制标准曲线:汞40 μg·L-1标准液,依次吸取0,2,4,6,8 和10 ml至反应瓶中,定容至25 ml,分别加入氯化亚锡100 g·L-1溶液2 ml,迅速盖紧瓶塞记录反应峰值,根据结果制作标准曲线。取一定量大鼠肝组织放入消化罐中,加入浓 HNO35 ml,170℃消化2 h后将消化液定容至25 ml。分别加入氯化亚锡100 g·L-1溶液2 ml,迅速盖紧记录峰值,根据结果计算大鼠肝中的汞蓄积量。
1.9 实时RT-PCR方法测定基因表达
取50~100 mg肝组织,采用Trizol一步法提取总RNA,按照RNA纯化试剂盒说明纯化,得100 μl RNA纯化液。紫外分光光度计检测RNA纯度,配置 2000 mg·L-1的 RNA 样品稀释液 50 μl。取 5 μl RNA稀释液按High Capacity RT试剂盒说明书逆转录成cDNA,稀释成100 mg·L-1备用。引物序列见表1。逆转录条件:25℃ ×10 min,37℃ ×2 h,85℃ ×5 min,4℃后取出。PCR 扩增:配置 15 μl反应体系,包 括 3 μl cDNA 稀 释 液,7.5 μl POWER SYBR®GREEN PCRMaster Mix,混合引物(表1)0.5 μl,DEPC 水 4 μl。反应条件:95℃ × 10 min,3个循环;95℃ ×10 s,60℃ ×1 min,40 个循环;95℃ ×1 min,55℃ ×1 min;55℃ ×10 s,80 个循环。根据结果对基因表达进行相对定量。基因相对表达(%)=目的基因的表达/内参基因的表达×100%。
1.10 统计学分析
2 结果
2.1 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠日常行为的影响
与正常对照组相比,给药初期,HgCl2组大鼠进食明显减少,不喜活动。给药中后期,精神较差,毛质粗糙微泛黄,毛发排列混乱不服贴,喂药反抗明显。其他组大鼠精神状态良好,饮食活动等无明显差异。
2.2 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠体质量的影响
大鼠体质量变化见图1。汞含量约为朱砂安神丸汞含量1/10的HgCl2,给药后立即出现体质量负增长,第6天体质量缓慢增长。与正常对照组相比,HgCl2组大鼠第6,13,21天体质量均明显降低(P<0.05);但HgS、朱砂和朱砂安神丸组大鼠第6,13,21天体质量与对照组没有显著差异。

Tab.1 Sequences of the primers
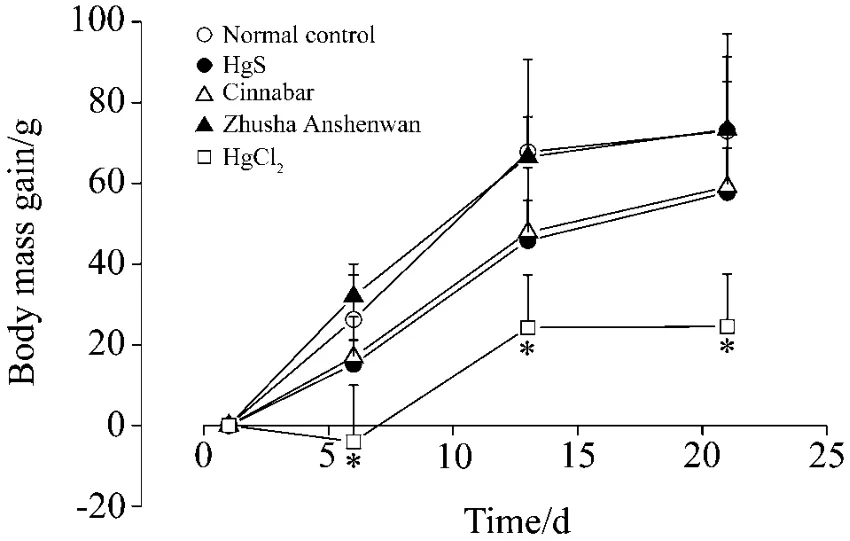
Fig.1 Effect of different mercury compounds on body mass of rats.Thirty male SD rats were orally gavaged normal saline,HgS 0.15 g·kg-1,cinnabar 0.15 g·kg-1,Zhusha Anshenwan 1.4 g·kg-1and HgCl20.02 g·kg-1,once daily,for 21 d.Animal body mass gain was calculated at the beginning,on the sixth,the thirteenth,and twenty first day.±s,n=6.*P<0.05,compared with corresponding normal control group.
2.3 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝指数和血清谷丙转氨酶的影响
如表2所示,与正常对照组相比,HgS,朱砂和朱砂安神丸和HgCl2组大鼠肝指数和ALT含量均无统计学差异,但HgCl2组大鼠肝指数有所升高。

Tab.2 Effect of mercury compounds on liver index and serum alanine transaminase(ALT)activity in rats
2.4 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝组织中汞蓄积量的影响
如图2所示,与正常对照组相比,HgCl2组大鼠组织汞蓄积量明显升高(P<0.05),而HgS、朱砂和朱砂安神丸组无明显差异。
2.5 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝组织基因表达的影响
2.5.1 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝组织MT-2 mRNA表达的影响
如图3所示,与正常对照组相比,HgCl2组大鼠肝组织MT-2基因相对表达量明显增高(P<0.05),表明HgCl2可明显上调MT-2基因的表达,而其他组没有明显的统计学差异。

Fig.2 Hg contents in the livers of different mercury compounds-treated rats.See Fig.1 for animal treatment.Livers were colffected at the end of experiment and Hg contents were determined by the cold atomic absorption spectrometry.1.Normal control;2.HgS;3.cinnabar;4.Zhusha Anshenwan;5.HgCl2.±s,n=6.*P<0.05,compared with normal control group.

Fig.3 Effect of different mercury compounds on expressions of MT-2 mRNA in the livers.See Fig.1 for animal treatment.MT-2 relative expression(%)=MT-2 gene expression/β-actin gene expression×100%.1:normal control;2:HgS;3:cinnabar;4:Zhusha Anshenwan;5:HgCl2.±s,n=6.*P<0.05,compared with normal control group.
2.5.2 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝组织CYP1A1,CYP1A2,CYP3A2和CYP4A10基因表达的影响
由表3可见,与正常对照组相比,HgCl2组大鼠CYP1A1和CYP1A2基因表达明显增高(P<0.05),CYP4A10基因表达有增高趋势但没有统计学意义。朱砂组CYP3A2基因表达明显升高(P<0.05),而HgS组、朱砂安神丸组没有统计学差异。
2.5.3 朱砂安神丸、朱砂、硫化汞和氯化汞对大鼠肝组织CAR及CYP2B1基因表达的影响
由表4可见,与正常对照组相比,HgCl2组CAR基因表达明显降低(P<0.05),其他组没有统计学差异。CYP2B1基因表达各组之间没有统计学差异。

Tab.3 Effect of different mercury compounds on mRNA expressions of CYP1A1,CYP1A2,CYP3A2 and CYP4A10

Tab.4 Effect of different mercury compounds on mRNA expressions of CAR and CYP2B1 in livers of rats
3 讨论
朱砂安神丸出自李东垣名作《内外伤辨惑论》一书,以朱砂为君,黄连为臣,生地、当归为佐,甘草为使,可清心养血,镇惊安神,为我国中医临床常用,然而其全方含汞约9%[1],临床使用是否安全遭到质疑。HgS是朱砂中的主要成分,2010药典规定炮制朱砂的HgS含量不得低于98%,其在水中的解离度极小(溶度积为 Ksp=10-52),口服吸收率仅为0.2%。HgS是否为朱砂及其复方朱砂安神丸产生药理、毒理作用的物质基础,目前尚无定论[2]。本实验研究表明,短期以临床剂量给予朱砂安神丸,相同汞含量的情况下比较HgS、朱砂、朱砂安神丸三者的毒性,三组大鼠体征没有明显改变,肝汞蓄积量,肝指数、生化指标检测均与正常组没有明显差异。HgCl2为可溶性二价汞,其在体内的吸收率为7%~15%,远高于HgS。本实验结果显示,给予HgCl20.02 g·kg-1(含汞0.015 g·kg-1,约 1/10 朱砂中汞含量),其在肝组织内的汞蓄积量明显高于其他各组,肝较其他各组有增大趋势。HgCl2组在给药初期体质量明显降低,给药中后期体质量增加缓慢,提示持续给药后体内的解毒机制可能发挥了作用,但随着给药时间延长,机体对HgCl2出现不能耐受的趋势。
MT富含巯基,可大量结合金属,并可被金属诱导合成增加,具有抗氧化损伤、重金属解毒等作用[3]。在本实验中,HgCl2组大鼠肝组织MT-2基因表达显著增高,可明显上调MT-2基因的表达。而HgS、朱砂、朱砂安神丸组与正常组的MT-2基因表达没有明显差异,均未触发MT-2基因表达。
CYP酶系是参与体内药物代谢的主要酶系,CYP1A1,CYP1A2均可激活前致癌物导致癌症的发生[4]。同时,重金属可诱导 CYP1A1 的表达[5],在亚慢性小鼠汞暴露实验中,甲基汞2.6 mg·kg-1可诱导CYP1A1基因表达上调[6]。本实验中HgCl2组已明显诱导CYP1A1,CYP1A2基因表达的增高,而HgS、朱砂和朱砂安神丸组与正常对照组的CYP1A1,CYP1A2基因表达没有明显差异。
CYP3A2是大鼠体内重要的CYP3A亚型,临床上有超过60%的药物通过CYP3A代谢,是参与首过效应的重要代谢酶。本实验中朱砂组明显上调了CYP3A2的基因表达,HgS、朱砂安神丸、HgCl2组则与正常组没有显著差异,在何海洋等[7]小鼠急性毒性实验、陆远富等[6]亚慢性小鼠毒性实验中,朱砂300 mg·kg-1均明显上调小鼠 CYP3A11 mRNA 表达,提示朱砂在与其他药物联用时可能影响其首过消除。
CYP4A10是人类CYP4A11的异体同工酶,该基因对肝毒物敏感[8],易被肝致癌物诱导。同时,CYP4A10表达上调可导致肝内氧应激和脂质过氧化作用增强,诱发炎症反应而发生非酒精性脂肪肝[9]。本实验中HgCl2组CYP4A10表达虽与正常组无统计学意义,但有增高趋势,而其他各组并未发现这个诱发趋势。
结构型雄烷受体CAR是核受体超家族的重要成员,主要存在于肝,参与调节多种药物代谢酶,与外源性物质代谢以及肝疾病的发生发展密切相关[10]。CAR可参与疏水性胆汁酸石胆酸的解毒过程,CAR的表达缺失可能导致胆汁淤积和肝损伤[11];CAR可以调节几乎所有胆红素转运转化排泄的相关代谢酶和转运体,CAR表达抑制可引起胆红素聚集,引发高胆红素血症而产生黄疸[12]。本实验中HgCl2组明显降低了CAR基因表达,而其他各组与正常组没有统计学差异。
大鼠CYP2B1受CAR通路调节,在小鼠体内的同工酶为CYP2B9,人体内为CYP2B6。参与多种毒物代谢及大约7%的常用药物代谢[13]。本实验中,HgCl2组CAR基因表达下调,但各组CYP2B1基因表达没有统计学差异。在何海洋等[7]小鼠急性汞暴露实验中,朱砂安神丸10 g·kg-1、朱砂 0.3 g·kg-1下调了小鼠 CYP2B9基因,而在陆远富等[6]朱砂300 mg·kg-1和 HgCl232 mg·kg-1连续给药 44 d 实验中,小鼠CYP2B9基因则被诱导表达增高。以上实验结果提示,大鼠CYP2B1基因与小鼠CYP2B9基因可能具有种属差异性,同时其表达与给药剂量和给药时间有关。
课题组前期通过急性毒性实验和亚慢性毒性实验结果表明,朱砂及其复方朱砂安神丸未对肝造成明显损伤,其毒性与HgCl2、甲基汞等汞存在形式相差甚远[14-17]。本研究结果中 MT-2,P450 酶、核受体CAR在基因水平发生的变化是否会导致相应酶活性的改变以及蛋白质含量上的变化,这些还有待进一步的研究。
综上所述,HgCl2在肝内大量蓄积,机体可通过调动相关解毒蛋白如MT减轻HgCl2对肝组织的伤害。HgCl2可明显改变P450酶基因的表达,下调CAR基因的表达。而HgS、朱砂、朱砂安神丸尚未明显改变上述基因的表达,但朱砂可能影响其他肝代谢药物的首过效应。
[1]Chen B,Liu CN.Content determination of HgS and berberine hydrochloide in Zhushaanshenwan[J].Shandong Med Industry(山东医药工业),2003,22(1):12-13.
[2]Liang AH,Shang MF.General situation of the study on the toxicity of cinnabaris[J].China J Chin Mater Med(中国中药杂志),2005,30(4):249-252.
[3]Klaassen CD,Liu J,Choudhuri S.Metallothionein:an intracellular protein to protect against cadmium toxicity[J].Annu Rev Pharmacol Toxicol,1999,39:267-294.
[4]Androutsopoulos VP, Tsatsakis AM, Spandidos DA.Cytochrome P450 CYP1A1:wider roles in cancer progression and prevention[J].BMC Cancer,2009,9:187.
[5]Kann S,Huang MY,Estes C,Reichard JF,Sartor MA,Xia Y,et al.Arsenite-induced aryl hydrocarbon receptor nuclear translocation results in additive induction of phaseⅠ genes and synergistic induction of phaseⅡgenes[J].Mol Pharmacol,2005,68(2):336-346.
[6]Lu YF, Wu Q, Liang SX, Miao JW,Shi JS,Liu J.Evaluation of hepatotoxicity potential of cinnabar-containing An-Gong-Niu-Huang Wan,a patent traditional Chinese medicine[J].Regul Toxicol Pharmacol,2011,60(2):206-211.
[7]He HY,Wu Q,Liu J,Shi JZ.Effect of cinnabar and Zhusha Anshen Pill on the expression of cytochrome P450 mRNA in mouse liver[J].Lishizhen Med Mater MedRes(时珍国医国药), 2011, 22(6):1373-1375.
[8]Bartosiewicz MJ,Jenkins D,Penn S,Emery J,Buckpitt A.Unique gene expression patterns in liver and kidney associated with exposure to chemical toxicants[J].J Pharmacol Exp Ther,2001,297(3):895-905.
[9]Leclercq IA,Farrell GC,Field J,Bell DR,Gonzalez FJ,Robertson GR.CYP2E1 and CYP4A as microsomal catalysts of lipid peroxides in murine nonalcoholic steatohepatitis[J].J Clin Invest,2000,105(8):1067-1075.
[10]Tien ES,Negishi M.Nuclear receptors CAR and PXR in the regulation of hepatic metabolism[J].Xenobiotica,2006,36(10-11):1152-1163.
[11]Guo GL,Lambert G,Negishi M,Ward JM,Brewer HB Jr,Kliewer SA,et al.Complementary roles of farnesoid X receptor,pregnane X receptor,and constitutive androstane receptor in protection against bile acid toxicity[J].J Biol Chem,2003,278(46):45062-45071.
[12]Wagner M, Halilbasic E, Marschall HU, Zollner G,Fickert P,Langner C,et al.CAR and PXR agonists stimulate hepatic bile acid and bilirubin detoxification and elimination pathways in mice[J].Hepatology,2005,42(2):420-430.
[13]Hodgson E, Rose RL. Theimportance of cytochrome P4502B6 in the human metabolism of environmental chemicals[J].Pharmacol Ther,2007,113(2):420-428.
[14]Kang F, Wu K, He HY, Wu Q,Liu J,Kang YJ,et al.Comparative toxicology study of cinnabar,Zhusha Anshenwan,methylmercury and mercuric chloride[J].China J Chin Mater Med(中国中药杂志),2010,35(4):499-503.
[15]He HY,Kang F,Yan JW,Liu J,Shi JZ.Comparative studies on acute toxicity of cinnabar,Zhusha Anshenwan,mercuric chloride and mercurous chloride[J].Chin J Exp Tradit Med Form(中国实验方剂学杂志),2011,17(2):219-223.
[16]Shi JZ, Kang F, Wu Q, Lu YF,Liu J,Kang YJ.Nephrotoxicity of mercuric chloride,methylmercury and cinnabar-containing Zhu-Sha-An-Shen-Wan in rats[J].Toxicol Lett,2011,200(3):194-200.
[17]Liu J,Shi JZ,Yu LM,Goyer RA,Waalkes MP.Mercury in traditional medicines:is cinnabar toxicologically similar to common mercurials[J]?Exp Biol Med(Maywood),2008,233(7):810-817.
