腘窝淋巴结试验模型的构建及在清开灵注射液致敏性研究中的应用
2012-11-12刘兆华刘兆平
王 宏,刘兆华,杜 武,刘兆平
(山东大学药学院1.药理学系,2.新药评价中心药学实验室,山东济南 250012)
清开灵注射液(Qingkailing Injection,QKLI)是由胆酸、珍珠母(粉)、猪去氧胆酸、栀子、水牛角(粉)、板蓝根、黄芩苷和金银花制成的中药复方制剂,具有清热解毒、化痰通络和醒神开窍之功效,用于热病、神昏、中风偏瘫和神志不清,也可用于急性肝炎、上呼吸道感染、肺炎、脑血栓和脑出血等的治疗。随着QKLI临床应用的日益广泛,不良反应尤其是过敏反应的报道日益增多[1-2],严重阻碍了其生产和应用。确定致敏原、明确致敏机制是提高QKLI临床用药安全性的有效方法。QKLI成分复杂,其中含有的许多小分子物质如绿原酸、黄芩苷和一些相对分子质量较小的结合型氨基酸等均为可疑的致敏物质[3-5]。大量实验表明,传统的过敏反应检测方法如主动全身过敏试验、主动皮肤过敏试验和被动皮肤过敏试验等对大分子蛋白类物质的检测结果与临床有较好的一致性,而对小分子物质易产生假阴性结果[6]。因此,迫切需要新的实验方法对QKLI的致敏性进行研究。
腘窝淋巴结试验 (popliteal lymph node assay,PLNA)是近年来文献报道较多的可用于小分子物质致敏性检测的实验方法[7-8],对多个已知的对人体具有免疫刺激作用的化合物的研究显示,PLNA实验结果与临床不良反应发生率之间具有较高的相关性[9]。盐酸 D-青霉胺(D-penicillamine hydrochloride,D-Pen)是临床不良反应发生率较高的一种小分子物质,国外研究者多用其作为PLNA建模的阳性药物[10-11],本研究以 D-Pen为阳性对照药,以苯巴比妥(phenobarbital,PB)为阴性对照药,通过对D-Pen量效关系和腘窝淋巴结(popliteal lymph node,PLN)时效的研究,选择D-pen的最低有效剂量和最佳解剖时间,复制直接法 PLNA(direct PLNA,d-PLNA)和间接法 PLNA(secondary PLNA,s-PLNA)模型,并检测QKLI的致敏性。通过比较小鼠给药侧和未给药侧PLN的反应情况,推测QKLI的致敏可能性。
1 材料和方法
1.1 动物
SPF级BALB/c小鼠,雌性,7~8周龄,体质量18~22 g,由山东大学实验动物中心提供,动物许可证号:SCXK(鲁)20090001。小鼠预饲养1周后开始实验。自由饮水摄食,温度21~23℃,相对湿度45% ~55%,12 h明/12 h暗。
1.2 药物、试剂和仪器
D-Pen,美国MP Biomedicals公司,用生理盐水溶解,用前过滤除菌;PB,美国Internal Laboratory公司,批号2300605,用20%DMSO+80%生理盐水溶解;QKLI,每支2 ml,河北神威药业有限公司,批号10062652;磷酸盐缓冲液(PBS),赛默飞世尔生物化学制品(北京)有限公司;胎牛血清(fetal bovine serum,FBS),新西兰Gibco公司;DMSO,细胞培养级,美国Solarbio公司。CytoreconTMCYT-1000细胞计数仪,美国Effector Cell Institute公司;ME235P型分析天平,德国赛多利斯公司;Eppendorf Minispin离心机,德国Eppendorf公司。
1.3 清开灵注射液的制备
由于清开灵粉针剂已经停产,为了制得较高浓度的QKLI,将市售 QKLI进行冻干,方法如下:将QKLI转移至西林瓶后,在-80℃冰箱放置24 h,随即采用冷冻干燥法,获得冻干粉,然后用适量注射用水溶解,制备2倍和4倍原液浓度的QKLI。
1.4 D-Pen量效关系和PLN反应动力学测定
小鼠随机分为正常对照、D-Pen 12.5,25.0,37.5,50.0 和 62.5 mg·kg-1和 PB 50 mg·kg-1组,每组10只。将配置好的D-Pen和PB过滤除菌,一次性sc给予小鼠右侧后肢足趾部,进针方向由足跟指向足尖,给药体积均为每只50μl;左侧不做任何处理。正常对照组sc给予生理盐水。分别于给药后第5,7和9天处死小鼠,75%乙醇浸泡10 min,入无菌操作间,分离并摘取左、右两侧PLN,剔除周围脂肪和结缔组织,然后迅速放入冰浴的含1%FBS的PBS(1%FBS-PBS)中,取出称质量,计算PLN质量指数(mass index,MI),MI=PLN 质量(处理侧)(mg)/PLN质量(未处理侧)(mg)。将每侧淋巴结分别放在200目不锈钢网上,用小杵轻轻研磨的同时用冰浴的1%FBS-PBS冲洗至小培养皿中,收集细胞悬液,310×g离心5 min,弃上清,洗涤1次,将细胞重悬于0.5 ml冰浴的1%FBS-PBS中,采用细胞计数仪计细胞数,计算PLN的细胞指数(cell index,CI),CI=PLN(处理侧)细胞数/PLN(未处理侧)细胞数。根据实验结果选择D-Pen的最低有效剂量和最佳解剖时间,为采用d-PLNA和s-PLNA进行药物检测时给药剂量和解剖时间的选择提供实验依据。
1.5 直接腘窝淋巴结试验检测清开灵注射液的致敏性
小鼠随机分为正常对照组、D-Pen 37.5 mg·kg-1组、PB 50.0 mg·kg-1组、QKLI原液、2 倍和4 倍原液浓度组,每组10只。分别在小鼠右侧后肢足趾部一次性sc 50μl上述药物,左侧不做任何处理。正常对照组给予生理盐水。给药后第7天,处死小鼠,按1.4方法解剖,取PLN,称重,研磨,制备单细胞悬液,计算MI和CI。
1.6 间接腘窝淋巴结试验检测清开灵注射液的致敏性
小鼠随机分为正常对照组、D-Pen 37.5 mg·kg-1组、PB 50 mg·kg-1组、2 倍和 4 倍 QKLI原液浓度组,小鼠右侧后肢足趾部一次性sc给予50μl上述药物,左侧不做任何处理。2个月后,同一小鼠的同侧足趾 sc 给予 D-Pen 25 mg·kg-1,PB 25 mg·kg-1,2倍和4倍QKLI原液浓度组注射QKLI原液进行激发,正常对照组sc给予生理盐水。激发后第7天处死小鼠,按1.4方法解剖,取PLN,称重,研磨,制备单细胞悬液,计算MI和CI。
1.7 统计学分析
2 结果
2.1 D-Pen最低有效剂量和最佳解剖时间的选择
由表1可见,单次足趾部sc给予D-Pen后第7天,D-Pen 37.5,50.0 和62.5 mg·kg-1组处理侧 PLN质量和细胞计数均显著高于未处理侧(P<0.05,P<0.01),MI和 CI显著升高,达到阳性反应标准(平均 MI≥2,CI≥5),且高于正常对照组(P <0.05,P <0.01)。D-Pen 25 mg·kg-1组处理侧PLN质量和细胞计数较未处理侧亦升高(P<0.05),但MI和 CI未达到阳性标准。上述结果提示,D-Pen 的最低有效剂量为 37.5 mg·kg-1。
PLN时效关系分析显示(表2),sc给予D-Pen 37.5 mg·kg-1后第 7 天,其 MI和 CI均达到阳性反应标准,而给药后第5和9天MI和CI未达到阳性标准,提示最佳解剖时间为给药后第7天。
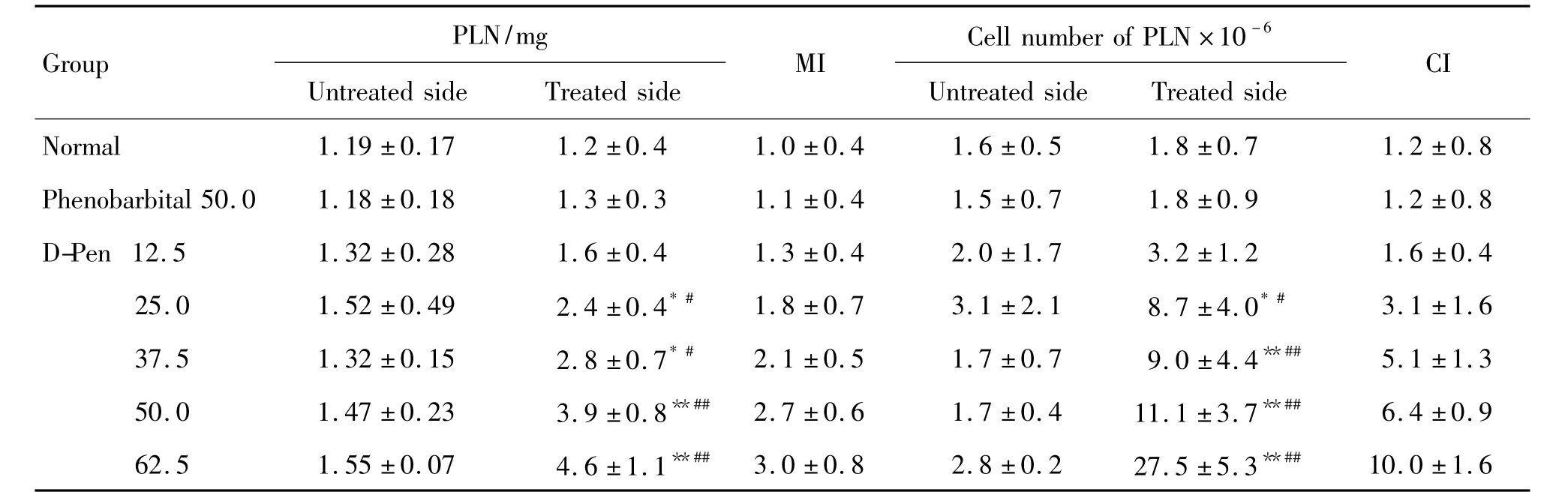
Tab.1 Dose-dependent response of D-penicillamine hydrochloride(D-Pen)inducing popliteal lymph node(PLN)response

Tab.2 Time-dependent reaction of D-Pen hydrochloride in popliteal lymph node(PLN)
2.2 QKLI对d-PLNA小鼠PLN反应的影响
由表3 可见,与未处理侧相比,PB 50 mg·kg-1组处理侧PLN质量和细胞计数无显著变化。D-Pen 37.5 mg·kg-1组、2 倍和4 倍 QKLI原液浓度组处理侧PLN质量和细胞计数均显著高于未处理侧(P<0.01),与正常对照组相比,有显著性差异(P<0.01),MI和CI显著升高,达到阳性反应标准;QKLI原液组(QKLI×1)处理侧PLN的质量和细胞计数较未处理侧亦升高(P <0.05),且高于正常对照组(P <0.05,P <0.01),但MI和CI未达到阳性反应标准。
2.3 QKLI对s-PLNA小鼠PLN反应的影响
由表4可见,足趾部sc低于有效剂量的药物进行激发后,PB组处理侧PLN质量和细胞计数与未处理侧相比无显著变化,与正常对照组相比,亦无统计学意义。D-Pen组、2倍和4倍QKLI原液浓度组处理侧PLN质量和细胞计数均显著高于未处理侧(P <0.01),且高于正常对照组(P <0.01),MI和CI达到阳性反应判定标准。

Tab.3 Effect of Qingkailing injection(QKLI)on PLN response of mice in direct popliteal lymph node assay
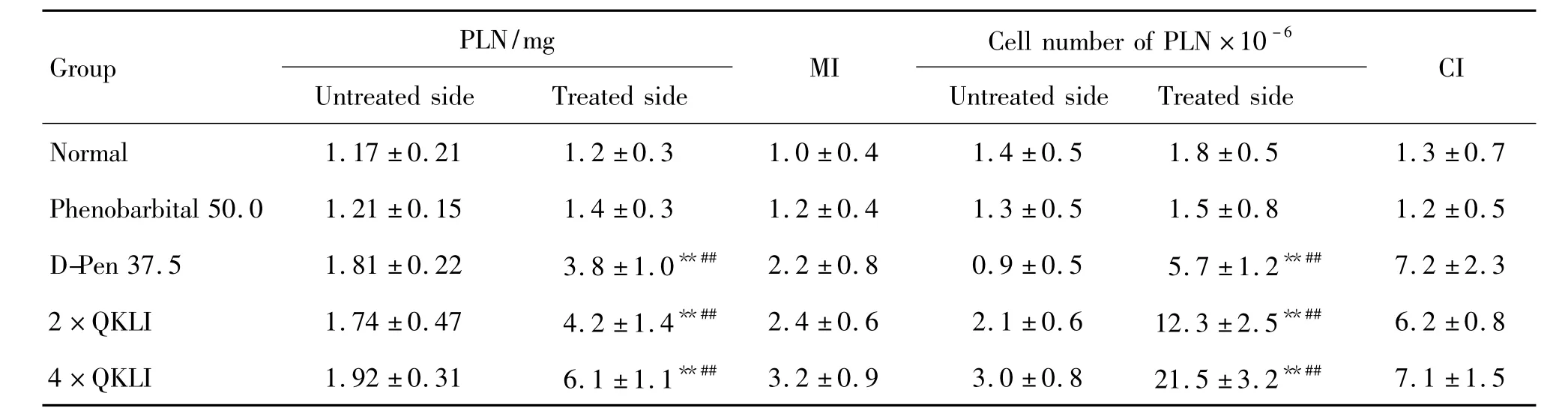
Tab.4 Effect of QKLI on PLN response of mice in secondary popliteal lymph node assay
3 讨论
PLNA是一种较为可靠的检测注射用小分子药物致敏性的实验方法,其发生机制可能与危险假说和半抗原假说有关,即小分子化合物可能通过提供危险信号或作为半抗原的方式激活机体的免疫系统,进而刺激机体产生免疫应答。小鼠足趾部sc给药后,通过检测局部引流PLN的MI和CI的变化情况,可以推测受试物的致敏潜能。
d-PLNA是将受试物直接注入小鼠后肢足趾部皮下,操作简单,灵敏度高,实验结果重复性好,且能进行量效关系研究,是评价小分子化合物免疫刺激潜能的较为理想的实验方法,但是不能区分受试物引起的阳性反应是由免疫系统介导的过敏反应还是由刺激性因素引起的炎症反应[13-15]。s-PLNA是用有效剂量的受试物致敏小鼠,一段时间(数周至数月)后,当处理侧的PLN与未处理侧相比无显著性差异后,再用低于有效剂量的同一受试物进行激发,若受试物能够诱导T细胞介导的免疫反应,则激发后能引起处理侧PLN中淋巴细胞的活化与增殖,进而引起PLN质量和细胞数目的增多,达到阳性反应的标准[16-17];若受试物的作用仅为刺激性因素引起的炎症反应,则用激发剂量的药量激发后不能引起PLN阳性反应。因此,s-PLNA能够克服d-PLNA不能研究反应机制的不足。本研究将d-PLNA和s-PLNA联合应用进行QKLI致敏性检测。
通过对阳性对照药D-Pen量效关系和PLN反应动力学研究,本研究确定了D-Pen的最低有效剂量为37.5 mg·kg-1,最佳解剖时间为药后第7 天,为d-PLNA阳性药物给药剂量与解剖时间的选择和s-PLNA给药剂量及激发剂量与解剖时间的选择提供了实验依据。
d-PLNA实验结果显示,2倍和4倍原液浓度的QKLI可诱导BALB/c小鼠发生明显的PLN反应,表现为MI和CI明显升高,且达到阳性反应的标准,提示QKLI具有一定的致敏潜能。为了进一步研究其具体机制,本研究应用s-PLNA对2倍和4倍原液浓度的QKLI进行检测。首次致敏2个月后,用不能引起PLNA阳性反应的QKLI原液进行激发,激发后第7天解剖,MI和CI均达到了阳性反应的标准,表明较高浓度的QKLI能够诱导T细胞介导的免疫反应。上述实验结果提示,QKLI中可能存在某些小分子致敏性成分,这些成分达到一定的浓度时能够诱导机体发生过敏反应。但是,QKLI成分复杂,具体引发过敏反应的小分子成分尚不清楚,有待今后进一步研究。
中药注射剂的安全性问题是制约其应用与发展的瓶颈,PLNA为中药注射剂小分子致敏原的筛选提供了有效途径,具有较好的应用价值。
[1]Wang QW, Li D, Feng ZH. Adverse drug reactions induced by Qingkailing injection:an analysis of 287 cases[J].Eval Anal Drug-Use in Hosp China(中国医院用药评价与分析),2010,10(7):652-654.
[2]Yu DH, Li B, Cheng M. Analysis of 34 cases with adverse drug reactions of Qingkailing Injection[J].China Licensed Pharmacist(中国执业药师),2010,7(12):6-8.
[3]Liu YP. Adverse reactions of traditional Chinese medicines in 111 cases[J].Adverse Drug Reactions J(药物不良反应杂志),2000,2(2):94-97.
[4]He Z,Qu HH,Wang XQ,ZhaoY,Li YF,Hu LN,et al.Allergenicity of chlorogenic acid as hapten[J].J Beijing Univ Tradit Chin Med(北京中医药大学学报),2010,33(10):667-669,680.
[5]Tong L.The relationship of adverse reactions of Shuanghuanglian Injection with its components[J],Chin Tradit Pat Med(中成药),1997,19(4):47-48.
[6]Choquet-Kastylevsky G, Descotes J. Value of animal models for predicting hypersensitivity reactions to medicinal products[J].Toxicology,1998,129(1):27-35.
[7]Løvik M,Alberg T,Nygaard UC,Samuelsen M,Groeng EC,Gaarder PI.Popliteal lymph node(PLN)assay to study adjuvant effects on respiratory allergy[J].Methods,2007,41(1):72-79.
[8]Shinkai K,Nakamura K,Tsutsui N,Kuninishi Y,Iwaki Y,Nishida H,et al.Mouse popliteal lymph node assay for assessment of allergic and autoimmunity-inducing potentials of low-molecular-weight drugs[J].J Toxicol Sci,1999,24(2):95-102.
[9]Pieters R.The popliteal lymph node assay:a tool for predicting drug allergies[J].Toxicology,2001,158(1-2):65-69.
[10]Aida T,Kimura T,Ishikawa N,Shinkai K.Evaluation of allergenic potential of low-molecular compounds by mouse popliteal lymph node assay[J].J Toxicol Sci,1998,23(5):425-432.
[11]Nierkens S,Aalbers M,Bleumink R,Boon L,Pieters R.Drug-induced type 1 and type 2 immune responses are characterized by distinct profiles of cell kinetics,cytokine production,and expression of co-stimulatory molecules in the popliteal lymph node assay[J].J Immunotoxicol,2005,2(3):141-150.
[12]Ravel G,Descotes J.Popliteal lymph node assay:facts and perspectives[J].J Appl Toxicol,2005,25(6):451-458.
[13]Gutting BW,Schomaker SJ,Kaplan AH,Amacher DE.A comparison of the direct and reporter antigen popliteal lymph node assay for the detection of immunomodulation by low molecular weight compounds[J].Toxicol Sci,1999,51(1):71-79.
[14]Choquet-Kastylevsky G, Descotes J. Popliteal lymph node responses to acetone and ethanol differ from those induced by streptozotocin[J].Arch Toxicol,2004,78(11):649-654.
[15]Ravel G,Christ M,Horand F,Descotes J.Cytokine release does not improve the sensitivity and specificity of the direct popliteal lymph node assay[J].Toxicology,2004,200(2-3):247-254.
[16]Friedrich K,Delgado IF,Santos LM,Paumgartten FJ.Assessment of sensitization potential of monoterpenes using the rat popliteal lymph node assay[J].Food Chem Toxicol,2007,45(8):1516-1522.
[17]Liu ZH, Liu ZP, Zhou GY. Application of popliteal lymph node assay in study of drug hypersensitivity[J].Chin J Pharmacol Toxicol(中国药理学与毒理学杂志),2009,23(1):70-75.
