羟基红花黄色素A对氧化低密度脂蛋白诱导的血管平滑肌细胞增殖的抑制作用
2012-11-12毕少杰马伟红
盛 林,毕少杰,焦 波,马伟红
(1.山东大学第二医院心内科,山东济南 250033;2.山东大学药学院药理室,山东济南 250012)
血管平滑肌细胞(vascular smooth muscle cells,VSMC)增殖是动脉粥样硬化、高血压和介入治疗后血管再狭窄的共同病理基础[1]。氧化低密度脂蛋白(oxidized low-density lipoproteins,ox-LDL)可以损伤血管内皮细胞,刺激VSMC增殖或者诱导凋亡,导致动脉粥样硬化斑块稳定性下降[2-3]。近年研究还发现ox-LDL与冠状动脉介入治疗后血管再狭窄关系密切[4]。红花黄色素(safflor yellow)是从传统活血化瘀中药红花中提取而来,为多种水溶性查耳酮成分的混合物,被认为是红花中的主要有效成分。红花黄色素可进一步分离为红花黄色素A、红花黄色素B、红花黄色素 C,其中羟基红花黄色素 A(hydroxyl-safflor yellow A,HSYA)被认为是红花黄色素中含量最高的黄酮成分,也是红花发挥药理作用的主要物质。由于HSYA具有抗心肌缺血、抑制血小板聚集、抗栓和抗氧化等作用,可以有效缓解心绞痛发作,因而广泛应用于临床。有文献报道红花黄色素可以抑制VSMC增殖[5],但是红花黄色素能否抑制ox-LDL诱导VSMC增殖,目前尚未见报道。本实验通过ox-LDL诱导VSMC增殖,探讨HSYA抑制VSMC增殖的信号调节机制。
1 材料与方法
1.1 试剂和仪器
HSYA,纯度98%,分子式:C27H32O16,由山东省天然药物工程技术研究中心现代中药研究室提供;DMEM培养基和胰蛋白酶:Gibco公司;胎牛血清:杭州四季青公司;磷酸化细胞外信号调节激酶1/2(phosphorylated extracellular signal-regulated kinase 1/2,p-ERK1/2)单克隆抗体、丝裂原活化的蛋白激酶磷酯酶-1(mitogen-activated provein kinase phosphatase-1,MKP-1)单克隆抗体均为美国Cell Signal Technology公司产品;β肌动蛋白HRP标记羊抗兔IgG为晶美生物工程有限公司;β微管蛋白HRP标记羊抗兔IgG为美国Santa Cruz公司产品;PD98059为Sigma-Aldrich公司产品;发光底物(SuperSignal Western Pico Chemiluminescence Substrate),美国 Pierce公司产品;牛血清白蛋白、碘化丙啶(propidium iodide,PI)为美国Amresco公司产品;N,N,N,N-四甲基乙二胺(N,N,N,N-tetramethylethylenediamine,TEMED)、过硫酸铵(ammonium persulfate,APS)、RNase均为美国Sigma公司产品;考马斯亮蓝、丙烯酰胺、甲叉双丙烯酰胺均为美国Bio Basic Inc.BBI公司产品;CO2细胞培养箱(美国Forma Scientific,Inc.公司);荧光显微镜(日本Olympus公司);酶联免疫检测仪(Multiskan Mk3,上海雷伯分析仪器有限公司);流式细胞仪(BD FACS Calibur);PCR仪系MT Research INC产品;DYY-Ⅲ6型稳压稳流电泳仪,上海医疗仪器厂产品;电泳及转膜装置(美国Bio-Rad公司);ox-LDL为北京欣源佳和生物科技公司;无水乙醇为天津市天新化学试剂开发中心产品。
1.2 细胞培养
SD大鼠由山东大学第二医院实验动物中心提供,许可证号:SYXK(鲁)20050050。取150 g左右雄性大鼠胸主动脉,剥去血管外膜,刮除内膜,剪成1 mm×1 mm组织块,贴于培养瓶内,于37℃,5%CO2条件下用含20%胎牛血清的DMEM培养液进行培养,3~5 d换液1次。待60%~80%融合时,加入0.25%胰蛋白酶消化传代,4~6 d传代。细胞为梭形,长成致密细胞层时出现典型的“峰-谷”状结构。实验用第3~8代VSMC。
1.3 细胞分组处理
取1.2项培养的细胞,根据预实验结果,采用ox-LDL最佳刺激细胞增殖浓度35 mg·L-1和HSYA最佳抑制细胞增殖浓度 10 μmol·L-1进行实验,按照下述进行分组处理:正常对照组细胞用含0.5%胎牛血清DMEM 培养液培养,ox-LDL 35 mg·L-1组,HSYA 10 μmol·L-1+ox-LDL 35 mg·L-1组,PD9805910 μmol·L-1+ox-LDL 35 mg·L-1和PD9805910 μmol·L-1+HSYA 10 μmol·L-1+ox-LDL 35 mg·L-1组。细胞与药物共同培养48 h。
1.4 MTT 法检测细胞存活率[6]
取指数生长期细胞,经PBS洗涤后,用0.25%胰蛋白酶消化分散成单个细胞。取细胞接种于96孔培养板中,细胞数为每孔1×103个。置37℃,5%CO2孵箱中培养24 h,细胞贴壁后加入ox-LDL,每组6个复孔。继续培养24 h取培养板,经洗涤加入20 μl MTT 5 g·L-1,培养 4 h,去除培养液,加入DMSO后即在570 nm处测吸光度值(absorbance,A),细胞存活率(%)=A处理组/A正常对照组×100%。
1.5 流式细胞仪检测细胞增殖周期
按1.2分组处理后用0.25%胰蛋白酶消化成单细胞悬液,收集于离心管中,4℃,2000×g离心6 min,吸去上清,加入PBS洗涤2次,离心后弃上清,每管加入0.5 ml预冷的70%乙醇固定,4℃冰箱过夜。取出固定细胞,4℃,2000×g离心6 min,除去乙醇,加入预冷PBS洗涤2次,离心。每管样品中加入 537 μl PBS 和3 μl RNase,37℃孵育30 min。每管中加入60 μl PI染液,避光反应30 min,转移至流式管中于流式细胞仪检测。
1.6 逆转录聚合酶链反应(RT-PCR)检测MKP-1 mRNA和ERK1 mRNA转录表达
将VSMC在24孔板中传代培养,按上述方法培养至终点。吸出培养液加入Trizol试剂,严格按照Gibco Trizol试剂盒说明书进行操作,提取VSMC总RNA。提取 10 μl RNA,冰上依次加入 0.2 μl Oligo dT 500 mg·L-1,2.5 μl dNTP(10 mmol·L-1),0.5 μl M-MLV 逆转录酶2 MU·L-1,4 μl RT(5 × ),0.5 μl RNasin 4 kU·L-1,加三蒸水将总体积补至 20 μl 。然后37℃水浴 30 min,95℃ 10 min,0℃放置 5 min。置于-20℃冰箱备用。取逆转录产物5 μl作为扩增模板,分别加入 0.5 μl 上游引物 50 mmol·L-1,0.5 μl下 游 引 物 50 mmol· L-1,1 μldNTP 10 mmol·L-1,0.5 μl Taq 酶 5 kU·L-1,5 μl PCR 缓冲液(10 ×),5 μl MgCl225 mmol·L-1,加三蒸水将总体积补至50 μl。放入PCR扩增仪,95℃预变性,并按以下条件扩增30个循环:91.6℃45 s,57℃60 s,72℃60 s,最后72℃延伸5 min。MKP-1序列为上游5'-TCTGGATTGTCGCTCCTTCT-3',下游 5'-GTCTGCCTTGTGGTTGTCC T-3',扩增产物长度为 619 bp;ERK1引物序列为上游5'-ACACATGCTTTGGGTCCTTC-3',下游 5'-AGGAACAGCTCACAGCCCTA-3',扩增产物长度为883 bp;GAPDH引物序列为上游5'-CATCACCATCTTCCAGGAGCA-3',下游 5'-TGACCTTGCCCACAGCCTTG-3',扩增产物长度443 bp。取PCR扩增产物行琼脂糖凝胶电压电泳,采用复日FR-980A生物电泳图像分析仪进行琼脂糖凝胶扫描和扩增条带积分吸光度(integrated absorbance,IA)分析。以与内参GAPDH的IA比值表示MKP-1和ERK1mRNA的相对表达强度。
1.7 Western印迹法测定ERK1/2和MKP-1蛋白表达
取对数生长期细胞,以1×108L-1的密度接种于6孔板中,37℃,5%CO2恒温培养箱中培养至90%融合,收集1.3处理的细胞,冰PBS洗涤3次,在冰浴条件下加入适量裂解液裂解细胞,14000×g离心15 min,小心吸取上清,BCA试剂测定蛋白含量,取40 μg蛋白样品上样 ,以10%SDS-PAGE凝胶电泳分离(积层胶80 mV,分离胶120 mV)后电泳转移(150 mA,1.5 h)至PVDF膜上,丽春红染色观察蛋白质转移情况。5%的脱脂奶粉封闭1 h后,分别以兔抗 MKP-1(1∶1000),ERK1/2(1∶1000)单克隆抗体 4℃孵育过夜,TBST洗脱后,二抗(1∶5000)室温下孵育1h后,电化学发光免疫分析(ECL)显色。用GIS图像处理系统分析目的条带的蛋白浓度,计算各蛋白条带和内参照的比值。
1.8 统计学分析
2 结果
2.1 HSYA对ox-LDL诱导大鼠主动脉VSMC增殖的影响
表1结果显示,与正常对照组相比,ox-LDL 35 mg·L-1组 VSMC 存活率明显增高,增加了 1.7倍,加入 HSYA 10 μmol·L-1后,细胞增殖受到明显抑制,细胞存活率降低了 60.4%(P<0.01);加入ERK1/2特异性抑制剂 PD9805910 μmol·L-1,细胞存活率降低了58.3%(P<0.01)。HSYA 10 μmol·L-1和 PD9805910 μmol·L-1同时加入细胞存活受到进一步抑制,细胞存活率下降了61.9%(P<0.01)。HSYA 10 μmol·L-1,PD9805910 μmol·L-1单用或两药合用对细胞存活的作用无显著性差异。

Tab.1 Effect of hydroxyl-safflor yellow A(HSYA)on vascular smooth muscle cell survival stimulated by oxidized low-density lipoprotein(ox-LDL)by MTT assay
2.2 HSYA对ox-LDL诱大鼠主动脉VSMC周期的影响
表2和图1流式细胞术分析结果显示,与正常对照组相比,ox-LDL 35 mg·L-1组G0/G1期细胞下降了30.2%,S期细胞数增加了1.9 倍(P<0.01)。加入 HSYA 10 μmol·L-1可显著抑制ox-LDL诱导细胞增殖周期,停滞于 G0/G1期的 VSMC(79.8±9.5)%(P<0.05)。加入 PD9805910 μmol·L-1使(75.0±8.3)%的细胞停滞于G0/G1期(P<0.01)。PD98059和HSYA同时加入VSMC增殖周期进一步受到抑制,G0/G1期细胞增加至(83.0±11.40)%,S期细胞减少至(17.0±2.6)%(P<0.01)。HSYA,PD98059单用或两者合用对细胞周期的作用无显著差异。

Tab.2 Effect of HSYA on cell cycle in VSMC stimulated by ox-LDL
2.3 HSYA对ERK1和MKP-1基因表达的影响

Fig.1 Effect of HSYA on cell cycle in VSMC stimulated by ox-LDL.See Tab.1 for the treatment.A:normal control;B:ox-LDL 35 mg·L -1;C:ox-LDL 35 mg·L -1+HSYA 10 μmol·L -1;D:ox-LDL 35 mg·L -1+PD9805910 μmol·L -1;E:ox-LDL 35 mg·L -1+PD9805910 μmol·L -1+HSYA 10 μmol·L -1 .

Fig.2 Effect of HSYA on ERK1mRNA and MKP-1mRNA expression in VSMC stimulated by ox-LDL.See Tab.1 for the treatment.B was the semiquantitative result of A.1.control;2.HSYA;3.ox-LDL;4.ox-LDL+HSYA;5.ox-LDL+PD98059;6.ox-LDL+PD98059+HSYA.±s,n=6.**P<0.01,compared with normal control;#P<0.05,##P<0.01,compared with ox-LDL;△P<0.05,compared with PD98059+ox-LDL.
图2 结果显示,HSYA 10 μmol·L-1对正常细胞ERK1和MKP-1基因表达无影响。与正常对照组相比,ox-LDL 35 mg·L-1组 VSMC ERK1 mRNA 表达量明显增高了2.2倍(P<0.01),MKP-1 mRNA表达虽然也略有增加,但无显著差异。与ox-LDL组相比,加入 HSYA 10 μmol·L-1,ERK1 mRNA 表达量下降了42.2%(P<0.01),MKP-1 mRNA表达显著增高,增加了 86.9%(P<0.01);加入 PD9805910 μmol·L-1ERK1 mRNA 下降了45.9%(P<0.01),MKP-1 mRNA表达无明显差异;PD98059与HSYA同时加入,ERK1 mRNA表达进一步明显下降(P<0.01),且与单用药组有显著差异(P<0.05),MKP-1 mRNA显著增加,增加了110%(P<0.01),且显著强于PD98059单独作用组(P<0.01)。
2.4 HSYA对 p-ERK1/2和 MKP-1蛋白表达的影响
图3结果显示,与正常对照相比,ox-LDL模型组p-ERK1/2显著增加,增加了33.3%(P<0.01),MKP-1蛋白略有减少,但无显著差异。与ox-LDL模型组相比,HSYA 10 μmol·L-1组 p-ERK1/2 表达减少了39.9%(P<0.01),MKP-1蛋白表达增加了80.6%(P<0.01);PD9805910 μmol·L-1组p-ERK1/2表达下降了45.9%(P<0.01),MKP-1 蛋白表达增加了21.1%,但无显著差异;HSYA与PD98059同时加入,p-ERK1/2表达下降了51.2%(P<0.01),MKP-1 表 达 增 加 了 62.4%(P<0.01)。
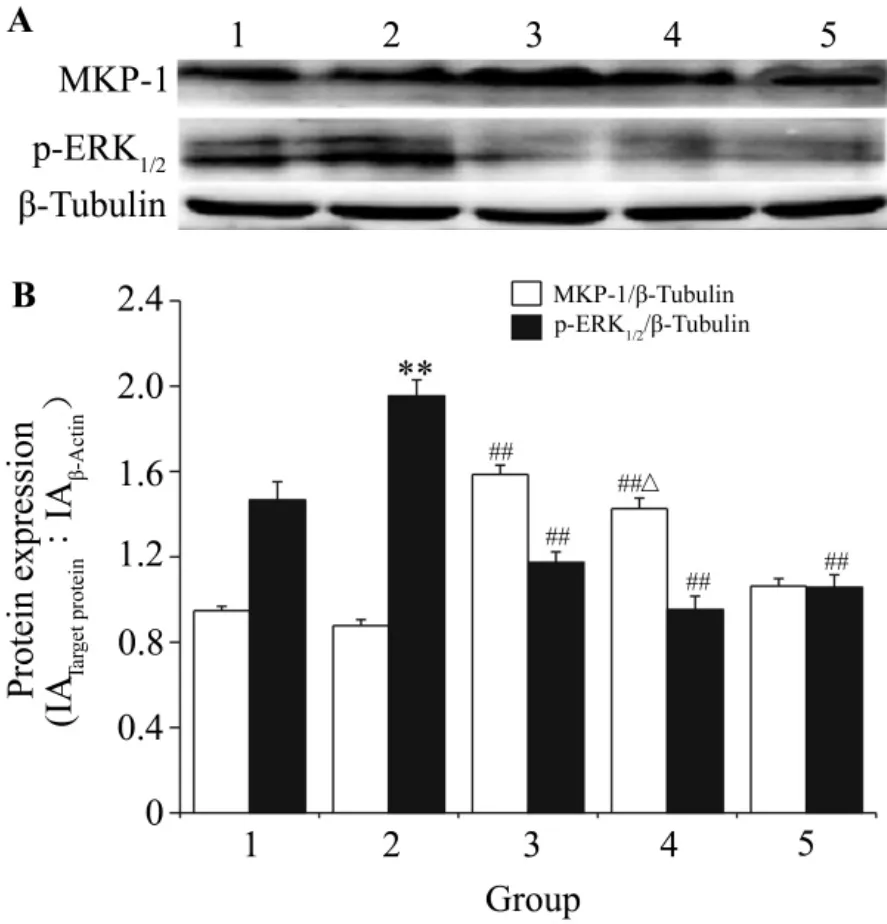
Fig.3 Effect of HSYA on the p-ERK1/2 and MKP-1 protein expression ofVSMC stimulated by ox-LDL 35 mg·L -1.See Tab.1 for the legend.B was the semiquantitative result of A.1.normal control;2.ox-LDL;3.ox-LDL+HSYA;4.ox-LDL+PD98059+HSYA;5.ox-LDL+PD98059.±s,n=6.**P<0.01,compared with normal control group;##P<0.01,compared with ox-LDL group;△P<0.05,compared with ox-LDL+PD98059 group.
3 讨论
本研究结果表明,ox-LDL 35 mg·L-1可以显著增强ERK1/2基因转录和蛋白表达,推动细胞周期运行,刺激 VSMC 增殖。HSYA 10 μmol·L-1可以显著增强MKP-1基因转录和蛋白表达,抑制p-ERK1/2活性,通过诱导VSMC生长停滞在G0/G1期抑制ox-LDL刺激VSMC增殖。使用ERK1/2选择性抑制剂PD98059后,ox-LDL刺激ERK1/2表达和VSMC增殖的活性受到显著抑制,而 MKP-1表达不受PD98059影响,进一步证明ox-LDL刺激VSMC增殖是通过的ERK1/2信号转导通路,与MKP-1活性无明显关系。HSYA和PD98059与ox-LDL共培养的研究结果证明,HSYA可以显著增强细胞MKP-1基因转录和蛋白表达。
ERK1/2是细胞内调节细胞生长的最重要的信号蛋白激酶之一,包括生长因子、血管紧张素Ⅱ和内皮素等在内的许多刺激因子均通过活化ERK1/2促进 VSMC 增殖[7-8]。MKP-1 是 ERK1/2 的负性调控蛋白,通过脱磷酸化作用MKP-1可以灭活ERK1/2活性。因此,调控ERK1/2和(或)MKP-1表达将对VSMC增殖产生重要影响。ox-LDL对VSMC的生物学效应与其浓度有关,低浓度刺激细胞增殖而高浓度则诱导凋亡。研究表明,ox-LDL可以通过活化Ras/Raf/丝裂原活化蛋白激酶激酶激酶(mitogenactivated protein kinase kinase kinase,MEK)/ERK1/2信号转导通路和诱导细胞周期蛋白D1表达刺激VSMC 增殖[9-13]。本研究显示,ox-LDL 显著增强ERK1 mRNA转录和磷酸化ERK1/2蛋白活性,推动VSMC由细胞周期G0/G1期向S/G2-M期转变,证实激活ERK1/2是ox-LDL刺激VSMC增殖的基本机制。MKP-1是 ERK1/2的负性调控蛋白,然而ox-LDL刺激细胞增殖与MKP-1表达变化是否有关,HSYA抑制ox-LDL刺激VSMC增殖是否也与MKP-1表达变化有关目前尚未见报道。本研究结果表明,ox-LDL在增强ERK1/2活性的同时并没有增加MKP-1转录和蛋白表达,因此,ox-LDL刺激VSMC增殖与 MKP-1并不相关,而可能是直接刺激ERK1/2转录,增强其磷酸化蛋白表达。
本实验结果还表明,ERK1/2选择性抑制剂PD98059是通过降低ERK1/2基因转录和p-ERK1/2表达抑制ox-LDL诱导VSMC增殖的,而对于MKP-1的基因转录与蛋白表达没有影响。与PD98059不同,HSYA在显著降低p-ERK1/2活性的同时明显增强了MKP-1基因转录和蛋白表达。因此,HSYA抑制细胞增殖的机制可能是由于通过增强MKP-1表达抑制了p-ERK1/2及其下游信号细胞周期蛋白D1活性,进而抑制细胞周期G0/G1期向S/G2-M期转变的结果。这可能是HSYA抑制ox-LDL诱导VSMC增殖的一个新的重要机制。
[1]Curcio A,Torella D,Indolfi C.Mechanisms of smooth muscle cell proliferation and endothelial regeneration after vascular injury and stenting:approach to therapy[J].Circ J,2011,75(6):1287-1296.
[2]Stoll G,Bendszus M.Inflammation and atherosclerosis:novel insights into plaque formation and destabilization[J].Stroke,2006,37(7):1923-1932.
[3]Imazu M,Ono K,Tadehara F,Kajiwara K,Yamamoto H,Sumii K,et al.Plasma levels of oxidized low density lipoprotein are associated with stable angina pectoris and modalities of acute coronary syndrome[J].Int Heart J,2008,49(5):515-524.
[4]Naruko T,Ueda M,Ehara S,Itoh A,Haze K,Shirai N,et al.Persistent high levels of plasma oxidized lowdensity lipoprotein after acute myocardial infarction predict stent restenosis[J].Arterioscler Thromb Vasc Biol,2006,26(4):877-883.
[5]Qiu ZC,Xu JL,Chen YX,Cui JC.Effect of safflor yellow on rat vascular smoth muscle cells[J].Hunan J Tradit Chin Med(湖南中医杂志),2005,21(4):75-77.
[6]Brunt KR,Fenrich KK,Kiani G,Tse MY,Pang SC,Ward CA,et al.Protection of human vascular smooth muscle cells from H2O2-induced apoptosis through functional codependence between HO-1 and AKT[J].Arterioscler Thromb Vasc Biol,2006,26(9):2027-2034.
[7]Li Y,Lévesque LO,Anand-Srivastava MB.Epidermal growth factor receptor transactivation by endogenous vasoactive peptides contributes to hyperproliferation of vascular smooth muscle cells of SHR[J].Am J Physiol Heart Circ Physiol,2010,299(6):H1959-H1967.
[8]Xiang Q, Lin G, Xu J, Zheng S,Chen S,Zhou K,et al.The role of caveolin1 and sprouty1 in genistein's regulation of vascular smooth muscle cell and endothelial cell proliferation[J].Eur J Pharmacol,2010,648(1-3):153-161.
[9]Perez J,Torres RA,Rocic P,Cismowski MJ,Weber DS,Darley-Usmar VM,et al.PYK2 signaling is required for PDGF-dependent vascular smooth muscle cell proliferation[J].Am J Physiol Cell Physiol,2011,301(1):C242-C251.
[10]Yang CM,Chiu CT,Wang CC,Chien CS,Hsiao LD,Lin CC,et al.Activation of mitogen-activated protein kinase by oxidized low-density lipoprotein in canine cultured vascular smooth muscle cells[J].Cell Signal,2000,12(4):205-214.
[11]Watanabe T, Takahashi K, Kanome T, Hongo S,Miyazaki A,Koba S,et al.Human urotensin-Ⅱ potentiates the mitogenic effect of mildly oxidized low-density lipoprotein on vascular smooth muscle cells:comparison with other vasoactive agents and hydrogen peroxide[J].Hypertens Res,2006,29(10):821-831.
[12]Chahine MN, Blackwood DP, Dibrov E,Richard MN,Pierce GN.Oxidized LDL affects smooth muscle cell growth through MAPK-mediated actions on nuclear protein import[J].J Mol Cell Cardiol,2009,46(3):431-441.
[13]Tu YS,Yan PK,Zhu BY,Huang HL,Liao DF.Probucol reduces cyclin D1protein expression and G1→S transition in rat vascular smooth muscle cells[J].Chin J Arterioscler(中国动脉硬化杂志),2005,13(6):676-680.
