刺参“腐皮综合症”致病菌LNUB415的分离及防治的初步研究
2012-01-12艾海新于晶晶郑方亮朱春玉丁国伟李鹤刘宏生
艾海新,于晶晶,郑方亮,朱春玉,丁国伟,李鹤,刘宏生*
(1.辽宁大学生命科学院,辽宁沈阳110036;2.辽宁省生物大分子计算模拟与信息处理工程技术研究中心,辽宁沈阳110036)
海参(Sea cucumber)属于棘皮动物门、海参纲、海参属,位居“八珍”之一,是一种名贵的食品兼药材。辽宁、山东海域所产刺参(Apostichopus japonicus)是海参中营养价值最高的一种,为海参中的上品。刺参养殖业已成为环渤海海域继海带、对虾、扇贝、海水鱼养殖之后新兴的水产养殖支柱产业。随着刺参养殖业快速发展,其病害发生也日趋严重。目前,辽宁海域产的幼参和成参主要疾病为“腐皮综合症”(俗称化皮病),多表现为附着力减弱,喷射内脏,皮肤在不同部位出现腐烂并死亡[1]。由于抗生素易产生残留,影响产品质量安全,因此研发中草药作为抗生素的替代品将具有重要的现实意义和广阔的发展前景。中草药含有多种具有免疫调节作用的成分,如生物碱、多糖、皂苷、有机酸等,应用在水产养殖领域,已有很多报道。张耀武等[2]报道:将黄芩、板蓝根、黄芪等混合饲料投喂黄颡鱼,显著提高黄颡鱼生长、血细胞的吞噬活性和溶菌酶活力。本研究从患病刺参肠道分离纯化出多株细菌,从中筛选到1株优势细菌,并对其进行了形态学、生理生化鉴定和16S rDNA序列分析,病原菌经分离纯化后进行了人工回接感染试验,进一步对条件致病菌进行病原学研究,并开展了抗生素和中草药免疫增强剂的筛选,该结果为进一步研究辽宁海域海参刺参的病害和“腐皮综合症”的防治提供了理论参考依据。
1 材料与方法
1.1 材料
患病刺参取自大连普兰店某刺参养殖场,体表呈大面积腐烂;用于人工感染的刺参,取自该养殖区健康幼参。
1.2 方法
1.2.1 显微观察和刺参肠道细菌分离首先肉眼观察患病刺参病灶处,用接种环刮取腐烂部位,直接制成水浸片显微镜观察,对细菌、霉菌、寄生虫的种类和数量进行观察和记录,以初步确定可疑病原。在无菌条件下,取患病和健康刺参肠道组织,剪碎、匀浆。取100 μL匀浆液在无菌TSA固体培养基上均匀涂抹,28℃恒温培养24~36 h,挑取培养基上的单菌落在TSA固体培养基上划线分离,纯化菌株。
1.2.2 病原菌的分类鉴定①形态及生理生化指标:将纯培养的细菌在28℃下培养24 h后,观察菌落及其形态,按常规方法进行革兰染色和电镜观察。根据参考文献[3]对纯化菌株进行生理生化指标的测定;②16Sr DNA序列分析和系统发育树:挑取单菌落加入到50 μL无菌水中,混匀。100℃水浴加热10 min后,于4℃下离心(11 000 r/min)10 min,取5 μL上清液为PCR反应的模板。采用细菌16S rDNA序列扩增的通用引物进行PCR扩增,反应条件参考文献[4]。琼脂糖凝胶电泳检测扩增产物的大小(1.5 kb左右)后,将其送至北京华大基因研究中心进行测序。将16S rDNA序列在GenBank数据库中进行BLAST比对,选取相似性较高的序列,通过MEGA4.0软件的邻近相接法对测得的DNA序列与已知序列进行聚类分析,建立系统发育树[5]。
1.2.3 人工感染试验将肠道分离的优势菌制成菌悬液,用注射法进行人工回接感染试验。分为试验组和对照组,每组2个平行,每个平行5头刺参。实验组每头刺参皮下注射菌悬液1 mL,菌悬液浓度为108、106、104cfu/mL,对照组注射1.5%的无菌生理盐水。同时,将菌悬液100℃水浴20 min灭活取1 mL皮下注射。试验期间,水温保持在14~16℃,盐度18~22 g/L,日换水量1/3,充气。连续观察10 d,记录试验结果。
1.2.4 中草药和药敏纸片试验①中草药制备:11种中草药原料购自沈阳东北大药房,分别是黄芪、连翘、大青叶、鱼腥草等,将中草药用粉碎机粉碎,分装待用。取60 g中草药倒入烧杯加入300 mL去离子水,浸泡2 h后煎煮,边煮边搅拌,煮沸后文火煮1 h,滤除煎液,共煎3次,合并滤液浓缩至30 mL,生药含量为2 g/mL,121℃灭菌20 min后置于4℃冰箱中保存待用;②中草药体外抑菌圈测定:取直径90 mm的平板,注入加热融化的TSA 7~9 mL,均匀摊布碟底,放置超净工作台,凝固后待用。将纯菌落制成菌悬液,按照1∶20加入40℃固体TSA中,取7~9 mL均匀倒在已凝固的培养基上。凝固后每个平板放置灭菌牛津杯4个,取150 μL中草药提取液加入牛津杯中,每个平板均做空白对照。28℃培养箱恒温培养24 h,观察有无抑菌圈产生,并记录抑菌圈直径大小。每种药做2个重复,测定记录抑菌圈大小,取其平均值;③药物敏感试验:采用1.2.4中②方法制作上层混菌的培养基,将9种药敏纸片均匀贴于培养基上,每种药敏纸片做2个重复,于28℃培养箱恒温培养24 h,观察有无抑菌圈产生,并记录抑菌圈直径大小;④中草药和抗生素人工感染试验:实验组每组2个平行,每个平行5头刺参。每头刺参皮下注射菌悬液1 mL,菌悬液浓度为108、106、104cfu/mL,喂养后出现附着力下降的症状,将中草药粉碎置于冰箱保存,使用前2 h按照4%量与饲料混合喂养。抗生素按照0.5%量与饲料混合喂养。对照组注射1.5%的无菌生理盐水。
2 结果与分析
2.1 优势菌的分离纯化
感染的对象为幼参,主要症状为口部肿大,附着力减弱,喷射内脏,皮肤溃烂直至死亡等。病参病灶组织的水浸片观察,发现病灶处有大量细菌,无霉菌和寄生虫存在,可初步确定刺参患病由细菌感染引起。从病灶组织分离到1株优势菌,标记为LNUB415。LNUB415在TSA上的菌落特征:圆形,乳白色,不透明,边缘不整齐似毛玻璃状,中间稍凸,表面半湿润,融蜡状,革兰阳性,菌体长杆状,两端较平整,多数呈链状排列,大小为(0.8~1.0)μm×(3~5)μm。芽胞偏中生,椭圆形。通过形态观察及生理生化指标测定,可初步确定LNUB415为芽胞杆菌属(Bacillus)的一种(表1)。
2.2 菌株LNUB415 16S rDNA序列分析
菌株LNUB415的16S rDNA序列长度为1 465 bp。登陆NCBI,将获得的序列进行BLAST同源检索,结果发现:LNUB415与蜡样芽胞杆菌(Bacillus cereus)具有99%同源性,表明LNUB415菌株为蜡样芽胞杆菌属。在GenBank中挑选芽胞杆菌属的部分菌株16S rDNA基因序列,利用CLUSTAL X2.0和MEGA4.0软件,N-J法构建系统发育树状图(图1)。综合形态学和生理生化测定,鉴定LNUB415为蜡样芽胞杆菌。

表1 菌株LNUB415的生理生化特征Table 1 Physiological and biochemical characteristics of bacterial strains LNUB415

图1 根据16SrDNA序列同源性构建的LNUB415的系统发育树Fig.1 Phylogenetic tree of LNUB415 based on 16S rDNA sequence homology
2.3 人工感染结果
人工感染结果发现感染刺参的症状与自然发病刺参的症状基本相同:首先,其触手过度张开,接着口部肿大,分泌粘液增多,肢体柔软,管足附着力下降,有的个体有排脏现象;然后,口部或棘刺部位出现溃烂,溃烂处有白色絮状物粘连,肛门处产生大量粘液,病情严重时开始体表大面积溃烂,最终死亡。
LNUB415注射浓度为108cfu/mL的实验组A1在幼参感染后24 h出现腐烂,至48 h全部死亡;浓度为106cfu/mL的实验组A2在感染后36 h棘刺部位出现白点,出现局部腐烂;浓度为104cfu/mL的实验组A3在36 h后触足无力,沉入池底;A4组将菌悬液100℃水浴20 min灭活取200 μL皮下注射,4 d后开始出现腐烂,第7 d死亡9只(表2)。

表2 LNUB415人工感染试验结果Table 2 Results of artificial infection experiment
2.4 中草药和抗生素试验结果
2.4.1 中草药和药敏试验体外抑菌试验结果中草药水提物的抑菌圈大小见表3。由表3可见,11种中草药水提物对LNUB415的抑菌效果由强到弱为黄连、大黄、大青叶。可见黄连、大黄对LNUB415都具有较强的抑制作用。菌株LNUB415对生产中常用的9种抗菌药物的敏感测试结果见表3,菌株LNUB415对链霉素、头孢噻肟、头孢哌酮、诺氟沙星敏感,对其他抗生素耐药或中度敏感。
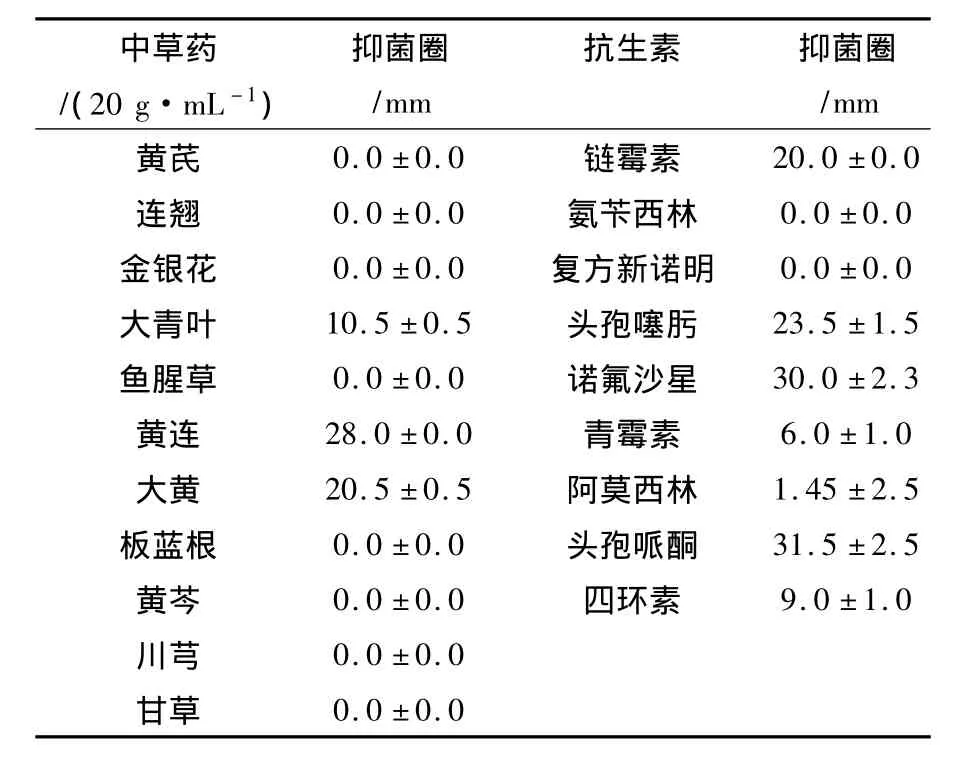
表3 11种中草药的水提物体和9种抗生素体外抑菌圈Table 3 Inhibitory circles of 11 Chinese herbal medicine water extracts and 9 drugs sensitivity tests
2.4.2 中草药和药物人工感染试验结果根据体外抑菌试验结果,将饲料与单方中草药黄连(HL)混合,喂养已注射菌液浓度为108cfu/mL的试验组(见表2中B1组),患病刺参死亡率下降至80%;浓度为106cfu/mL的B2组,喂药后60 h出现死亡,喂养10 d死亡率为50%;浓度为104cfu/mL的B3组,喂药后72 h出现患病症状,死亡率降低至30%,患病症状得到有效改善。药物选择诺氟沙星(NFLX),按照比例与饲料混合,喂养患病刺参(见表2中B4组),喂养10 d死亡率为20%,患病刺参的病情得到控制。
3 讨论
“腐皮综合症”是刺参幼参和成参时期危害最为严重的疾病,该病的病原具有多样性和地域性的特点。目前已报道的“腐皮综合症”病原,如灿烂弧菌(Vibrio splendidus)[6]、假交替单胞菌(Pseudoalteromonas nigrifaciens)[7]和溶藻弧菌(Vibrio.alginolyticus)[8]、杀鲑气单胞菌(Aeromonas salmonida)[9]、中间气单胞菌(Aeromonas.media)[10]、海弧菌生物变种Ⅰ(Vibrio.pelagius biovarI)等均可引发该病,而病毒也可能引发该病。Huan Deng等[11]从患病刺参表皮和肠道分离的细菌均导致不同程度死亡率,认为腐皮综合症是由多种不同细菌引起的。刺参为沉积食性,主要靠楣状触手扒取底质表面的沉积物为食,刺参超过70%的能量需求来自于细菌。这些细菌在刺参消化道会形成相对稳定的群落及优势菌群,当某种细菌随着环境的改变大量繁殖,抑制有益细菌生长,成为优势菌群,就会导致刺参抵抗力下降,诱发疾病。因此,不同的环境条件下可能形成不同的致病优势菌群,导致刺参暴发“腐皮综合症”。
通过微生物分析和人工回接感染试验证实,优势菌LNUB415可能是大连海域刺参“腐皮综合症”重要病原菌之一。采用形态学、生理生化测定以及16S rDNA序列分析等方法对其进行了分类学鉴定,初步确定LNUB415为蜡样芽胞杆菌。蜡样芽胞杆菌为革兰阳性好氧杆菌,是我国正式批准生产微生态制剂的菌种之一,常作为陆生畜禽微生态制剂的益生菌种。但蜡样芽胞杆菌中的部分菌株具有致病性,能引起败血症、心内膜炎、肺部感染等疾病,由蜡样芽胞杆菌引起的食物中毒事件也屡见报道。洛艺文等[12]也发现蜡样芽胞杆菌能够导致刺参腐皮综合症的发生,可能由于皮下注射量不同,本实验具有较高的致死率,但发病症状基本相同。本实验中,随着菌悬液浓度增加,致死率也增加,说明该菌达到一定浓度,对刺参具有很大的危害性。对该菌进行加热预处理(A4组),仍具有较高的致死率,但发病潜伏期较长,可能是该菌的芽胞耐高温没有完全杀死或菌体蛋白有致病性,具体致病机理有待于进一步研究。因此在水产养殖中应慎用含蜡样芽胞杆菌的微生态制剂,使用前应首先确定菌株的安全性。除刺参外,蜡样芽胞杆菌对其他海水养殖种类的危害性,需进一步研究。
中草药制剂在刺参养殖中的应用仍属于起步阶段,孟庆大等[13]将当归、刺五加等复方中草药喂养患病刺参,有效地降低了死亡率。王印庚等[14]对刺参“腐皮综合症”病原菌进行24种中草药的体外抑菌试验,以期筛选高效专用中草药。黄连作为中医临床上常用的抗菌消炎药,其中含有的小檗碱、药根碱、黄连碱和巴马亭等主要生物碱成分,具有很高的抑菌活性。本研究将黄连混合饵料喂养患病刺参(B3组),死亡率降至30%,对该病起到有效治疗。选用诺氟沙星混合饲料喂养患病刺参(B4组),死亡率降低至20%,虽然死亡率低于中草药,但抗生素在使用过程易产生耐药菌株,并且对环境造成危害,容易在生物体内蓄积,威胁人类健康,并且有些抗生素能直接或间接造成动物机体免疫力下降,增加发病率。有报道,饲料中添加中草药能明显提高水产品非特异性免疫功能,增强对疾病的预防能力。中草药以其无抗药性、无残留、无污染等优点逐步应用于水产养殖,陈孝煊等[15]将1%的大黄和黄连拌饵投喂克氏原螫虾和红螫螫虾,发现这2种中药能够增强两种螯虾血细胞的吞噬活性,并增强其非特异性免疫功能。建议在刺参养殖和疾病防治中选择中草药替代抗生素。
刺参“腐皮综合症”发病急、病程短、死亡率高,一旦发病,用抗生素治疗效果不理想,容易产生抗药性和药物残留,所以预防是防制该病的主要措施之一。建议刺参疾病的防治首先应严格监控养殖系统的菌群系统,定期投放有效微生物(EM菌)净化水体,杜绝养殖系统的病原菌感染。另外在刺参日常喂养中适当配合中草药免疫增强剂,提高刺参自身机体免疫力,促进刺参健康生长。疾病爆发时应严格筛选具有针对性的药物,防治滥用抗生素,产生耐药菌株,并且在使用药物前应进行代谢和残留消除实验,确定休药期,提高刺参质量安全,促进刺参养殖业健康发展。
[1] 牛化欣,常杰,方波,等.养殖海参成期腐皮综合症的病原学研究[J].黑龙江畜牧兽医,2008,1(7):70-72.
[2] 张耀武,郑建武,李文辉,等.复方中草药制剂对黄颡鱼生长和非特异性免疫功能的影响[J].水产科学,2010,29(1):225-228.
[3] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[4] Yana Song,Jing Hui,Hongsheng Liu,et al.Identification of Inonotus obliquus and Analysis of Antioxidation and Antitumor Activities of Polysaccharides[J].Curr Microbiol,2008,57(5):454-462.
[5] 艾海新,朱春玉,刘宏生,等.1株产紫杉醇内生真菌LNUF014的鉴定及产物检测[J].微生物学杂志,2010,30(4):58-62.
[6] 张春云,王印庚,荣小军,等.养殖刺参”腐皮综合症”病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.
[7] 王印庚,方波,张春云,等.养殖刺参保苗期重大疾病“腐皮综合症”病原及其感染源分析[J].中国水产科学,2006,13(4):610-616.
[8] 杨嘉龙,周丽,绳秀珍,等.养殖刺参溃疡病病原菌RH2的鉴定及其生物学特性分析[J].水产学报,2007,31(4):504-511.
[9] 杨嘉龙,周丽,邢婧,等.养殖刺参溃疡病杀鲑气单胞菌的分离、致病性及胞外产物特性分析[J].中国水产科学,2007,14(6):981-989.
[10] 王高学,原居林,赵云奎,等.刺参表皮溃烂病病原菌的分离鉴定与药敏试验[J].西北农林科技大学学报(自然科学版),2007,35(8):87-90.
[11] Huan Deng,Chongbo He,Zunchun Zhou,et al.Isolation and pathogenicity of pathogens from skin ulceration disease and viscera ejection syndrome of the sea cucumber Apostichopus japonicus[J].Aquaculture,2009,287(29):18-27.
[12] 骆艺文,郝志凯,王印庚,等.1株引起刺参“腐皮综合症”的蜡样芽胞杆菌[J].水产科技情报,2009,36(2):60-63.
[13] 孟庆大,杨海燕,申海清,等.中草药免疫增强剂在刺参养殖业中的应用研究[J].中兽医医药杂志,2008,1(2):38-39.
[14] 王印庚,冷敏,荣小军,等.中草药对刺参麸皮综合症病原菌的体外抑菌试验[J].渔业科学进展,2009,30(2):1-7.
[15] 陈孝煊,吴志新,张厚梅.大黄与黄连对二种淡水虾血细胞吞噬活性的影响[J].水生生物学报,2002,(2):201-204.
