L-蛋氨酸及甲醇浓度对毕赤酵母摇瓶发酵生产S-腺苷蛋氨酸的影响
2012-01-12许海琴倪辉蔡慧农杨秋明伍菱肖安风
许海琴,倪辉,2,3,蔡慧农,2,3,杨秋明,2,3,伍菱,2,3,肖安风,2,3*
(1.集美大学生物工程学院,福建厦门361021;2.福建省高校食品微生物与酶工程研究中心,福建厦门361021;3.厦门市食品生物工程技术研究中心,福建厦门361021)
S-腺苷蛋氨酸(S-adenosyl-L-methionine,SAM)是生物体内一种重要的中间代谢物质,它参与生物体内众多重要的生化反应,具有广泛的治疗和保健作用,如可以治疗关节炎、抑郁症、肝功能紊乱、胰腺炎等[1],并且可以预防肿瘤、心血管疾病和抗衰老[2-3]。SAM 的合成方法主要有化学(CH3I)合成,因反应底物价格昂贵、产率低、产物为消旋体等缺点,而未能生产应用;体外酶促转化法利用SAM合成酶催化底物L-蛋氨酸和ATP生产(-)型SAM,由于ATP成本太高,因此主要用于生物体内SAM代谢的研究;利用微生物发酵生产SAM是应用最广泛,成本最低廉的方法,用于生产SAM的微生物有酵母[4]、细菌[5]、霉菌[6]等。2008年,Zhang等[6]利用Streptomyces actuosus过量表达SAM合成酶,从而提高了SAM和纳西肽的产量。2006年,陶敏等[5]从大肠埃希菌BL21(DE3)中扩增出S-腺苷蛋氨酸合成酶基因,并插入大肠埃希菌高表达载体中表达,酶活达到4.17 μmol/(h·mL)。2008年,王杰鹏等[7]利用经常规诱变处理的SAM优势积累菌株酿酒酵母SAM0801,在5 L发酵罐上通过对L-蛋氨酸补加策略研究,最终确定L-蛋氨酸的加入时间为30 h,补加量为40 g/L,SAM最高产量为14.4 g/L。2002年,李东阳等[8]首次将酿酒酵母SAM2基因整合至毕赤酵母,优化其试管发酵条件后,SAM产量达到1.72 g/L。2006年,朱志钢等[9]优化了产SAM的重组甲醇型毕赤酵母的培养基,使SAM产量达1.70 g/L,L-蛋氨酸转化率达40.65%。2008年,Zhang等[10]优化了摇瓶发酵中甲醇的添加比例,当甲醇添加量为2.0%时,SAM产量最大,达到1.29 g/L。甲醇是影响毕赤酵母表达外源蛋白的一个重要因素,发酵过程甲醇浓度的测定方法主要有气相色谱法[11]、FT-MIRS[12]、变色酸分光光度法[13]。气相色谱法及FT-MIRS对仪器设备的要求较高且操作复杂,而变色酸分光光度法不利于实时控制发酵过程甲醇浓度。本文利用自制甲醇传感器测定发酵液中的甲醇浓度,该方法样品处理简便、测定快速更适于对发酵过程甲醇浓度的控制。通过对发酵过程甲醇的控制以最大限度的提高SAM产量;L-蛋氨酸作为SAM的合成前体对SAM的生产具有较大的影响,因此本实验通过考察L-蛋氨酸不同添加量对摇瓶发酵生产SAM的影响,选择适于SAM积累的L-蛋氨酸浓度。
1 材料与方法
1.1 材料
1.1.1 菌种产SAM毕赤酵母菌JMU0907,集美大学生物工程学院发酵工程研究室保藏。
1.1.2 培养基种子培养基:YPD培养基;摇瓶合成培养基:BMGY培养基[9]。
1.2 方法
1.2.1 培养方法①种子培养:YPD培养基,28℃,250 r/min,培养12 h;②初始培养条件[14]:将培养好的种子按10%接种量接种至摇瓶合成培养基,在28℃,250 r/min,蛋氨酸7.5 g/L培养24 h后,每24 h添加1%甲醇(体积比),并取样分析。诱导120 h后结束发酵。
1.2.2 分析方法①生物量的测定:菌液稀释后于波长600 nm处以蒸馏水为对照进行光度测定,OD600=读数×稀释倍数;②L-蛋氨酸的测定:发酵液3 500 r/min离心15 min,取上清液用超纯水稀释10倍后,13 000 r/min离心15 min,HPLC测定发酵液中L-蛋氨酸的含量(色谱条件:100%超纯水,210 nm,0.5 mL/min,30℃,C184.6×150 mm,5 μm);③SAM的测定[15]:1 mL发酵液加入2 mL 1.5 mol/L高氯酸,反应2 h,加入2 mL 1.25 mol/L氨。HPLC测定发酵液中SAM的含量(色谱条件:10 mmol/L甲酸铵,pH 3.0,254 nm,0.5 mL/min,30℃,C184.6×150 mm,5 μm);④甲醇浓度的测定:取1 mL发酵液以蒸馏水稀释10倍后用甲醇传感器测定发酵液中的甲醇浓度(甲醇传感器为集美大学生物工程学院自制)。
2 结果与分析
2.1 初始培养条件下摇瓶实验结果
按1.2.1②的初始培养条件,摇瓶培养毕赤酵母发酵生产SAM。发酵过程甲醇浓度、SAM产量及L-蛋氨酸浓度的变化如图1所示。
分析发酵过程L-蛋氨酸浓度的变化,当发酵时间达到96 h时,发酵液中L-蛋氨酸残余2.7 g/L。结束时,发酵液中L-蛋氨酸浓度为3.1 g/L,因菌体生长及作为前体合成SAM消耗的L-蛋氨酸为4.4 g/L。在该条件下毕赤酵母摇瓶发酵生产SAM没有将7.5 g/L的L-蛋氨酸完全利用,因此,在后续实验中对添加至培养基中的L-蛋氨酸的浓度进行考察,以得到适宜的L-蛋氨酸添加量。
在初始的培养条件下,每隔24 h补加1%(体积比)的甲醇,利用甲醇传感器对发酵过程的甲醇浓度进行检测,可以发现,随着发酵过程的进行,发酵液中的甲醇浓度不断增大,当发酵结束时,发酵液中的甲醇浓度达到70 g/L。对图中的SAM含量变化曲线与甲醇浓度的变化曲线进行比较,可以看出,在发酵的中期(48~96 h),SAM含量呈现快速增长的趋势,在发酵早期和后期,SAM含量变化不明显。分别计算发酵过程不同时间段的SAM生产速率,结果见表1。
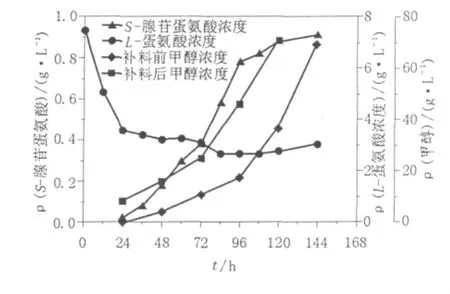
图1 毕赤酵母摇瓶发酵生产SAM发酵曲线Fig.1 Time course for the production of SAM by P.pastoris transformant in shake flasks

表1 诱导发酵开始后不同时间下甲醇的消耗速率及SAM生产速率Table 1 Methanol consumption and SAM production rate in different period after induced
由表1可见,随着甲醇浓度的增加,SAM生产速率先呈现上升趋势:在甲醇诱导的起始阶段(24~48 h),SAM的生产速率很低,此时的甲醇浓度也处于较低的浓度;在48~72 h期间,SAM的生产速率达到0.008 g/(L·h),相应的甲醇浓度为10.9~13.3 g/L;72~96 h期间SAM的生产速率最大,此时的甲醇浓度达到20 g/L左右。当甲醇浓度达到40 g/L左右时,SAM的生产速率出现明显的下降,96~120 h的SAM生产速率为0.004 g/(L·h);而发酵至120 h,SAM的生产速率接近0,此时的甲醇浓度增至70 g/L以上。这说明低甲醇浓度或高甲醇浓度均不利于SAM的生产,因此,有必要对发酵过程的甲醇浓度进行考察并优化。
2.2 L-蛋氨酸添加量对毕赤酵母摇瓶发酵生产SAM的影响
L-蛋氨酸既是SAM合成的前体物质,同时还作为碳源、氮源、硫源等参与细胞内的其他代谢[16],因此培养基中的L-蛋氨酸对毕赤酵母发酵生产SAM有着多重的影响。通过添加不同量L-蛋氨酸,考察其对毕赤酵母摇瓶发酵生产SAM的影响。图2、图3为不同L-蛋氨酸添加量下毕赤酵母发酵过程的生物量及SAM发酵曲线。
分析图2中生物量变化曲线,细胞在以甘油为碳源的生长阶段细胞快速生长,且细胞的生长速率与L-蛋氨酸添加量呈反比例关系。这主要是因为L-蛋氨酸会抑制TCA及EMP途径,从而减少ATP的产生[17]。因此,在培养基中添加L-蛋氨酸会导致细胞的生长受到影响,L-蛋氨酸添加浓度越高,所获得的生物量越低。

图2 发酵过程不同L-蛋氨酸添加量对毕赤酵母生长的影响Fig.2 Time course of cell growth in P.pastoris fermentation with shake flasks
测定不同L-蛋氨酸添加量下毕赤酵母摇瓶发酵生产SAM的变化,结果如图3所示。在不添加L-蛋氨酸的菌体中仍然有较低的SAM存在,这是因为毕赤酵母本身会产生少量的SAM参与细胞内的反应;根据图1可知2.5 g/L L-蛋氨酸条件下发酵至96 h时发酵液中的L-蛋氨酸基本耗尽;而在生物体内SAM的合成与分解是一个动态过程,L-蛋氨酸与ATP结合生成SAM,SAM又会经过多步反应最后形成L-蛋氨酸。因此,低浓度的L-蛋氨酸使得SAM的合成速率小于分解速率,菌体内的SAM含量下降[16];5 g/L和7.5 g/L L-蛋氨酸条件下,在整个发酵过程都能够提供足够的L-蛋氨酸供细胞生长及SAM合成需要,因此在该浓度下SAM产量达到一个较高的水平;Thomas等[18]报道,发酵培养基中L-蛋氨酸的存在会抑制SAM合成酶的转录,因此,添加10 g/L L-蛋氨酸获得的SAM产量比添加5 g/L和7.5 g/L L-蛋氨酸的SAM产量低了50%左右。
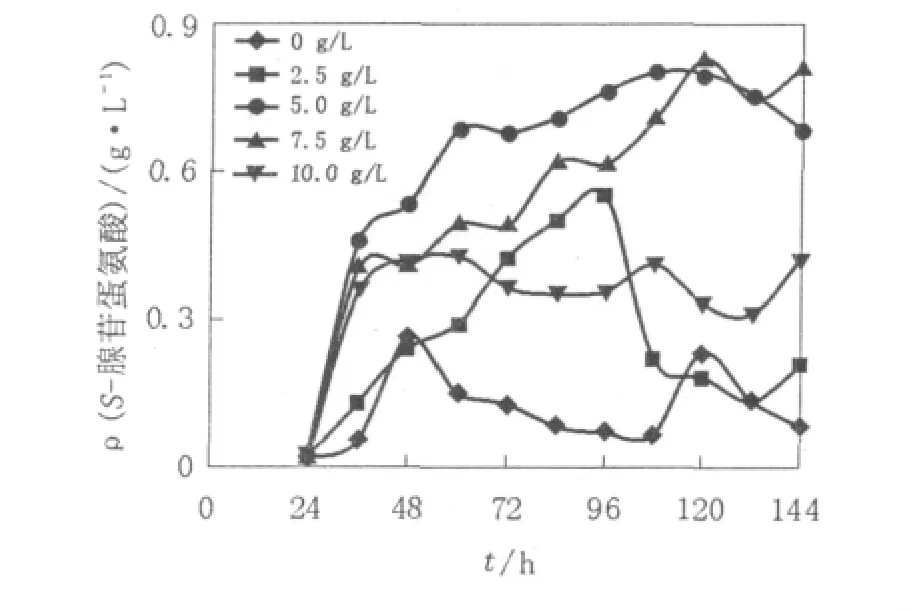
图3 添加不同L-蛋氨酸浓度下发酵过程SAM的变化Fig.3 Time course for the expression of SAM by P.pastoris transform ant in shake flasks
综合以上实验结果,对L-蛋氨酸浓度及发酵过程SAM最高浓度作图进行比较,结果见图4。由图4可见,随着L-蛋氨酸浓度的增大,SAM产量呈现先增后降趋势,当L-蛋氨酸添加浓度为5~7.5 g/L的SAM产量明显高于其他浓度下的SAM产量。据相关文献报道,L-蛋氨酸不仅是SAM的合成前体,同时参与细胞内的其他代谢反应,多种影响因素的综合作用影响了SAM的生成:首先,L-蛋氨酸作为SAM的合成前体,随着添加浓度的增大,使SAM的合成速率提高从而增加SAM的积累;其次,增加L-蛋氨酸的浓度,会增强SAM合成酶2基因的表达,但同时又会抑制SAM合成酶1基因的表达[18],因此,L-蛋氨酸的浓度过低或过高均不利于SAM合成酶的生成,即影响SAM的积累;此外,ATP与L-蛋氨酸在SAM合成酶的催化下合成SAM,而发酵过程高浓度的L-蛋氨酸会抑制TCA循环及EMP途径,导致ATP形成减少[17],合成前体ATP的减少会使SAM的合成速率下降,减少SAM在细胞内的积累量。因此,只有添加适当的L-蛋氨酸时才有助于胞内SAM的积累。

图4 L-蛋氨酸对毕赤酵母摇瓶发酵生产SAM的影响考察结果Fig.4 Comparison of SAM production with different L-Met concentration in P.pastoris fermentaion
2.3 发酵过程甲醇浓度对SAM摇瓶发酵的影响
根据表1中甲醇浓度与SAM生产速率变化,对甲醇浓度进行考察,甲醇浓度具体考察范围为0~60 g/L,以每隔24 h补加1%甲醇作为对照组,检测在发酵过程中生物量、SAM含量的变化,结果见图5、图6。图5为不同甲醇浓度下毕赤酵母的生长曲线,可见,在不同甲醇浓度下,随发酵时间的变化,毕赤酵母生长的变化趋势是一致的。发酵结束时OD值均在45左右,其中甲醇浓度为15 g/L时生物量最高,OD值达到52.0。
比较不同甲醇浓度条件下SAM含量变化曲线(图6),可以发现,控制不同甲醇浓度进行发酵,SAM的生产呈现不同的增长趋势。发酵过程不添加甲醇,SAM产量接近于零,随着甲醇浓度的增大,SAM的产量呈现先增加再下降的趋势,其中,在10~30 g/L的甲醇浓度下进行毕赤酵母发酵生产,最有利于SAM的积累,发酵结束后10 g/L和30 g/L甲醇浓度发酵的SAM产量分别达到1.34 g/L和1.29 g/L,而15 g/L甲醇浓度发酵的SAM产量最高,达到1.41 g/L。

图5 不同甲醇浓度下发酵过程毕赤酵母生长情况Fig.5 Time course of biomass for the expression of SAM by P.pastoris transformant in shake flasks

图6 不同甲醇浓度下发酵过程SAM变化Fig.6 Time course for the expression of SAM by P.pastoris transformant in shake flasks
分析不同甲醇浓度下SAM产量的变化速率,可以发现SAM浓度变化可以分为2个阶段:第一阶段在24~96 h之间,SAM产量的增加速率基本上为一定值,计算发酵24~96 h之间的SAM生产速率,结果见表2。由表2可见,随着甲醇浓度的增加,SAM生产速率先呈现上升趋势,在10~30 g/L甲醇浓度下SAM生产速率最大,均达到0.017 g/(L·h);甲醇浓度大于30 g/L,SAM生产速率又呈现下降趋势,至60 g/L时降至0.007 g/(L·h)。
第二阶段为发酵96 h之后,SAM的产量进入一个相对稳定的状态,甲醇浓度小于30 g/L,SAM含量仍然呈现增加的趋势,其中15 g/L甲醇浓度下SAM生产速率略大于10 g/L,因此最终15 g/L条件下SAM产量更高;而控制甲醇浓度在30 g/L以上进行发酵,SAM含量不变或下降,表现出明显的底物抑制现象。由此可见,发酵过程中不同的甲醇浓度对SAM的产量及L-蛋氨酸的利用有比较大的影响,其中以15 g/L的甲醇最有利。
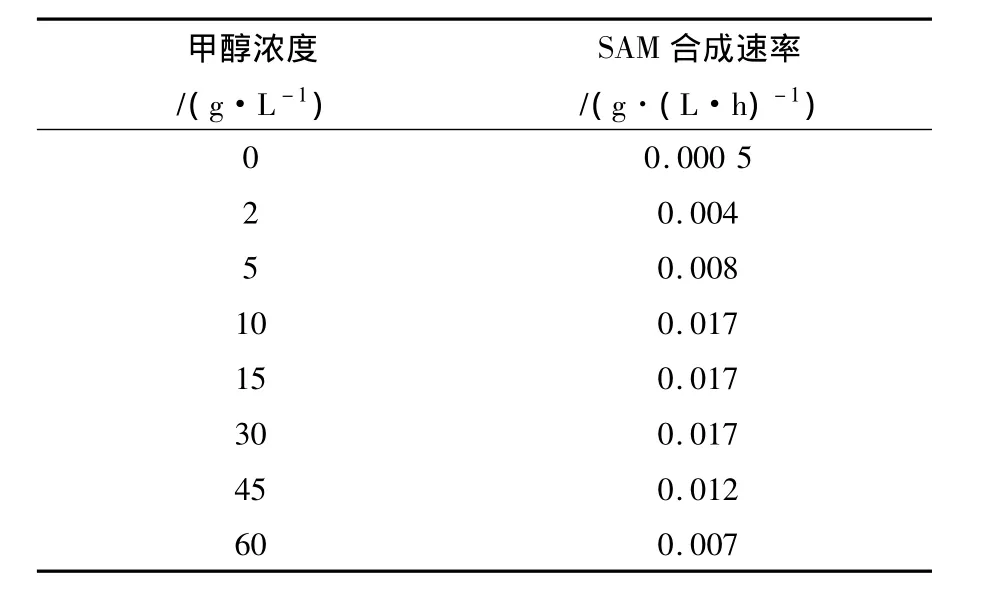
表2 不同甲醇浓度下的SAM生产速率(发酵24~96 h)Table 2 Effect of different methanol concentration on SAM production rate

图7 甲醇对毕赤酵母摇瓶发酵生产SAM影响的考察结果Fig.7 Comparison of SAM production with different Methanol concentration in P.pastoris fermentaion
以甲醇浓度作为横坐标对SAM最大产量进行作图,得到图7。由图7可见,SAM产量随甲醇浓度的增加呈现先增加再下降的趋势。因为在甲醇诱导阶段,一方面甲醇作为碳源用于细胞的生长、代谢,另一方面,甲醇又作为诱导物,诱导SAM合成酶的产生,催化ATP和L-蛋氨酸合成SAM。细胞生长需要消耗大量的能量,发酵液中甲醇浓度过低,细胞处于饥饿状态,没有足够的能量用于菌体的生长代谢及SAM的合成,SAM的产量偏低;增加发酵液中的甲醇浓度,可以提供充足的能量供细胞利用。此外,适当增加甲醇浓度,也可以提高甲醇氧化酶基因的活性,使SAM合成酶的表达量增加,进而增加SAM的合成;但是,发酵液中甲醇浓度过高,又会抑制细胞的生长、减弱细胞的代谢甚至导致细胞的死亡[19],因此,过高的甲醇浓度又会导致SAM的产量下降。
3 讨论
毕赤酵母摇瓶发酵生产SAM过程中,L-蛋氨酸浓度及甲醇浓度对SAM产量有显著的影响。发酵培养基中添加不同初始浓度的L-蛋氨酸,SAM产量呈现先增加再下降的趋势,其中以添加7.5 g/L L-蛋氨酸的SAM产量最高,达到0.81 g/L;发酵过程控制甲醇浓度在10~30 g/L之间,最有利于SAM的生产,24~96 h之间SAM生产速率达到0.017 g/(L·h);15 g/L甲醇浓度下获得的SAM产量最高,达到1.41 g/L,相比每隔24 h补加1%甲醇的对照组,SAM产量提高了21%。
[1] Mato J M,Shelly C.Role of S-adenosyl-L-methionine in liver health and injury[J].Hepatology,2007,45(5):1306-1312.
[2] Purohit V,Abdelmalek M F,Barve S,et al.Role of S-adenosylmethionine,folate,and betaine in the treatment of alcoholic liver disease:summary of a symposium[J].The American Journal of Clinical Nutrition,2007,86(1):14-24.
[3] Shukeir N,Pakneshan P,Chen G,et al.Alteration of the methylation status of tumor-promoting genes decreases prostate cancer cell invasiveness and tumorigenesis in vitro and in vivo[J].Cancer Research,2006,66(18):9202-9210.
[4] Bottiglieri T,Hyland K,Reynolds E H.The clinical potential of ademetionine(S-adenosylmethionine)in neurological disorders[J].Drugs,1994,48(2):137-152.
[5] 陶敏,干信.S-腺苷甲硫氨酸合成酶在大肠埃希菌中的克隆与表达[J].生物技术,2006,16(3):20-22.
[6] Zhang X,Fen M,Shi X,et al.Overexpression of yeast S-adenosylmethionine synthetase metK in Streptomyces actuosus leads to increased production of nosiheptide[J].Applied Microbiology Biotechnology,2008,78(6):991-995.
[7] 王杰鹏,谭天伟.发酵法生产S-腺苷蛋氨酸前体蛋氨酸补加策略[J].生物工程学报,2008,24(10):1824-1827.
[8] 李东阳,于健,田露,等.利用重组Pichia pastoris生产腺苷甲硫氨酸[J].生物工程学报,2002,18(3):295-299.
[9] 朱志钢,储炬,胡晓清,等.重组毕赤酵母发酵生产S-腺苷甲硫氨酸培养条件优化[J].工业微生物,2006,36(3):1-4.
[10] Zhang J,Wang X,Su E,et al.A new fermentation strategy for S-adenosylmethionine production in recombinant Pichia pastoris[J].Biochemical Engineering Journal,2008,41(1):74-78.
[11] Surribas A,Cos O,Motesinos J L,et al.On-line monitoring of the methanol concentration in Pichia pastoris cultures producing an heterologous lipase by sequential injection analysis[J].Biotechnology Letters,2003,25(21):1795-1800.
[12] Crowley J,McCarthy B,Nicholas S,et al.Monitoring a recombinant Pichia pastoris fed batch process using Fourier transform mid-infrared spectroscopy(FT-MIRS)[J].Biotechnology Letters,2000,22(24):1907-1912.
[13] 余波,戴小峰,张社,等.变色酸分光光度法测定毕赤酵母发酵液中的甲醇含量[J].上海大学学报(自然科学版),2006,12(2):196-199.
[14] 张建国,王学东,张鲁嘉,等.利用Pichia pastoris生产S-腺苷甲硫氨酸的发酵工艺[J].工业微生物,2008,38(3):6-11.
[15] 邓娟娟.利用重组毕赤酵母发酵生产S-腺苷甲硫氨酸工艺的研究[D].华中农业大学,2006.
[16] Hu H,Qian J,Chu J,et al.Optimization of L-methionine feeding strategy for improving S-adenosyl-L-methionine production by methionine adenosyltransferase overexpressed Pichia pastoris[J].Applied Microbiology Biotechnology,2009,83(6):1105-1114.
[17] Anderlund M,Nissen T L,Jens N,et al.Expression of the Escherichia coli pntA and pntB genes,encoding nicotinamide nucleotide transhydrogenase,in Saccharomyces cerevisiae and its effect on product formation during anaerobic glucose fermentation[J].Applied and Environmental Microbiology,1999,65(6):2333-2340.
[18] Thomas D,Rothstein R,Rosenberg N,et al.SAM2 encodes the second methionine S-adenosyl transferase in Saccharomyces cerevisiae:physiology and regulation of both enzymes[J].Molecular and Cellular Biology,1988,8(12):5132-5139.
[19] 王水莲,张建勇,刘杰,等.不同甲醇流加策略对重组毕赤酵母发酵生产腺苷蛋氨酸的影响[J].齐鲁药事,2006,25(12):756-757.
