微小毛霉凝乳酶的分离纯化研究
2012-01-12高维东宋礼纪银莉何潇张玉平甘伯中
高维东,宋礼,纪银莉,何潇,张玉平,甘伯中
(1.甘肃华羚生物技术研究中心,甘肃兰州730000;2.甘肃农业大学食品科学与工程学院,甘肃兰州730070)
凝乳酶是生产奶酪及凝乳酶干酪素中使牛乳凝固的关键性酶,它是一种天冬氨酸蛋白酶,其主要的生物学功能是限制性剪切酪蛋白Phe105~Met106之间的肽键,从而导致牛奶的凝结,因此被广泛应用于奶酪制造业和干酪素产业[1]。凝乳酶来源广泛,在动植物以及微生物中都有,传统的凝乳酶来源于小牛的皱胃,但是随着世界奶酪产业的不断壮大,单纯靠宰杀大量的小牛获取凝乳酶显然与现代工业的发展不相符,植物凝乳酶虽然来源广泛,但是其蛋白水解力强,并且受时间、地点等的限制难以发展[2-3],微生物生长周期短,产量大,受气候、地域、时间限制小,用其生产凝乳酶成本较低,酶提取方便,经济效益高。微生物凝乳酶从1965年起开始取代小牛皱胃酶制造干酪以来,成功地弥补了小牛凝乳酶短缺的问题[4],并在奶酪制造业与干酪素产业中得到了广泛应用。
1 材料与方法
1.1 材料
1.1.1 主要材料与试剂微小毛酶HL-1,中国科学院微生物研究所保藏菌株,经本实验室紫外线和亚硝基胍诱变筛选得到;脱脂奶粉,完达山乳制品有限公司;标准分子量蛋白,美国Sigma公司;其他生化试剂均为国产分析纯。
1.1.2 培养基①斜面培养基:马铃薯(去皮切块)200 g,葡萄糖20 g,琼脂17.3 g,自来水1 000 mL。将马铃薯去皮切块,加1 000 mL自来水,在电炉上80℃加热1 h,用纱布过滤,补加自来水至1 000 mL,加入葡萄糖和琼脂,加热溶解,分装,121℃高压灭菌20 min待用[5];②液体种子培养基:麸皮水解液30 mL,硝酸铵0.5 g,蔗糖1 g,磷酸二氢钾0.2 g;③三角瓶发酵培养基:粉碎后新鲜麸皮30 g、硝酸铵0.3 g和磷酸氢二钾0.5 g加入到500 mL三角烧瓶内,按1∶0.8加入自来水,搅拌均匀,在121℃下灭菌25 min待用;④浸提液:0.85%的氯化钠溶液[6-7]。
1.1.3 主要仪器与设备UV2450紫外可见分光光度计,日本SHIMADZU;BIO-RAD垂直板电泳仪,美国BIO-RAD公司;恒温培养箱,上海一恒科技有限公司;高速冷冻离心机,长沙湘仪离心机有限公司;超净工作台,苏州净化设备有限公司;超滤仪,美国Millipore公司;真空冷冻干燥机,长沙湘仪离心机仪器设备有限公司;纯水机,重庆力德高端水处理设备有限公司;蛋白质层析系统AKTA purifier,美国GE医疗集团公司。
1.2 方法
1.2.1 凝乳酶活力的测定方法Arima方法:用0.01 mol/L的氯化钙液配制10%脱脂奶粉液,此溶液配制后在室温放置40 min以上使用,当天使用有效,不宜冰箱放置[8]。取5 mL 10%的脱脂奶粉液在35℃保温10 min,加0.5 mL适当稀释的酶液(35℃保温),立即摇匀,开始计时(凝乳时间控制在40~90 s),并把试管倾斜45°以上。在水浴中震荡试管,观察壁上出现小颗粒为终点,记录凝乳时间。在上述条件下,40 min凝1 mL 10%脱脂奶粉的酶量定义为一个Soxhlet单位(SU)[9]。

式中:2 400为40 min的凝乳时间,s;D为酶液稀释倍数;t为反应时间。
1.2.2 凝乳酶制剂的制备方法将配置好的发酵培养基按14%接种,28℃下发酵72 h后待用。
1.2.3 浸提温度对酶提取的影响分别在20、25、30、35、40、45℃下将发酵完全的培养基加入0.85%氯化钠溶液里浸提12 h,除去固体物后测定凝乳酶活力。每个样做3个平行试验,取平均值做结果分析。
1.2.4 浸提时间对酶提取的影响30℃下在浸提罐中加入0.85%氯化钠溶液,分别浸提2、4、6、8、10、12、14 h,除去固形物测定凝乳酶的活力。每个样做3个平行试验,取平均值做结果分析。
1.2.5 浸提液pH对酶提取的影响将0.85%氯化钠溶液的pH分别调整为5.5、6.0、6.5、7.0、7.5,在不同pH条件下浸提培养物10 h,除去固形物测定凝乳酶活力。每个样做3个平行试验,取平均值做结果分析。
1.2.6 浸提液离子强度对酶提取的影响调整浸提液氯化钠的浓度,分别配制浓度为0.6%、0.8%、1.0%、1.2%、1.4%、1.6%的氯化钠浸提液,浸提10 h,除去固形物测定凝乳酶活力。每个样做3个平行试验,取平均值做结果分析。
1.2.7 浸提液加入比例对酶提取的影响分别按物料与浸提液质量比1∶3、1∶4、1∶5、1∶6、1∶7加入浸提液,在30℃下提取10 h,除去固形物测定凝乳酶活力。每个样做3个平行试验,取平均值做结果分析。
1.2.8 离心沉降对酶活力的影响浸提物以200目的滤布除去固形物,得到的粗酶液分别在6 000、8 000、10 000、12 000、14 000 r/min下离心10 min,测定离心后的上清液凝乳酶活力。每个样做3个平行试验,取平均值做结果分析。
1.2.9 膜法对凝乳酶的纯化离心后的粗酶液利用微滤及浓缩技术,经过1 μm熔喷滤芯、1 μm PP折叠滤芯、0.2 μm PES折叠滤芯、0.45 μm PES折叠滤芯和0.45 μm PP折叠滤芯等5步过滤,除去发酵液中的培养基杂质、菌丝体、菌体和部分大分子杂蛋白,实现了酶液的澄清,再经过8 000分子量的超滤膜除去大量的水分,实现酶液的浓缩,测定酶活。
1.2.10 有机溶剂沉淀法对凝乳酶的纯化离心后的粗酶液加乙醇(95%),其比值为1∶0.6(体积比),静置4 h,离心取上清液加乙醇(95%),其比值为1∶0.8(体积比),静置过夜,离心,沉淀用10倍体积pH 5.0的0.05 mol/L醋酸缓冲液溶解,测定酶活。
1.2.11 层析法对凝乳酶的纯化利用美国通用医疗集团的AKTAprocess蛋白质层析仪,用S300和G100的填料进行微小毛霉凝乳酶蛋白的分离纯化,实现了凝乳酶蛋白的自动化分离纯化,分部收集,测定收集液酶活。
2 结果与分析
2.1 浸提温度对酶提取的影响
由图1可以看出,30℃浸提活力最高,酶活为5 450 U/mL。温度过低,不利于酶从菌丝体及培养物基质中释放出来,温度过高会对酶蛋白的热稳定性造成影响,同时易被微生物降解利用。
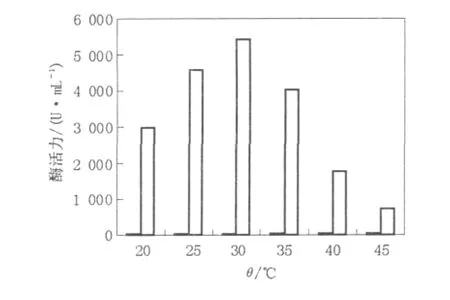
图1 浸提温度对酶提取的影响Fig.1 Effects of reaction temperature on enzyme extraction
2.2 浸提时间对酶提取的影响
由图2可以看出,浸提10 h,浸提液凝乳酶活力较高,酶活为4 870 U/mL。随着浸提时间的延长,凝乳酶逐渐释放到浸提液中,但由于酶蛋白的稳定性及微生物的降解作用,活力从10 h后逐渐降低。
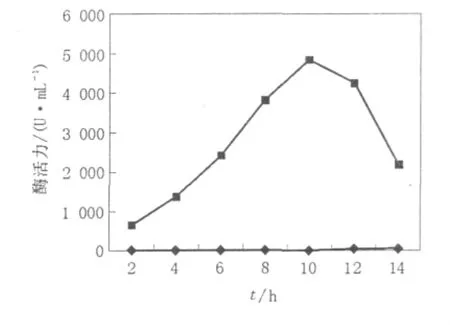
图2 浸提时间对酶提取的影响Fig.2 Effects of time on enzyme extraction
2.3 浸提液pH对酶提取的影响
由图3可以看出,当浸提液的pH值在6.5时,凝乳酶有较高的回收率,酶活为4 120 U/mL。微小毛酶凝乳酶的最适pH值为5.8左右,所以在酸性条件下浸提,更有利于微小毛霉凝乳酶的释放。
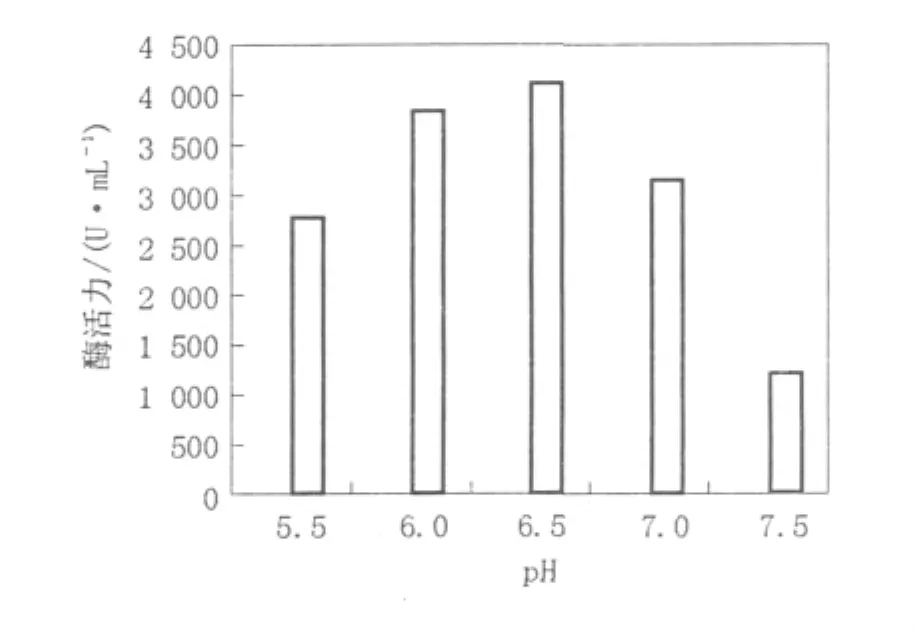
图3 浸提液pH值对酶提取的影响Fig.3 Effects of pH on the enzyme extraction
2.4 浸提液离子强度对酶提取的影响
由图4可以看出,1%的氯化钠有利于凝乳酶的提取,酶活为5 570 U/mL。当氯化钠浓度过高或过低时,会偏离菌丝体的等渗点,阻碍凝乳酶的释放。
2.5 浸提液加入比例对酶提取的影响
由图5可以看出,1∶5的固液比有利于凝乳酶的提取,酶活为4 730 U/mL。固液比太低,不利于凝乳酶从菌丝体及基质中释放;固液比过高,酶浓度会降低造成酶活的降低,同时间接对后期酶的提取浓缩增加生产成本。
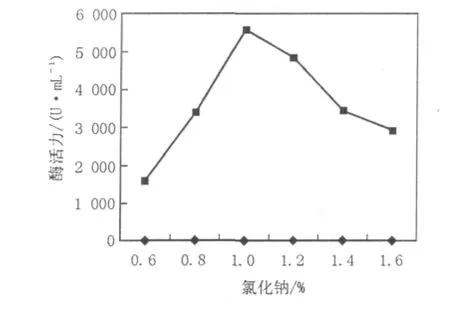
图4 浸提液离子强度对酶提取的影响Fig.4 Effects of ion concentration on the enzyme extraction
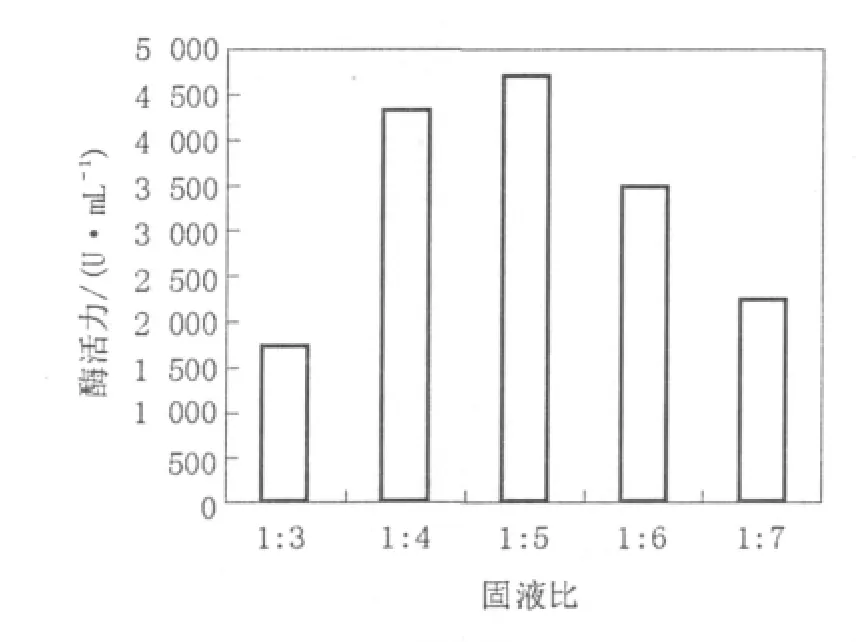
图5 固液比对酶提取的影响Fig.5 Effects of Solid-liquid ratio on the enzyme extraction
2.6 离心力对酶活力的影响
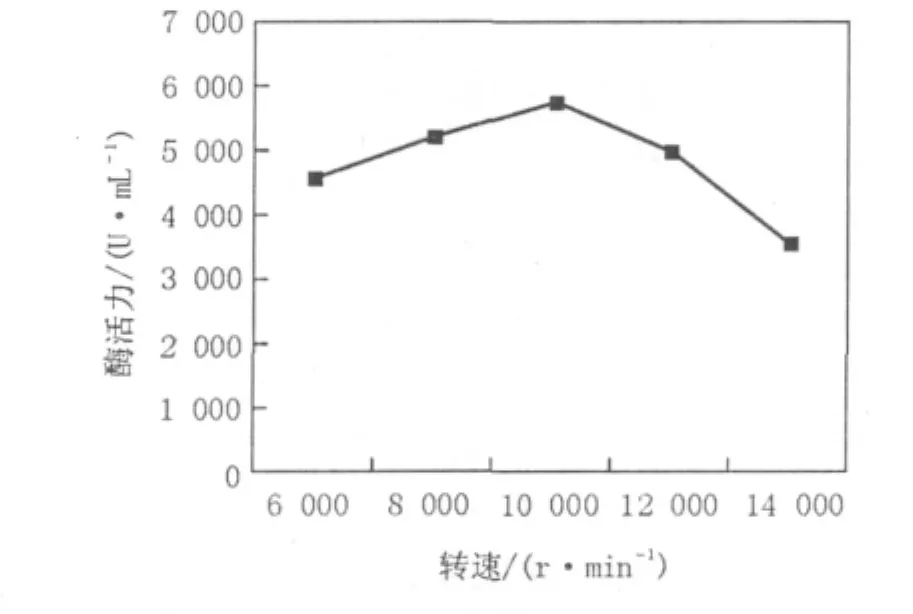
图6 离心力对酶提取的影响Fig.6 Effects of Centrifugal force on the enzyme extraction
由图6可以看出,10 000 r/min离心10 min凝乳酶的回收率最高,酶活为5 720 U/mL。离心力较低,杂质及杂蛋白去除不完全,酶活较低。离心力过高,会造成部分酶蛋白的沉淀及损伤,酶活也不高。
2.7 膜法对凝乳酶的纯化
经过5次过滤,1次浓缩后,凝乳酶样品浓缩8倍,活力提高约6倍,酶活为34 227 U/mL。由于除去了部分杂蛋白、小分子糖类、无机盐及水,酶液酶活极大提高,但酶液通过滤芯和滤膜时,酶蛋白会有部分损伤,酶活提高倍数和浓缩倍数无明显的对应关系。同时试验中也发现浓缩倍数越高,酶蛋白损伤也就越大。试验中减少膜超滤时间,降低浓缩倍数,采用5倍浓缩粗酶液,酶活约提高了4.5倍,酶活为25 765 U/mL。
2.8 有机溶剂沉淀法对凝乳酶的纯化
经过有机溶剂浸提后,样品浓缩50倍,活力提高约17倍,酶活为97 543 U/mL。通过沉淀法得到凝乳酶溶液,浓缩倍数及酶活比膜过滤法纯化凝乳酶都有所提高,但从浓缩倍数及活力提高倍数对应关系可以看到,有机溶剂沉淀法对酶活损失也较大。由于有机溶剂的使用量大,在后期工业化应用中,有机溶剂的回收及安全使用必成为工业化推广着重考虑的问题。
2.9 层析法对凝乳酶的分离提纯
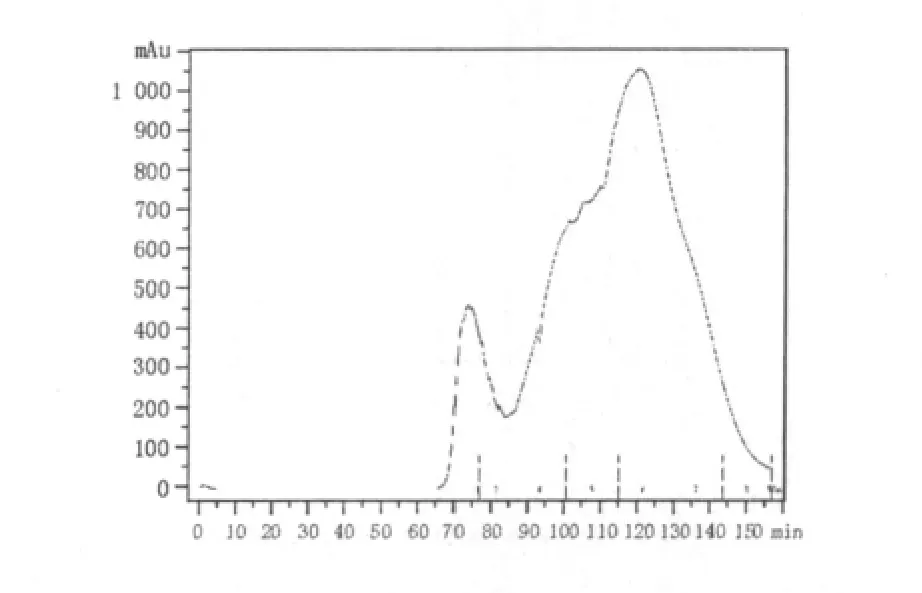
图7 层析法对凝乳酶的分离提纯Fig.7 Chromatography for separation and purification of chymosin
利用AKTAprocess蛋白质层析仪层析样品后,由图7可以看出,凝乳酶的保留时间在110~130 min之间,分离纯化后,凝乳酶蛋白纯度达到95%以上,收集酶液酶活为52 786 U/mL。利用层析法获得了较纯的凝乳酶,粗酶液浓缩了15倍,凝乳酶酶活提高约10倍,酶活损失最小。与膜法对凝乳酶纯化相比,层析对凝乳酶的纯化效果较好,但层析处理量小,填料昂贵,不适合工业化推广。
3 讨论
试验结果表明微小毛霉(HL-1)凝乳酶的最适提取条件:浸提温度30℃;浸提液pH 6.5;浸提时间10 h;浸提液氯化钠浓度1%;物料与浸提液比例为1∶5;在10 000 r/min下离心10 min,粗酶液提取效果最好。95%的乙醇沉淀纯化凝乳酶,浓缩倍数及酶活提高倍数较好,但工业化推广中乙醇的安全使用及回收成本较高。层析纯化凝乳酶,酶活损失最小,纯化效果最好,但填料昂贵,处理量小,不适合工业化推广。膜法纯化凝乳酶,通过控制膜处理时间,降低浓缩倍数,酶活损失可以降到最小,适合工业化推广。
[1] 钱世钧,张纯青.微小毛霉凝乳酶的纯化和性质研究[J].微生物学报,1989,29(4):272-277.
[2] 周俊清,林亲录.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004,2(4):6-9.
[3] 姜峰,张兰威.我国凝乳酶特性及其替代品的研究现状[J].食品研究与开发,2003,24(6):3-6.
[4] 郭广远,姜成林,马俊.微生物凝乳酶的研制Ⅰ.菌株的筛选、发酵制备及毒性[J].微生物学通报,1988,15(5):207-210.
[5] 矫庆华,钱世钧,孟广震.微小毛霉凝乳酶的生物合成和性质的研究[J].微生物学报,1992,32(1):30-35.
[6] 孙建,宋晓红,卢孟柱,等.总状毛霉凝乳酶的研制及初步应用[J].微生物学通报,1994,21(1):5-10.
[7] 周俊清,林亲录,赵谋明.产高效凝乳酶菌株获得方法的探讨[J].食品科学,2005,26(3):253-256.
[8] 甘伯中,高维东,丁福军,等.微生物凝乳酶固体发酵条件的研究[J].食品工业科技,2008,29(4):196-198.
[9] Arima K,Yu J,Iwasaki S.Milk-clotting enzyme from Mucor Pussilus[J].In methods in enzymology Academic,1970,19(3):446-460.
