甲型副伤寒杆菌重组蛋白Omp W的表达与鉴定*
2011-08-21林飞飞冯康乐雷银蕉戎春浩
林飞飞,冯康乐,雷银蕉,戎春浩,盛 思,阮 萍
沙门菌(Salmonella)是一类兼性胞内寄生菌。沙门菌血清型众多,其中伤寒沙门菌和副伤寒沙门菌感染引起的伤寒和副伤寒是发展中国家高发的肠道传染病,每年导致近60万人死亡,我国每年报告伤寒及副伤寒病例数近2万例。近年来,甲型副伤寒沙门菌在我国开始流行,在一些省或自治区人群中超过伤寒沙门菌而成为优势菌型[1-2],且甲型副伤寒沙门菌耐药性逐年增强。目前我国普遍采用以荚膜多糖为抗原的Vi疫苗来预防伤寒或副伤寒,但甲型副伤寒杆菌无多糖荚膜,故Vi疫苗无预防甲型副伤寒效果[3]。因此,筛选甲型副伤寒杆菌保护性表面蛋白抗原,进而研制甲型副伤寒疫苗,对于预防和控制甲型副伤寒的流行具有重要意义。
外膜蛋白(outer membrane proteins,OMP)通常是沙门菌等革兰阴性细菌主要表面抗原之一。根据甲型副伤寒杆菌全基因组序列[4],该菌至少有21个OMP编码基因,其中肯定的主要OMPs有spaO、omp A、omp C、omp N、ompS、omp W、nmp C等,根据查阅文献,spaO、omp A和nmp C等已有报道或正在研究之中,故根据甲副伤寒杆菌ATCC9150株全基因组序列中对omp W基因产物“Surface antigen”的诠释,我们选择了omp W作为研究对象,进行其基因产物的研究。本研究中,我们检测了我国甲型副伤寒杆菌临床菌株中omp W基因携带率,构建了omp W基因原核表达系统并鉴定了重组表达产物r Omp W的免疫原性,以期为r Omp W用作甲型副伤寒杆菌基因工程疫苗抗原提供依据。
1 材料与方法
1.1 菌株来源及培养 甲型副伤寒杆菌参考标准株50001购自北京中国药品生物制品检定所。95株分离自患者并经系统细菌学鉴定的甲型副伤寒杆菌株由浙江省宁波市和温岭市疾病预防控制中心提供。上述菌株采用细菌营养肉汤或其琼脂(Oxoid)培养。原核表达载体p ET42a-E.coliBL21DE3由浙江大学医学院严杰教授惠赠。
1.2 PCR 采用细菌基因组DNA提取试剂盒(BioColor)提取上述菌株基因组 DNA,提取的DNA并溶于TE缓冲液中,采用分光光度法测定DNA浓度和纯度。根据GenBank中omp W基因序列以及限制性核酸内切酶位点分析结果,自行设计扩增全长omp W基因的PCR引物:上游5’-GCG CAT ATG (NdeI)GTG GCG GCA CAG GCG TT-3’,下游5’-GCG CTC GAG (XhoI)GAA ACG ATA GCC TGC CGA-3’。PCR引物由上海Introvigen公司合成。PCR总体积100μL,内含2.5 mol/L各d NTP、250 nmol/L各引物、2.5 U Taq-Pfu DNA聚合酶混合物、100 ng DNA模板和1×PCR缓冲液(TaKaRa)。PCR参数:94℃5 min;94℃30 s,55℃30 s,72℃90 s,30个循环;72 ℃10 min。采用1μg/m L溴乙锭预染色的1.5%琼脂糖凝胶电泳检测扩增产物,目的产物预期大小为624 bp。
1.3 T-A克隆和原核表达系统构建 采用T-A克隆试剂盒(BioDev-Tech)将甲型副伤寒杆菌JH01临床菌株omp W基因扩增片段克隆至PMD18-T中形成重组质粒PMD18-TompW,转化入E.coliDH5α并在LB培养液(Oxoid)中扩增,采用小量质粒试剂提取盒(BioDev-Tech)提取质粒,委托上海Introvigen公司测序。分别将PMD18-TompW及原核表达载体p ET42a(Novagen)用核酸内切酶NdeI和XhoI(TaKaRa)双酶切,回收的omp W基因片段与线性化p ET42a用T4 DNA连接酶(Ta KaRa)连接形成重组表达载体p ET42aompW。将p ET42aompW转化入表达宿主菌E.coliBL21DE3(Novagen)形成E.coliBL21DE3pET42a-ompW,该重组工程菌在LB培养液中扩增后提取质粒再次测序。
1.4 目的重组蛋白表达和免疫原性鉴定 采用分别含0.1和0.5 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG,Sigma)的LB培养液,37℃震荡培养4 h,以诱导E.coliBL21DE3pET42a-ompW表达目的重组蛋白r Omp W。用12%分离胶的 SDS-PAGE(Sigma)和Bio-Rad凝胶图象分析系统检查r Omp W表达情况及产量,采用 Ni-NTA亲和层析柱(BioColor)提纯r Omp W。将1 mg r Omp W与弗氏完全佐剂混合后背部皮内免疫家兔4次,每次间隔1 w,末次免疫后2 w采集心血并分离血清,采用免疫双扩散法检测抗血清的效价。分别以1∶200稀释的r Omp W兔抗血清和1∶500稀释的自制甲型副伤寒杆菌50001株全菌兔抗血清为一抗,1∶3 000稀释的HRP标记羊抗兔IgG(Jackson Immuno Research)为二抗,采用Western Blot检测r Omp W的抗原性和免疫反应性。
1.5 临床菌株omp W基因携带率检测 按上法采用PCR检测95株甲型副伤寒杆菌临床菌株omp W基因的携带情况。
2 结 果
2.1 PCR检测结果 甲型副伤寒杆菌50001株及JH01株基因组DNA中均扩增出预期大小的omp W基因片段(图1)。
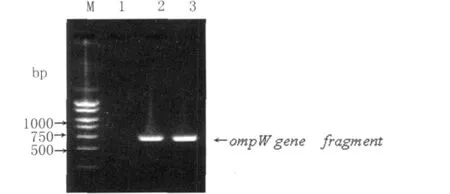
图1 甲型副伤寒杆菌菌株中扩增的ompW基因目的条带Fig.1 The amplification fragments of target gene and DNA segmentsM:marker(Biocolor);Lane 1:the blank control;Lane 2 and 3:the amplification fragments of the omp W genes from a S.paratyphi A strain 50001 and No.JH01,respectively.
2.2 序列分析结果 与报道的omp W基因序列(Gen Bank No.:CP000026)比较,甲型副伤寒杆菌50001株及包括JH01株在内的10株甲型副伤寒杆菌临床菌株omp W基因核苷酸和氨基酸序列相似性均为100%。PMD18-TompW与p ET42aompW中插入的omp W基因基因序列完全相同。上述序列比较时不包括引物序列。
2.3 r Omp W表达和提纯效果 IPTG能有效地诱导E.coliBL21DE3pET42a-ompW表 达r Omp W,其 表 达量约占细菌总蛋白的25%,Ni-NTA亲和层析法提纯的r Omp W在分离胶中显示为单一的蛋白条带。
2.4 r Omp W的抗原性和免疫反应性 r Omp W能免疫家兔后能产生抗体。Western blot结果证实,甲型副伤寒杆菌全菌抗血清及兔抗r Omp W血清均能识别r Omp W并产生阳性反应。
2.5 临床菌株omp W基因携带率 PCR结果显示,所有甲型副伤寒杆菌临床菌株(95/95)均携带omp W基因。
3 讨 论
OMP是革兰阴性菌主要表面蛋白抗原。有研究证实,沙门菌OMP可有效地诱导机体产生淋巴细胞增殖反应[5-6],一些副伤寒杆菌OMP可诱导患者或实验感染动物中产生高效价抗体[7-8]。2004年,McClelland等报告了甲副伤寒杆菌ATCC9150株全基因组序列[4],至少有二十个明确的OMPs或推测的OMPs基因得到诠释,其中肯定的甲副伤寒杆菌主要 OMPs有spaO、omp A、ompC、omp N、ompS、omp W、nmp C,这为研究甲副伤寒杆菌OMPs及其免疫性提供了坚实的基础。众所周知,与抗原构造较为简单的病毒不同,细菌是抗原构造复杂多样的原核细胞型微生物,单一细菌OMP抗原的抗体作用靶点极为有限,难以获得理想的免疫保护效果,故至今从未有以单一蛋白抗原。我们认为,必须采用多种细菌表面蛋白同时作为免疫原,才有可能获得良好的免疫保护效果。因此,在甲型副伤寒杆菌SpaO、Omp A、H1a和nmp C抗原研究基础上[9-11],根 据 甲 副 伤 寒 杆 菌 全 基 因 组 序 列 中 对omp W基因产物“Surface antigen”的诠释,进一步研究了其基因产物,以期获得更多的多价基因工程疫苗候选抗原。
本研究中,我们采用PCR和T-A克隆法从甲型副伤寒杆菌50001株及包括JH01株在内的10株甲型副伤寒杆菌临床菌株omp W基因克隆。与报 道 的omp W基 因 序 列 (GenBank No.:CP000026)比较,上述克隆的甲型副伤寒杆菌omp W基因核苷酸和氨基酸序列相似性均为100%,表明omp W基因序列极为保守。r Omp W免疫家兔后能产生特异性抗体,r Omp W不仅能与其抗血清结合,也能与甲型副伤寒杆菌全菌抗血清发生免疫反应,表明r Omp W具有良好的抗原性和免疫反应性。此外,蛋白抗原基因在不同来源菌株中分布广泛,也是确定其能否作为基因工程疫苗候选抗原的基本条件之一。我们的PCR结果显示,所有受试的95株甲型副伤寒杆菌临床菌株均携带omp W基因。上述结果提示,Omp W为甲型副伤寒杆菌分布广泛且自然表达的外膜蛋白,可作为多价基因工程疫苗的候选抗原。
[1]秦淑文,陈恩富,谢淑云,等.2004-2006年浙江省沿海地区伤寒副伤寒疫情及监测结果分析[J].中国预防医学杂志,2008,9(4):284-286.
[2]储从家,孔繁林,吴惠玲,等.3888例甲型副伤寒流行病学调查[J].云南医药,2008,29(1):57.
[3]Parry CM,Hhien TT,Dougan G,et al.Typhoid fever[J].N Engl J Med,2002,347(22):1770-1782.
[4]McClelland M,Sanderson KE,Clifton SW,et al.Comparison of genome degradation in Paratyphi A and Thphi,human-restricted serovars ofSalmonnellaentericathat cause typhoid[J].Nat Genet,2004,36:1268-1274.
[5]Gonzalez CR,Isibasi A,Ortiz-Navarrete V,et al.Lymphocytic proliferative response to outer membrane protein isolated fromSamonella[J].J Microbiol Immunol,1993,37:793-799.
[6]McSorley SJ,Cookson BT,Jenkins MK,et al.Characterization of CD4+cell responses during natural infection withSalmonella typhimurium[J].J Immunol,2000,164:986-993.
[7]Korbsrisate S,Sarasombath S,Ekpo P,et al.Molecular cloning and expression ofSalmonellaparatyphiA 52 kDa specific protein gene[J].Asian Pac J Allergy Immunol,1994,12:27-37.
[8]Jeannin P,Magistrelli G,Goestsch L,et al.Outer membrane protein A(Omp A):a new pathogen-associated molecular pattern that interacts with antigen presenting cells-impact on vaccine strategies[J].Vaccine,2002,20:A23-A27.
[9〛Ruan P,Xia XP,Sun D,et al.Recombinant SpaO and H1a as immunogens for protection of mice from lethal infection withSalmonellaparatyphiA:Implications for rational design of typhoid fever vaccines[J].Vaccine,2008,26:6639-6644.
[10]蒋锦琴,阮萍,丁威,等.甲型副伤寒杆菌omp A基因分布及重组表达产物的免疫学鉴定[J].中华微生物学和免疫学杂志,2010,30(1):1-5.
[11]吴颖,王艳芳,严杰,等.甲型副伤寒杆菌nmpC基因原核表达及表达产物免疫保护作用[J].中华微生物学和免疫学杂志,2010,30(12):1118-1123.
