结核分枝杆菌肝素结合血凝素与人IL12融合基因重组耻垢分枝杆菌的构建及鉴定*
2011-08-21赵善民毛峰峰郭晓雅张彩勤师长宏
赵 勇,张 海,赵善民,伍 静,毛峰峰,郭晓雅,张彩勤,师长宏
2.第四军医大学西京医院呼吸内科;西安 710032
全球目前约1/3人口处于结核分枝杆菌(Mycobacterium,tuberculosis,MTB)持续感染状态,5%~10%感染者有可能最终发展为活动性结核病(tuberculosis,TB),并成为传播 MTB的重要传染源。耻垢分枝杆菌(Mycobacteriumsmegmatis,Ms)是一种生长快、转化效率高的非致病菌和强的细胞免疫佐剂,其表达的外源蛋白可达MTB的5~10倍,单位时间内分泌的蛋白产量可比MTB增加50~100倍,且对人、小鼠和豚鼠均不致病,因此可代替卡介苗(BCG)而被发展成疫苗载体[1]。
我们将MTB的肝素结合血凝素蛋白(Heparin Binding Hemagglutinin,HBHA)基因和人白细胞介素(interleukin,IL)12基因融合,构建成能携带外源基因并介导其在Ms宿主分泌表达的重组Ms,并对其蛋白的表达和表达的稳定性水平进行了测定。以期获得一种用于MTB治疗的候选疫苗。
1 材料与方法
1.1 材料 大 肠 杆 菌 DH5α、结 核 分 枝 杆 菌H37Rv、耻垢分枝杆菌(Ms)以及穿梭质粒pSMT3由本实验室保存。克隆载体p MD18T、Ex Taq DNA聚合酶、T4链接酶、限制性内切酶BamH I、SalI、SphI、Hind III以及DL2000、异丙基硫代-β-D半乳糖苷(IPTG)均购自大连 Ta KaRa公司;HBHA m Ab为本实验室筛选,hIL12 p Ab购自美国SANTA公司,FITC标记的羊抗鼠和羊抗人IgG购自博士德生物有限公司。
1.2 方法
1.2.1 HBHA及hIL12基因的引物设计 参考GenBank发表的HBHA及hIL12基因序列设计引物,见表1。由北京奥科生物有限公司合成。HBHA F和HBHA R分别引入BamH I和SalI,同时去掉HBHA基因的终止密码TAG;由于hIL12是由P40和P35两个亚基组成,为了保证HBHA和hIL12两亚基的正确折叠,分别在hIL12 P40 F和hIL12 P35 F的引入48 bp和30 bp的Linker及SalI和SphI位点,同时在hIL12 P40 R突变掉TAG终止密码。考虑到后续穿梭载体的构建,我们利用巢式PCR对P35基因542 bp处的BamH I进行点突变设计。利用巢式PCR对BamH I进行点突变。

表1 用于PCR扩增的引物序列Table 1 Primers used in thisstuy
1.2.2 目的基因的扩增及序列测定 以 MTB H37Rv DNA为模板PCR克隆HBHA基因,反应条件为:94℃预变性3 min,94℃30 s,55℃30 s,72℃30 s,72℃延伸3 min,30个循环,扩增MTB HBHA基因。用淋巴细胞分裂液分离人淋巴细胞,RPMI-1640洗涤后加1 m L TRIzol提取中RNA,以此为模板合成cDNA作为hIL12的模板,hIL12 P40 F和hIL12 P40 R扩增hIL12 P40基因;用hIL12 P35 F和hIL12 P35突变R扩增P35的上游542 bp碱基,同时利用hIL12 P35突变F和hIL12 P35 R为引物扩增下游的220 bp;而后利用两次扩增的PCR产物做模板,hIL12 P35 F和hIL12 P35 R为引物,扩增点突变的完整hIL12 P35基因。将所有的扩增产物以1%琼脂糖凝胶电泳鉴定后克隆至p MD18-T载体,酶切鉴定正确后由北京奥科生物有限公司测序。
1.2.3 含HBHA和hIL12基因的结核分枝杆菌穿梭载体的构建 利用BamH I、SalI;SalI、SphI;SphI、Hind III分别酶切测序正确的p MD18THBHA、p MD18T-hIL12 P40、p MD18T-hIL12 P35。通过琼脂糖凝胶电泳相应的基因片段,利用T4 DNA Ligase分步亚克隆到克隆载体p EGM-3zf(+),构建 p EGM-3zf-HBHA-hIL12。BamH I和Hind III双 酶 切 p EGM-3zf-HBHA-hIL12 及 结 核分枝杆菌穿梭质粒pSMT3空载体。凝胶回收HBHA-hIL12的融合基因片段及线性化的pSMT3载体。利用T4 DNA Ligase连接并转化到大肠杆菌DH5α,潮霉素抗性筛选。通过PCR及酶切鉴定获得阳性克隆。
1.2.4Ms感受态的制备及电穿孔转化 将7H9培养基中大量培养的Ms菌株,按1∶100的转接至200 m L 7 H9培养基,37℃培养2d后,按10%体积比加入2 mol/L的甘氨酸,继续培养24 h,冰浴1.5~2 h。4℃12 000 r/min离心20 min收集细菌。菌体用预冷的10%甘油洗涤3次后,以400μL分装备用。取pSMT3-HBHA-hIL12质粒200μL,加入400μL的无水乙醇和20μL醋氨酸(3 mol/L,p H5.2),混匀后-20℃冷却沉淀30 min。4 ℃12 000 rpm/min离心30 min,沉淀用75%乙醇洗涤,-20℃冷却15 min后4℃12 000 r/min离心20 min,白色沉淀无菌条件下风干,加入30μL无菌水重悬后取10μL加入到Ms感受态细胞中,混匀后冰浴10 min,在参数为2.5 KV、25μF、1000Ω的条件进行电穿。电穿完成后将细胞转入5 m L 7 H9中振荡培养4 h后加入5μL潮霉素,继续培养4 h后,将细胞涂布于含有潮霉素的7 H10平板筛选。37℃培养7 d左右挑选克隆进行鉴定。
1.2.5 重组耻垢分枝杆菌的鉴定
1.2.5.1 基因型鉴定 挑选并培养潮霉素抗性筛选的7 H10平板克隆,收集菌液,煮沸30 min,12 000 r/min离心取上清做为模板,利用hIL12 P40 F和hIL12 P35 R为引物,进行PCR鉴定。同时用Ms正常菌株做为阴性对照。
1.2.5.2 间接免疫荧光法鉴定 将基因型鉴定正确的阳性克隆接种于5 m L含潮霉素的7H9培养基中,37℃培养7d后收集菌体,无菌生理盐水洗涤3次,加入正常小牛血清100μL,37℃封闭1h。无菌生理盐水洗涤3次,加入HBHA m Ab,37℃结合2 h,离心后生理盐水洗涤,分别加入500μL PBS和5 μL的1%Evan’s Blue及5μL FITC标记的羊抗鼠IgG,室温避光结合15 min。PBS洗涤,取3μL均匀涂片,用中性树脂进行封片。荧光显微镜下观察结果。同时,利用hIL12 p Ab以相同的方法,观察hIL12在Ms中的表达。均选用正常培养的Ms作为阴性对照。
1.2.6 重组耻垢分枝杆菌生长曲线的测定 分别转接鉴定正确的表达HBHA-hIL12融合蛋白的重组Ms和普通Ms与20 m L 7H9培养液,37℃振荡培养,每隔4 h测定一次培养物OD600的吸光度。测定重组耻垢分枝杆菌对细菌生长速度的影响。绘制生长曲线。
2 结 果
2.1 HBHA及hIL12基因的扩增、克隆和构建以H37Rv DNA为模板进行PCR反应,扩增600 bp大小的HBHA基因;此外,以人淋巴细胞总RNA为模板进行 RT-PCR反应,分别可扩增获得1 032 bp和792 bp的hIL12 P40、hIL12 P35两个亚基,与文献报道的大小基本一致,序列测定表明获得了正确的目的基因,见图1。克隆到结核分枝杆菌穿梭载体pSMT3中后,经过BamH I、SalI、SphI、Hind III组合酶切鉴定,表明获得正确的克隆,见图2。
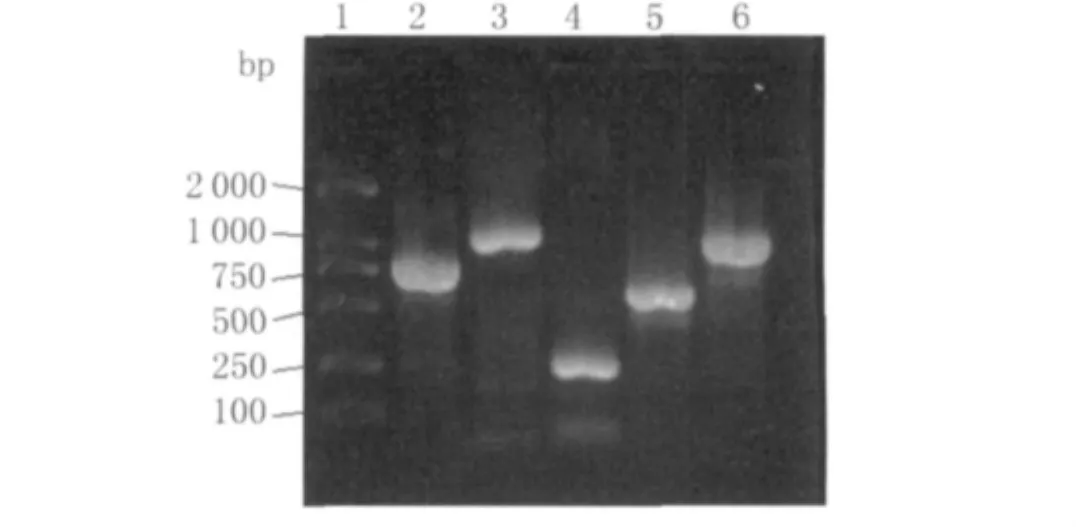
图1 HBHA及h IL12 P40、h IL12 P35基因扩增结果1:DL2000 Marker;2:HBHA基因 RCP扩增产物;3:hIL12 P40基因PCR扩增产物;4:hIL12 P35下游扩增产物;5:hIL12 P35上游扩增产物;6:hIL12 P35基因PCR扩增产物Fig.1 The results of amplification of HBHA,hIL12 P40 and hIL12 P351:DL2000 Marker;2:The products of HBHA;3:The products of hIL12 P40;4:The products of lower part of hIL12 P35;5:The products of upper half of hIL12 P35;6:The products of hIL12 P35
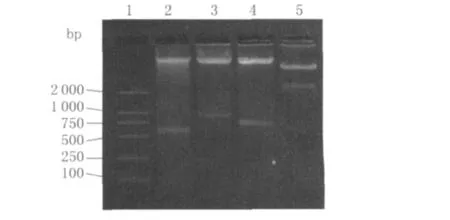
图2 重组质粒pSMT3-HBHA-h IL12的酶切鉴定1:DL2000 Marker;2:Bam H I、Sal I双酶切pSMT3-HBHA-hIL12质粒;3:Sal I、Sph I双酶切 pSMT3-HBHA-hIL12;4:Sph I、Hin d III双酶切切 pSMT3-HBHA-hIL12质 粒;5:Bam H I、Hin d III双 酶 切pSMT3-HBHA-hIL12鉴定Fig.2 Recombinant plasmid pSMT3-HBHA-hIL12 by endounclease digestion1:DL2000 Marker;2: Recombinant plasmid pSMT3-HBHA-hIL12 by Bam H I and Sal I digestion;3:The recombinant plasmid digestioned by Sal I and Sph I;4:Recombinant plasmid digestioned by Sph I and Hin d III;5:The recombinant plasmid digestioned by Bam H I and Hin d III
2.2 重组耻垢分枝杆菌的筛选和鉴定 转接酶切和测序鉴定正确的阳性克隆,37℃培养7 d,收集菌液,提取重组耻垢分枝杆菌基因组DNA。分别以hIL12 P40 F、hIL12 P40 R以及hIL12 P35 F和hIL12 P35 R为引物,进行重组耻垢分枝杆菌的基因鉴定,成功扩增出1 032 bp的hIL12 P40和792 bp的hIL12 P35。用正常培养的Ms作为阴性对照,未能扩增出任何条带,见图3。此外,再通过HBHA m Ab和hIL12 m Ab分别进行了间接性免疫荧光检测。均发现有相应蛋白的表达,见图4。
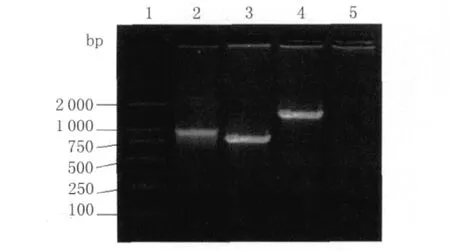
图3 HBHA-h IL12-r Ms的基因型鉴定1:DL2000 Marker;2:从 HBHA-h IL12-r Ms基因组扩增hIL12P40鉴定;3:从 HBHA-h IL12-r Ms基因组扩增hIL12P35鉴定;4:从 HBHA-h IL12-r Ms基因组扩增hIL12鉴定;5:Ms阴性对照Fig.3 Identification of the genotype of the recombinant Mycobacterium smegmatis HBHA-h IL12-r Ms1:DL2 000 Marker;2:The product of h IL12 P40 in HBHA-h IL12-r Ms;3:The product of h IL12 P35 in HBHA-h IL12-r Ms;4:The product of h IL12 in HBHA-h IL12-r Ms;5:Negative control by Ms
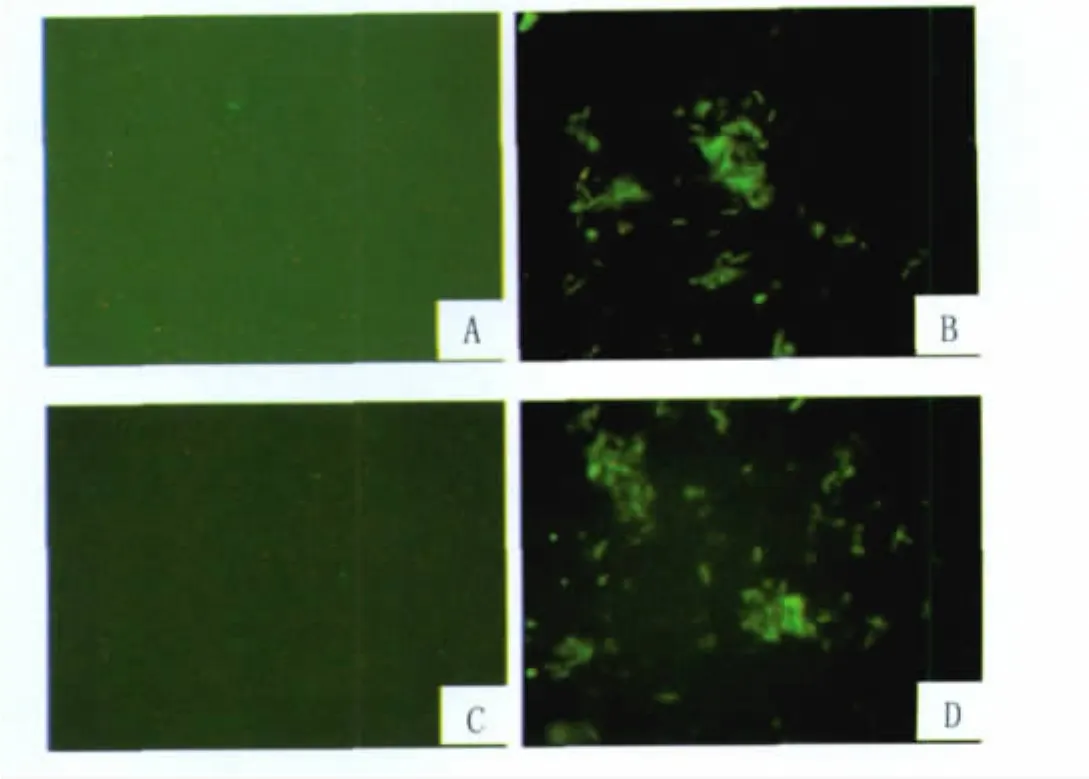
图4 免疫荧光鉴定HBHA和h IL12蛋白在Ms的表达(1 000×)A:HBHA单克隆抗体结合Ms免疫荧光;B:HBHA单克隆抗体结核HBHA-h IL12-r Ms重组耻垢分枝杆菌免疫荧光;C:hIL12多克隆抗体结合Ms免疫荧光;D:hIL12 多 克 隆 抗 体 结 合 HBHA-h IL12-r Ms 免 疫荧光Fig.4 The immunofluorescence identification of the expression of protein in r Ms(1 000×)A:Banding of Ms(Negative control)with anti-HBHA m Ab;B:Banding of HBHA-h IL12-r Ms with anti-HBHA m Ab;C:Banding of Ms with antihIL12 Pc Ab;D:Banding of HBHA-hIL12-r Ms with anti-hIL12 Pc Ab
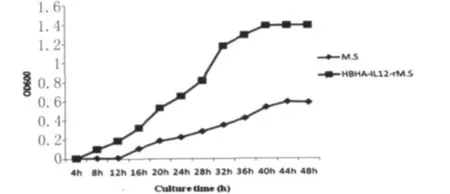
图5 重组HBHA-hIL-12-r Ms与正常Ms生长速度的改变Fig.5 The change of growth rate about the HBHA-hIL-12-r Ms and Ms
2.3 重组耻垢分枝杆菌的生长特性改变 结果如图5所示,可以看出与Ms相比较,重组HBHA-hIL-12-r Ms的生长速度明显加快。
3 讨 论
将外源基因导入分枝杆菌构建成重组分枝杆菌是结核疫苗改造的重要方向之一,目前常用的活疫苗载体主要包括分枝杆菌属、沙门菌、痘苗病毒等,使用分枝杆菌为载体的活疫苗具有以下优点:(1)所表达的保护性抗原不需纯化,可直接用于免疫,免去了蛋白质处理的复杂过程;(2)活疫苗可在体内长期存活并不断表达外源抗原,单次接种即可持续诱导对靶抗原的反应;(3)可根据需要对靶抗原进行修饰;(4)分枝杆菌本身可作为一种强免疫佐剂,提高宿主的免疫力。该方法主要利用基因工程技术将几种外源基因导入分枝杆菌中,依靠宿主表达外源抗原,以诱导对疾病的特异性体液和细胞免疫[4-5]。由于BCG生长缓慢,细胞壁厚且富含脂质,对之进行基因操作比较困难,因此我们更加关注非致病的耻垢分枝杆菌。许多实验已证实应用于动物体内是安全的。在美国Ms作为疫苗佐剂已成功用于TB的预防和治疗,证明了Ms作为活载体疫苗的安全性和可靠性。此外,Ms生长速率快,表达产量高,而且在Ms中表达的MTB相关蛋白与天然蛋白的生化及免疫学特性几乎完全一致[6]。因此,重组耻垢分枝杆菌活疫苗用于MTB感染的治疗时,可以通过恢复保护性免疫,促进单核巨噬细胞产生更多的H2O2和NO,有效清除MTB,增强机体免疫应答能力;还可改变免疫应答的Th1/Th2模式,使免疫应答从Th2型向Th1型偏移,从而有助于机体免疫细胞杀灭MTB,缩短疗程。但由于结核病本身就是一种免疫性疾病,本研究将人IL12基因与结核分子杆菌优势抗原HBHA融合表达,显著增强其免疫效果,而这种增强的免疫效应对机体是否有影响,我们将在后期的动物实验中进行相应的安全性验证。
HBHA是目前已报道的具有治疗效果的MTB靶抗原,可诱导机体产生保护性的免疫应答,减少感染动物主要脏器的荷菌数。并诱导潜伏感染患者特异性CD8+T淋巴细胞反应,产生穿孔素、TNF-α及IFN-γ等细胞因子。在治疗潜伏性结核感染方面具有独特的优势。hIL-12在针对胞内菌的细胞免疫中起着关键作用,它可诱导静止及活化的NK及T细胞产生IFN-γ,促进NK及T细胞的增殖,增强NK细胞的细胞毒作用,促使CTL细胞的成熟,并激活巨噬细胞,增强巨噬细胞对入侵MTB的杀伤作用,且已经作为辅助手段用于结核病的治疗。本研究通过构建表达HBHA-hIL-12融合基因的HBHA-hIL-12-r Ms,以耻垢分枝杆菌为宿主细胞,持续分泌具有生物活性的HBHA-hIL-12融合蛋白;将重组的耻垢分枝杆菌与HBHA单抗和人IL-12抗体反应,进行免疫荧光鉴定,证实两种蛋白的表达。通过连续培养监测 HBHA-hIL-12-r Ms的生长曲线,结果表明重组Ms的生长速度明显增强。我们进一步通过对重组Ms的第2、4、6代分泌的HBHA-hIL-12分别与HBHA单抗和hIL-12抗体作用均有反应(结果未发表)。证实了在重组Ms中表达的稳定性。
融合基因表达产物可有效提高单个优势抗原的治疗效果,已被证实具有明显的协同和增强作用。本研究以耻垢分枝杆菌作为宿主细胞,持续分泌具有生物活性的 HBHA-hIL-12融合蛋白;一方面可使hIL-12在体内持续存在,特异性的促进IFN-γ的分泌,促进NK及T细胞的增殖,增强NK细胞的细胞毒作用,促使CTL细胞的成熟[7-8]。增强宿主对MTB的免疫应答;另一方面可发挥其载体效应,促进HBHA诱导机体产生保护力和免疫应答,增强巨噬细胞对入侵MTB的杀伤作用。从而达到控制体内MTB的目的。
[1]Yue Q,Hu X,Yin W,et al.Immune responses to recombinantMycobacteriumsmegmatisexpressing fused core protein and preS1 peptide of hepatitis B virus in mice[J].J Virol Methods,2007,141(1):41-48.
[2]Temmerman S,Pethe K,Parra M,et al.Methylation-dependent T cell immunity toMycobacteriumtuberculosisheparin-binding hemagglutinin[J].Nat Med,2004,10(9):935-941.
[3]Parra M,Pickett T,Delogu G,et al.The mycobacterial heparinbinding hemagglutinin is a protective antigen in the mouse aerosol challenge model of tuberculosis[J].Infect Immun,2004,72(12):6799-6805.
[4]Dhar N,Rao V,Tyagi A K.Skewing of the Th1/Th2 responses in mice due to variation in the level of expression of an antigen in a recombinant BCG system[J].Immunol Lett,2003,88(3):175-184.
[5]Ohara N,Yamada T.Recombinant BCG vaccines[J].Vaccine,2001,19(30):4089-4098.
[6]Lowrie D B,Tascon R E,Bonato V L D,et al.Therapy of tuberculosis in mice by DNA vaccination[J].Nature,1999,400(6741):269-271.
[7]Zhengjun Yi,Yurong Fub,Chun Yang,et al.Recombinant M.smegmatis vaccine targeted delivering IL-12/GLS into macrophages can induce specific cellular immunity against M.tuberculosis in BALB/c mice[J].Vaccine,2007,25(4):638-648.
[8]Li FR,Wang XG,Deng CY,et al.Immune modulation of cotransplantation mesenchyma l stem cells with islet on T and dendritic cells[J].Clin Exp Immunol,2010,161(2):357-363.
