埃博拉出血热*
2011-08-21马志永史子学王水明王志亮马玉堃
刘 阳,马志永,史子学,王水明,王志亮,马玉堃
2.黑龙江大学生命科学学院,哈尔滨 150080;
3.中国动物卫生与流行病学中心,青岛 266114
埃博拉出血热(Ebola hemorrhagic fever,EHF)1976年首次发生于刚果民主共和国(前扎伊尔)埃博拉河流域,因其引起感染者全身出血症状,故命名为埃博拉出血热。EHF的病原是埃博拉病毒(Ebola virus,EBOV),属于丝状病毒科(Filoviridae)丝状病毒属(Filovirus)成员,是非节段的单股负链RNA病毒。目前已鉴定的EBOV有EBOV-扎伊尔型(Ebola-Zaire,EBOV-Z),EBOV-苏丹型(Ebola-Sudan,EBOV-S),EBOV-科特迪瓦型(Ebola-Ivory Coast,EBOV-C),EBOV-本 迪 布 焦 型(Ebola-Bundibugyo,EBOV-B),EBOV-莱 斯 顿 型(Ebola-Reston,EBOV-R)5种亚型。各亚型 EBOV都分离了一定数量的毒株[1],除EBOV-R亚型病毒呈隐形感染外,其余4种亚型病毒都对人有致死性,其中EBOV-Z病毒是最早发现的,对人的致死率在90%以上。目前已有猪感染EBOV-R亚型病毒的病例,是否存在EBOV-R在猪体内变异感染人的潜在危险,值得关注。EBOV主要通过体液传染,甚至身体接触也可以导致传染。EBOV通过干扰感染者机体凝血平衡,导致血管壁破坏或功能受损,血小板不能凝血,在2-21d内出现出血性休克或器官衰竭[1],死亡率很高。本文就EBOV研究的各方面最新进展作以下综述。
1 EBOV及基因和编码蛋白
1.1 病毒粒子结构 EBOV一般呈管状或不规则线状,病毒粒子直径约80 nm,长度400-1 400 nm。病毒核衣壳由螺旋状缠绕的病毒基因组RNA和病毒NP、VP35、VP30和L蛋白组成,直径约50 nm[2],内有直径为20 nm的中央轴管道,管道呈螺旋形,螺旋间距为5 nm。核衣壳外包被糖蛋白脂双层,囊膜上有病毒GP蛋白形成的间隔10 nm整齐排列的刺突[2]。病毒感染细胞后,在包浆中装配,形成包含体。病毒装配完成后,通过宿主细胞膜以芽生的形式释放[2]。感染能力较强的病毒一般长665-805 nm。
1.2 病毒基因组和蛋白结构 EBOV基因组是线性的、单股负链非节段的RNA,全长为18959-18961个核苷酸,基因组3’端无Poly(A),5’端无CAP结构。转 录 起 始 位 点 为 3’端 3’-CUNCNUNUAAUU-5’,转录终止位点为5’端3’-UAAUUCUUUUUU-5’。整个基因组共编码7个结构蛋白和1个 非 结 构 蛋 白 (3’-NP-VP35-VP40-GP/sGPVP30-VP24-L-5’)。因负链 RNA 无法合成 RNA依赖性RNA聚合酶,所以基因组本身无感染性。
EBOV的每个蛋白都由独立的开放阅读框编码,NP为核衣壳蛋白,VP24、VP40为基质蛋白,VP30、VP35为结构蛋白,L为RNA依赖性RNA聚合酶。NP基因大约定位在基因组的3’末端,被一个前导序列所引导,该基因编码区长2217个碱基,编码737个氨基酸的蛋白质。VP35可以抑制Ⅰ型干扰素,在RNA的合成中起重要作用,功能类似非节段负链RNA病毒的P蛋白。VP40是一种基质蛋白,有助于病毒样颗粒(virus-like particles,VLPs)在细胞中表达,并在宿主细胞出芽过程中起重要作用。GP为Ⅰ型跨膜蛋白,VP30为锌结合蛋白,可与DNA双螺旋结构相结合,参与病毒的转录、装配和复制过程。VP24为小型膜蛋白,与病毒的成熟密切相关。
2 EBOV流行病学特征
2.1 自然宿主 1976-1998年,通过对发生EHF地区30 000份哺乳动物、鸟类、爬行动物、两栖动物和节肢动物的检测,研究人员发现除了在中非共和国收集到的6只老鼠和1只鼩样品检测到EBOV,其余样品均为阴性[3]。2001-2003年加蓬EBOV暴发期间,在大猩猩、黑猩猩和小羚羊的尸体内检测到EBOV。然而,这些物种感染后的高死亡率,使得它们不太可能成为EBOV的自然宿主[3]。
有些人认为植物、节肢动物和鸟类可能是EB-OV的宿主,但是研究人员认为蝙蝠是自然宿主的可能性最大。1976~1979年EBOV爆发时,在EHF感染者的环境周围发现了蝙蝠,而且在1975-1980年间马尔堡病毒感染病例中也可能由蝙蝠传播[3]。之后研究人员对24种植物和19种动物进行感染EBOV试验,只有蝙蝠被感染。蝙蝠感染EBOV后无临床症状。2002-2003年之间检测加蓬和刚果共和国的679只蝙蝠,结果发现13个果蝠体内含有埃博拉病毒RNA[4]。2005年,再次发现携带EBOV无任何临床症状的3只蝙蝠。这些证据表明蝙蝠是EBOV自然宿主之一[5]。
2.2 传播途径 EBOV已经被证实是通过体液传播的,如口腔和结膜接触传播,这在非人类灵长类动物试验中已被确认。在自然界携带EBOV的蝙蝠唾液污染过的水果和树叶,极有可能将病毒传染给大猩猩和小羚羊等食草类哺乳动物。自然界的动物各种行为和其它因素都有可能造成EHF的暴发[6]。EBOV在其自然宿主和人类之间的传播是较罕见的,通常这种情况与EBOV在自然界的易感动物有关。曾经发生人在处理大猩猩、黑猩猩或者小羚羊等尸体时造成感染,直接导致了EBOV在人之间传播。EBOV所属科的病毒也可以通过气溶胶进行传播,具有很高的传染性。由于这些潜在的传染途径的存在,EBOV已经被列为一级生化武器[7]。
3 流行现状
据WHO发布的数据,自1976年首次发现感染埃博拉病毒病例以来,全球累计报告大约2313例,其中1 539例死亡[8]。目前,EBOV的频繁爆发已导致了5 000只大猩猩的死亡。在2007年11月30日,乌干达卫生部在本迪布焦地区确认埃博拉病毒的爆发,经美国国家参考实验室与疾病防控中心(CDC)和WHO确认是一个新的EBOV亚型,命名为EBOV本迪布焦埃。2008年2月20日此次EBOV流行结束,共感染149人,死亡37人。2009年3月12日,德国一位科学家意外被实验室污染EBOV的注射器刺伤手指,发生疑似EBOV的感染。
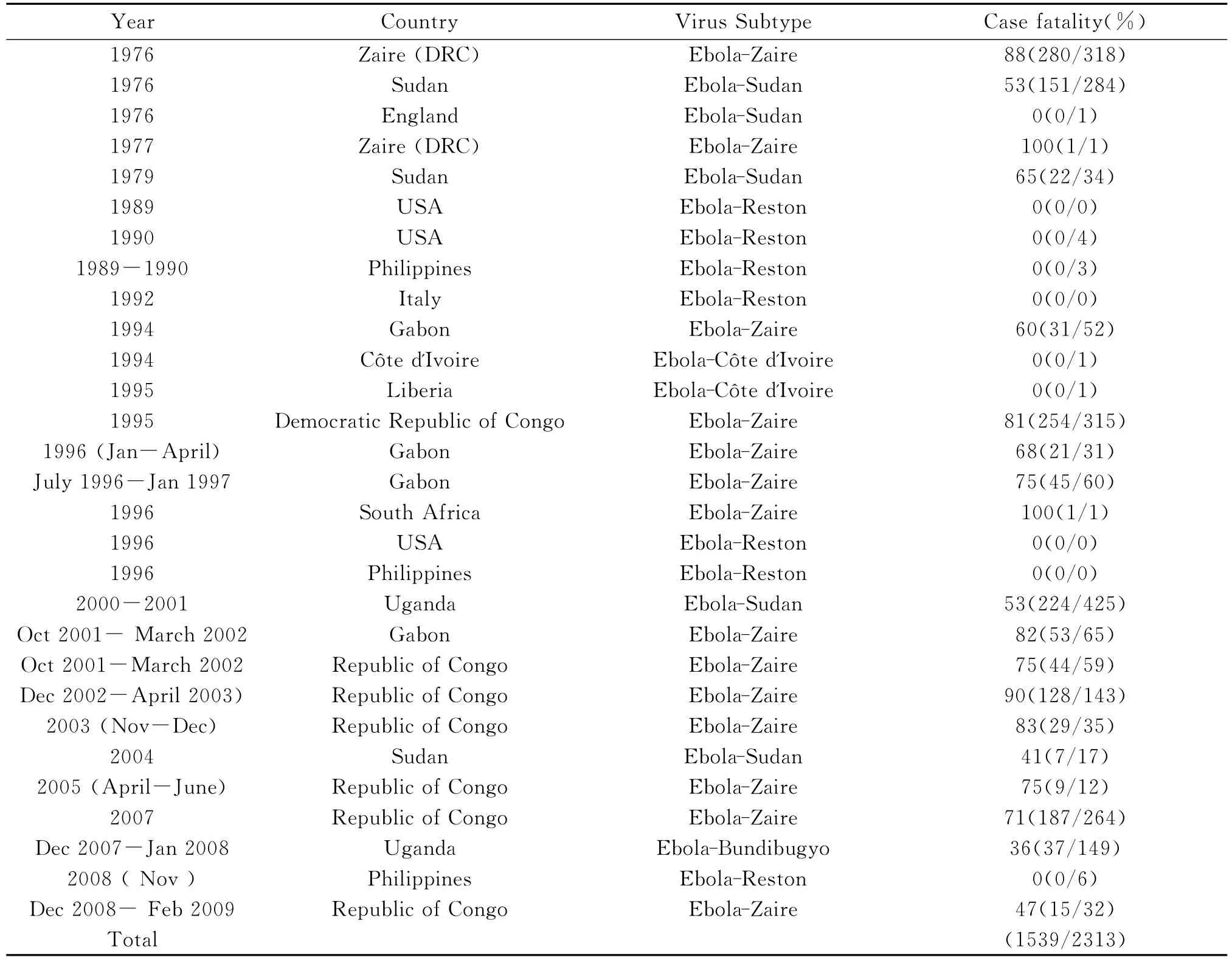
表1 埃博拉病毒暴发年代表Table1 Outbreaks of Ebola Virus
4 EBOV检测方法
鉴于EBOV对公共安全的危害性,对EHF进行了误诊可能对社会造成极大的恐慌,因此建立敏感、特异和准确的检测方法显得非常重要。病毒分离,反转录PCR(RT-PCR),抗原捕获ELISA,免疫荧光、针对病毒的IgG-ELISA和Ig M-ELISA方法都已用于EBOV的检测。Vero细胞和Vero E6细胞常用于EBOV的分离,由于EBOV分离必须在BSL-4实验室内操作,病毒分离方法不适用EBOV的快速诊断。EBOV的PCR检测方法敏感性、特异性都很高。如参考苏丹EBOV Gulu亚型的NP序列的套式 RT-PCR 方法[8],Drosten等[9]报道的实时荧光定量RT-PCR方法增加了检测的敏感性。当人感染了高致死性的EBOV后尚没有产生病毒抗体就已死亡,应用抗原捕获ELISA能在病毒感染早期及时快速完成检测。在1995的刚果民主共和国、1996年的加蓬和2000年的乌干达EBOV暴发期间,抗原捕获ZLISA方法在EHF诊断中被认为是有效的[8]。IgG-捕获ELISA和Ig M-捕获ELISA是一种EBOV流行病学调查的常用方法[8]。
5 EHF治疗和疫苗研制
5.1 EHF治疗手段 目前对于EHF还没有特效的治疗药物,已经感染了EBOV的患者只能采取对症治疗。采用恢复期患者的血清和免疫球蛋白可作为应急的治疗手段。EBOV感染后抗病毒药物是无效的,干扰素治疗也是无效的。实验室研究发现一种凝血抑制剂(r NAPc2)治疗可保护33%的病毒感染猕猴,然而r NAPc2对人没有治疗效果。2006年美国MRIID科学家报道吗啉反义药物治疗使75%的感染EBOV猕猴存活,改良的结合细胞穿透肽吗啉反义药物正在研制中[10]。2010年美国新发传染性疾病国家实验室科学家宣布,已经研究出一种携带小干扰RNAs的核酸脂质微粒(SNALPs),它能阻止病毒在实验猴体内复制[11],此外,研究人员正致力于通过对EBOV致病机制的深入研究以找到新治疗方法。
5.2 EBOV疫苗研制 传统的EBOV弱毒疫苗往往不能有效刺激机体产生免疫保护,弱毒疫苗还具有潜在的散毒风险。通过基因工程技术删除病毒毒力基因制备的弱毒疫苗可有效保护致死剂量病毒感染的小鼠和猪[12]。DNA疫苗利于抗体和细胞毒性T淋巴细胞产生,表达EBOV GP、NP、VP40和VP35的DNA疫苗对老鼠、豚鼠提供较好的保护,但是对非人类灵长类动物保护率较低。另一有前景的EBOV疫苗是病毒样颗粒疫苗,作为疫苗的病毒样颗粒缺少 NP、VP35、VP30、VP24和L蛋白,也没有病毒基因组,因此病毒样颗粒疫苗有效解决了弱毒疫苗毒力强的危险。病毒样颗粒疫苗另一优势是能避开机体的免疫清除反应,同时也有很好的应用效果。
[1]Bray M,Geisbert T.Ebola virus:the role of macrophages and dendritic cells in the pathogenesis of Ebola hemorrhagic fever[J].The international journal of biochemistry &cell biology,2005,37(8):1560-1566.
[2]Paolo Ascenzia,Alessio Bocedia,Julia Heptonstalla,et al.Ebolavirus and Marburgvirus:insight the Filoviridae family[J].Molecular Aspects of Medicine,2008,29(3):151-185.
[3]Pourrut X,Kumulungui B,Wittmann T.The natural history of Ebola virus in Africa[J].Microbes and infection/Institut Pasteur,2005,7(7-8):1005-1014.
[4]Leroy M,Kumulungui B,Pourrut X.Fruit bats as reservoirs of Ebola virus[J].Nature,2005,438(7068):575-576.
[5]Pourrut X,D licat A,Rollin E.Spatial and temporal patterns of Zaire ebolavirus antibody prevalence in the possible reservoir bat species[J].The Journal of infectious diseases,2007,196(2):S176-S183.
[6]Gonzalez JP,Pourrut X,Leroy E.Ebolavirus and other filoviruses[J].Current topics in microbiology and immunology,2007,315:363-387.
[7]Leffel EK,Reed DK.Marburg and Ebola viruses as aerosol threats[J].Biosecurity and bioterrorism:biodefense strategy,practice,and science,2004,2(3):186-191.
[8]Towner JS,Rollin DG,Bausch DG,et al.Rapid diagnosis of Ebola hemorrhagic fever by reverse transcription-PCR in an outbreak setting and assessment of patient viral load as a predictor of outcome[J].J Virol,2004,78(8):4330-4341.
[9]Drosten C,Gottig S,Schilling S,et al.Rapid detection and quanti cation of RNA of Ebola and Marburg viruses,Lassa virus,Crimean-Congo hemorrhagic fever virus,Rift Valley fever virus,dengue virus,and yellow fever virus by real-time reverse transcription-PCR[J]. Clinical Microbiol,2002,40 (7):2323-2330.
[10]Swenson L,Warfield L,Warren K.Chemical modifications of antisense morpholino oligomers enhance their efficacy against Ebola virus infection[J].Antimicrobial agents and chemotherapy,2009.53(5):208-2099.
[11]Geisbert TW,Amy CH,Robbins Marjorie.Postexposure protection of non-human primates against a lethal Ebola virus challenge with RNA interference:a proof-of-concept study [J].The Lancet,2010,375(9729):1896-1905.
[12]Halfmann P,Ebihara H,Marzi A,et al.Replication-deficient ebolavirus as a vaccine candidate[J].Virology,2009,83(8):3810-3815.
