抗粉尘螨主要变应原Der fⅡ单克隆抗体的制备与鉴定
2011-08-21刘晓宇吉坤美刘志刚
刘晓宇,吉坤美,李 荔,邹 菊,刘志刚
变态反应疾病已成为危害人们健康的主要问题之一,被WHO认定为当今世界重要的公共卫生学问题。它是由人体吸入、食用或接触过敏原引起的。粉尘螨(Dermatophagoidesfarinae,Df)是一种强烈的过敏原[1-2]。粉尘螨变应原成分约有21种,其中1类变应原(Der fⅡ)和2类变应原(Der fⅡ)为主要变应原,在粉尘螨过敏患者血清中,70%~80%患者的Ig E结合这两类变应原,并呈现强阳性[3]。粉尘螨II类变应原(Der fⅡ)的前体由146个氨基酸组成,经过去除信号肽加工处理后为129个氨基酸,分子量为14 k D,无糖基化位点[4],其主要的T细胞识别表位位于28~42和101~129[5]。我国研究者已经对粉尘螨Der fⅡ进行了基因克隆表达及免疫学活性的鉴定[6]。
目前,主要依靠标准化的尘螨过敏原进行尘螨过敏的诊断和脱敏治疗[7]。作为粉尘螨主要变应原之一,Der fⅡ的含量和活性已成为衡量粉尘螨脱敏疫苗中有效性的重要指标之一。特异性单克隆抗体是检测Def II含量和活性的重要工具。因此,Der fⅡ单抗的制备对于确定标准化的粉尘螨脱敏疫苗中主要变应原Der fⅡ的含量及活性指标至关重要。本研究制备了鼠源抗粉尘螨主要变应原Der fⅡ单克隆抗体,为Der fⅡ含量和活性检测体系的建立奠定了基础。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料 6~8 w龄雌性健康BALB/c小鼠,购自中山大学中山医学院实验动物中心;小鼠骨髓瘤细胞NS-1由汕头大学医学院炎症学与变态反应学研究所赠与;重组Der fⅡ蛋白、粉尘螨提取物和粉尘螨提取物由本实验室分离纯化。
1.1.2 实验试剂与仪器 福氏完全佐剂和不完全佐剂、过氧化物酶标记的羊抗小鼠免疫球蛋白、Ig类与亚类鉴定试剂盒、羊抗小鼠IgG/HRP均购于Sigma公司;DMEM、HAT购于Gibco公司;PEG 4000购于Merck公司;胎牛血清购于Gibco公司;HiTrap protein A、硝酸纤维素膜购于美国Amersham公司;蛋白Marker购于美国Fermentas公司;ECL Western Blotting Substation购于Perice公司;蛋白质电泳转移仪购于Bio-Rad公司。其他试剂为国产分析纯。
1.2 方法
1.2.1 杂交瘤细胞的制备 取0.6 mL 0.1g/L的重组 Der fⅡ蛋白与等体积的福氏完全佐剂混合并充分乳化,背部皮下多点分别注射于5只BALB/c小鼠。每间隔3 w,加强免疫1次,第2次加强免疫时改用福氏不完全佐剂,其余条件不变。融合前3 d,经尾静脉注射同等剂量的抗原PBS溶液进行加强免疫。细胞融合、杂交瘤细胞的筛选及克隆化,均按文献进行[6],分别收集免疫小鼠脾细胞和NS-1细胞,不完全培养基洗涤3次后,调整细胞浓度至脾细胞:NS-1细胞约为1∶10。加入50%PEG 4 000作用1~2 min后,加入完全培养基稀释,接种于96孔培养板,置于37℃,5%CO2培养。约10 d后,用间接ELISA法筛选阳性生长的细胞克隆孔,有限稀释法进行克隆化。
1.2.2 单克隆抗体的制备 提前7d注射0.5 m L液体石蜡至BALB/c小鼠腹腔。根据参考文献[6],将杂交瘤细胞以2×105个细胞/m L的浓度接种于含有完全培养液的80 m L培养瓶内,于37℃,5%CO2培养。至细胞活性状态最佳,1 000 r/min室温离心5 min,去上清,不完全培养液洗涤两次,将细胞质数量调至约5×106。将细胞注射入小鼠腹腔。7 d后,小鼠腹部增大,开始收集腹水,于2 000 r/min室温离心5 min,取上清于-20℃保存。
1.2.3 单克隆抗体的纯化 参照 HiTrap protein G亲和层析说明书进行腹水的抗体纯化。
1.2.4 Ig类与亚类的鉴定 采用Ig类与亚类鉴定试剂盒(间接ELISA法),鉴定抗体免疫球蛋白亚型,操作步骤严格按说明书进行。
1.2.5 抗Der fⅡ单克隆抗体的效价测定与纯化 用重组Der fⅡ蛋白包被ELISA固相载体,将杂交瘤细胞诱生的的腹水按1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200、1∶102 400、1∶204 800稀释作为一抗,以羊抗鼠-HRP为二抗,显色后通过测定其A450nm吸光值,免疫前小鼠血清做平行阴性对照试验。与重组Der fⅡ靶抗原发生结合反应的单克隆抗体的最大稀释度即为其效价,P/N≥2.1为阳性。
1.2.6 抗Der fⅡ单克隆抗体的鉴定 重组Der fⅡ蛋白经12%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后用电转仪转至硝酸纤维素膜 (电转条件:300m A,50min),用丽春红染液对膜进行染色后剪膜,超纯水、TBST(10 mmol/LTris,150 mmol/LNaCl,0.2%Tween-20,p H 8.0)洗去丽春红。将固定有Der fⅡ 重组蛋白的膜置于2%T-BSTBSA中,4℃封闭过夜。次日,经TBST摇洗3次后,分别加入抗Der fⅡ单克隆抗体,HRP标记的羊抗鼠IgG为二抗,室温孵育1h,TBST洗膜3次,DAB显色。
1.2.7 双抗体夹心ELISA法检测尘螨抗原 利用相加实验预测单抗株的结合表位,结果表明单抗3G7和3B12可能是相异表位。以单克隆抗体3G7作为双抗夹心ELISA的包被抗体,生物素标记的单抗3B12作为捕获抗体,采用棋盘法试验确定抗体的适宜的稀释倍数。用标准的尘螨Der fⅡ抗原系列稀释后测定该方法的检出限及标准曲线。
2 结 果
2.1 杂交瘤细胞的制备 细胞融合率为96.8%(465/480),抗体阳性检出率为87.7% (421/480),选择其中较高读数的10株进行克隆和亚克隆,最终获得5株分泌抗Der fⅡ单克隆抗体的杂交瘤细胞株,分别命名为3B12,3G7,3F3,4B2,4H8。
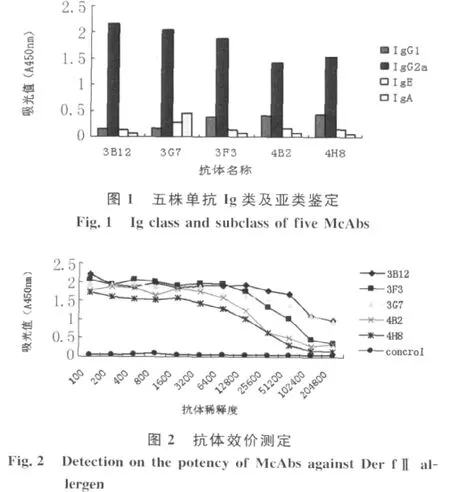
2.2 Ig类与亚类的鉴定 采用Ig类与亚类鉴定试剂盒(间接ELISA)结果表明5株抗体均为IgG2a类免疫球蛋白,非其他亚型,见图1。抗体亚型单一可能是纯化步骤中使用Protein G亲和层析法所致。
2.3 抗Der fⅡ单克隆抗体的效价测定 将小鼠腹水按一系列梯度稀释,用间接ELISA法测定其效价,见图2。其中3B12和3G7的效价远大于1∶204 800,其余抗体效价为1∶204 800。
2.4 抗Der fⅡ单克隆抗体的鉴定 将重组的Der fⅡ蛋白转印到硝酸纤维素膜上,然后用5株抗Der fⅡ单克隆抗体进行免疫印记实验,以免疫前鼠血清为阴性对照。Western Blotting结果如图3所示。在重组Der fⅡ(14k D)处均呈现明显的阳性反应条带,表明此5株单抗具有良好的Der fⅡ结合活性。
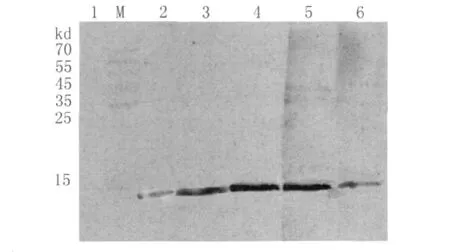
图3 抗Der fⅡ单克隆抗体的免疫印迹鉴定M:蛋白标志物;1:免疫前的血清;2:3F3;3:3G7;4:3B12;5:4B2;6:4H8Fig.3 Western-blotting analysis of Mc Abs against Der fⅡallergenM:Protein marker;1:Sera before immunization;2:3F3;3:3G7;4:3B12;5:4B2;6:4 H8
2.5 双抗体夹心ELISA法检测粉尘螨疫苗中变应原Der fⅡ含量 通过棋盘法确定单抗3G7以每孔0.9μg包被,生物素标记的3B12 1∶1 000稀释可以较好的检测到尘螨变应原Der fⅡ。粉尘螨标准Der fⅡ变应原按比例逐一稀释,阴性对照孔用PBS代替,以测定孔与阴性孔OD值之比大于2.1为阳性判断标准,测定该方法的检出范围,结果如图4所示。本方法测出的粉尘螨Der fⅡ的检出限为1.9μg/L,标准曲线在0.0625-1mg/L的范围内线性良好。
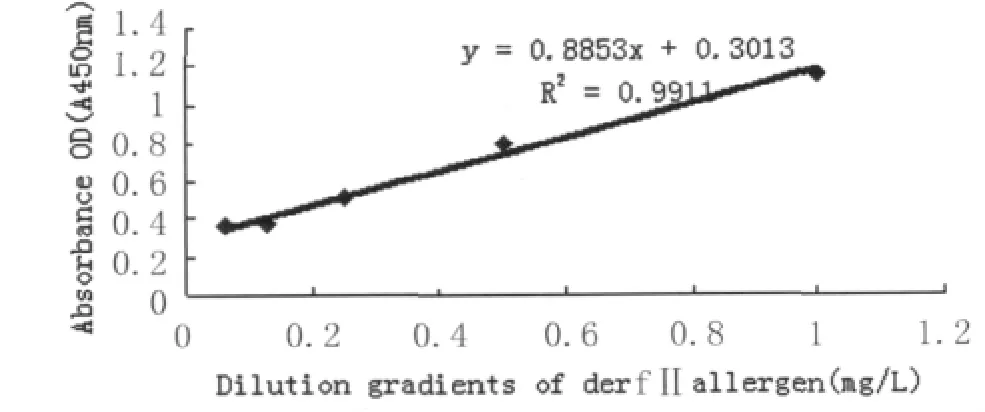
图4 双单抗夹心ELISA测定Der fⅡ含量的标准曲线Fig.4 Standard curve of sandwich ELISA for determination of the concentration of native Der fⅡ
3 讨 论
抗体是生物及医学领域中用途最为广泛的蛋白质分子。抗体的研究引起各领域学者的注意是从1890年德国学者Behring和日本学者北里发现白喉毒素后开始的。1975年Khlex和Milstein在《Nature》杂志上首次报道了用小鼠骨髓瘤细胞和经免疫的小鼠脾细胞融合产生的杂交瘤细胞既可以稳定的分泌抗体又具有无限增殖的特性。这一发现实现了人类在体外生产抗体,并广泛将其应用于生命科学研究,极大推动了免疫检测技术的发展[8]。近年来,随着分子生物学的发展以及人们对变态反应性疾病发病机制的深入研究,单克隆抗体已广泛应用于过敏性疾病的诊疗,在变应原的含量和活性检测等方面发挥了重要的作用。本研究运用杂交瘤技术成功制备出5株稳定分泌抗Der fⅡ单克隆抗体的细胞株。通过间接ELISA鉴定,5株单抗效价均在204 800以上,其亚类均为IgG2a,专一与粉尘螨提取物结合反应。表明它们可用于检测Der fⅡ主要变应原各种免疫学方法的建立。
抗Der fⅡ单克隆抗体在粉尘螨引发的过敏性疾病的预防和治疗方面具有重要用途。第一,利用高效价抗Der fⅡ抗体可开发出商品化的检测试剂,如ELISA或试纸条等用于周围环境中尘螨主要变应原Der fⅡ含量的检测[9],可提示过敏体质者避免接触尘螨变应原。第二,用于检测免疫脱敏疫苗中尘螨主要变应原Der fⅡ含量及活性[10-11]。我国临床上脱敏疫苗常常是种院内制剂,组分非常复杂,难以标准化,影响其使用时的特异性和安全性,如使用时可出现假阳性、过敏反应等副作用。标准化的脱敏疫苗则要求明确疫苗的有效组分及其含量,方可保证用药的重复性与安全性[11]。本研究制备的单抗可组装成ELISA试剂盒,使用该试剂盒可检测粉尘螨疫苗中主要变应原Der fⅡ的含量及活性。
抗Der fⅡ单克隆抗体的研制,可为粉尘螨变应原疫苗的提取、纯化及鉴定提供了有效的实验基础,并通过对粉尘螨主要变应原Der fⅡ检测方法的建立为粉尘螨标准化变应原疫苗研制与生产奠定了技术支持。
[1]蔡成郁,白羽,刘志刚,等.粉尘螨3类变应原基因的克隆、表达、纯化与变应原性鉴定[J].中国寄生虫学与寄生虫病杂志,2007,25(1):22-26.
[2]Platts-Mills TA,Thomas WR,Aalberse RC,et al.Dust mite allergens and asthma:Report of a second international workshop[J].Allergy Clin Immunol.1992,89:1046-1060.
[3]白羽,吉坤美,刘志刚,等.粉尘螨I类变应原基因的多态性分析及表达蛋白的特性鉴定[J].中国人兽共患病学报,2007,23(2):156-160.
[4]白羽,吉坤美,刘志刚,等.深圳地区粉尘螨II类变应原基因的多态性分析及其表达蛋白的变应原性鉴定[J].昆虫学报,2007,50(6):560-566.
[5]Verhoef A ,Lamb JR.Threshold signaling of human Th0 cells in activation and anergy:modulation of effector function by altered TCR ligand[J].J Immunol,2000,164(11):6034-6040.
[6]朱健琦,刘志刚,高波.粉尘螨Ⅱ类变应原的克隆表达、纯化及其免疫学特性[J].免疫学杂志,2006,22(2):213-217.
[7]International Workshop Report.Dust mite allergens and asthmaa worldwide problem[J].J Allergy Clin Immunol,1989,83:416-427.
[8]董志伟,王琰.抗体工程[M].北京:北京医科大学出版社,2002:52.
[9]Tsay A,Williams L,Mitchell EB,et al.Multi-Centre Study Group.A rapid test for detection of mite allergens in homes[J].Clin Exp Allergy,2002,32(11):1596-1601.
[10]Jeong KY,Jin HS,Oh SH,et al.Monoclonal antibodies to recombinant Der f 2 and development of a two-site ELISA sensitive to major Der f 2 isoallergen in Korea[J].Allergy,2002,57(1):29-34.
[11]Luczynska CM,Arruda LK,Platts-Mills TA,et al.A two-site monoclonal antibody ELISA for the quantification of the major Dermatophagoides spp.allergens,Der p I and Der f I[J].J Immunol Methods,1989,118(2):227-235.
