新疆马铃薯黑痣病病原菌的分离及鉴定
2024-12-31沈洪飞贾丰莲刘易吴燕杨茹薇孙慧李广悦
摘 要:【目的】分离鉴定引起新疆马铃薯黑痣病病原菌,为筛选防治该病药剂奠定基础。
【方法】从新疆吉木萨尔县、奇台县、乌鲁木齐市达坂城区和昭苏县等马铃薯种植区采集马铃薯块茎,通过组织分离法从带有马铃薯黑痣病的块茎分离病原菌,利用电子显微镜观察病原菌的形态特征,进行对峙培养和ITS序列分析,鉴定融合群。
【结果】从新疆吉木萨尔县、奇台县、乌鲁木齐市达坂城区和昭苏县分离的4株病原菌均能使马铃薯块茎出现马铃薯黑痣病症状,分离菌株均为AG3融合群。
【结论】AG3融合群是新疆马铃薯黑痣病的主要致病群。
关键词:马铃薯黑痣病;分离鉴定;融合群
中图分类号:S436.32"" 文献标志码:A"" 文章编号:1001-4330(2024)07-1766-06
0 引 言
【研究意义】马铃薯是继水稻、小麦和玉米之后的第4大主粮作物,马铃薯营养丰富且适应强[1]。马铃薯耐荫喜冷凉、产量高,在新疆温热平原区二季栽培或林果套作种植,可增加土地复种指数。马铃薯的生产和营养品质均受到生物和非生物胁迫的威胁[2]。新疆北疆马铃薯黑痣病发病率20%~50%,对其产量和品质影响较大。分离与鉴定新疆马铃薯黑痣病病原菌对防治该病有实际意义。【前人研究进展】新疆北部沿天山一带马铃薯种植区病害类型主要包括假单胞菌(Pseudomonas lactis)引起的青枯病、致病性尖孢镰刀菌(Fusarium oxysporum)引起的枯萎病、茄病镰刀菌(Fusarium solani)引起的干腐病、链格孢菌(Alternaria sp)引起的早疫病、细级链格孢菌(Alternaria tenuissima)黑斑病及赤星病菌(Alternaria alternata)引起的赤星病和立枯丝核菌(Rhizoctonia solani)引起的黑痣病等[3]。马铃薯黑痣病是由立枯丝核菌(Rhizoctonia solani)引起的一种土壤传播和种薯带菌传播的真菌病害,通常以菌丝和菌核的形态习居于土壤,可侵染包括马铃薯在内的多种作物,影响马铃薯的产量和品质[4]。立枯丝核菌被分为AG1-AG13和AG-BI等14个融合群,各融合群在形态、生理、生态、致病性和寄主等方面均存在一定的差别[5, 6]。关于引起马铃薯黑痣病病原菌(R.solani)的分离鉴定方法包括菌丝融合法、同工酶法和基于核糖体RNA基因内转录间隔区(rDNA-ITS)法。菌丝融合法可以划分不同融合群,但不能准确反映融合群种内及种间遗传与变异之间的关系。rDNA-ITS标记法能在分子水平上揭示立枯丝核菌的遗传变化及多样性[4]。通过rDNA-ITS标记法对立枯丝核菌ITS靶标区域进行检测,是马铃薯黑痣病病原菌检测和遗传多样性分析的主要手段[7]。【本研究切入点】目前,关于新疆马铃薯黑痣病病原菌融合群种类及生物学特性等研究的报道较少。需分离鉴定引起新疆马铃薯黑痣病的病原菌。
【拟解决的关键问题】
利用组织分离法、rDNA-ITS标记法及融合群鉴定等手段,鉴定新疆马铃薯黑痣病病原种类,分析新疆马铃薯黑痣病的病原菌类型,为防治新疆马铃薯黑痣病提供科学依据。
1 材料与方法
1.1 材 料
1.1.1 供试马铃薯样品及菌株
2020年马铃薯收获期从新疆吉木萨尔县( 88°95′E,43°84′N )、奇台县( 89°79′E, 43°82′N)、达坂城区(88°32′E,43°43′N)和昭苏县( 80°55′E,43°62′N)采集薯块表面长有菌核,感染马铃薯黑痣病的病薯样品,品种为希森6号、冀张薯12号。
中薯3号试管苗、中薯3号原种来自中国农业科学院蔬菜花卉研究所,用于马铃薯黑痣病病原菌的回接验证。
立枯丝核菌融合群标准菌株AG3-PT来自中国农业大学吴学宏老师课题组。
1.1.2 仪器和和试剂
试剂:24∶1氯仿-异戊醇混合液:96 mL氯仿中加入4 mL异戊醇。CTAB溶液:65℃预热CTAB溶液后,加入1 mL还原剂。
仪器:离心机(Eppendorf)、恒温培养箱(天津市泰斯特仪器有限公司)、
冷冻混合球研磨仪(RETSCH MM400)、PCR扩增仪(BIO-RAD)、
超净工作台(北京东联哈尔仪器制造有限公司)、凝胶成像仪(天能)、
高压蒸汽灭菌锅(上海博迅YXQ-100SII)、
电子显微镜(日本奥林巴斯Olympus)、pH计(梅特勒-托利多仪器(上海)有限公司)。
1.1.3 培养基及配制
马铃薯葡萄糖琼脂培养基(PDA):新鲜马铃薯(去皮)200 g切成小块,煮沸15 min,用纱布过滤,加入葡萄糖20 g,加蒸馏水定容至1 000 mL。根据15或7.5 g/L加入琼脂,配制成1.5% PDA培养基或0.75% PDA培养基,用于病原菌分离纯化和菌株活化培养。
水琼脂培养基(WA):称取15 g琼脂,加蒸馏水定容至1 000 mL,121℃灭菌15 min,用于病原菌的分离和融合群鉴定。
SM培养基:称取100 g麦粒用水浸泡8 h,并与蛭石、黑土、草炭(1∶2∶2)混匀后分装至锥形瓶,121℃灭菌30 min,用于制备毒土和致病性鉴定。
1.2 方 法
1.2.1 病原菌的分离及形态特征的测定
采用组织分离法进行黑痣病病原菌的分离。
(1)将马铃薯用清水洗净,放入75%酒精中进行组织表面消毒,再用无菌水冲洗3次。用消毒灭菌的镊子取马铃薯块茎表面菌核,放入WA平板上,于25℃恒温培养箱培养72 h。
(2)当WA平板培养的菌核周围长出白色菌丝,在无菌条件下挑取白色尖端菌丝至新的PDA平板纯化培养,纯化培养3次后保存备用。
(3)将纯化培养的病原菌用5 mm打孔器,沿菌落边缘切取5 mm的菌饼,接种到PDA平板上,在25℃恒温条件下培养,第3 d时挑取菌丝观察菌丝形态及观察培养基上的菌落形态。第3、7和14 d,观察菌核在培养基上的生长状态、菌核大小、颜色和外部形态。
1.2.2 病原菌致病性的测定
(1)土壤接种法:将分离的供试病原菌菌株转接到PDA平板上培养3 d后,用直径9 mm打孔器,沿菌落边缘切取菌饼,用灭菌牙签挑取6个菌饼至装有300 g的SM麦粒培养基中,25℃恒温箱中暗培养20~30 d,产生大量菌核后将麦粒培养基打碎备用。按1∶5的比例将带菌核SM麦粒培养基与栽培用土混合均匀,制成带有病原菌的土壤,并接种至栽培有中薯3号试管苗的育苗盆中(马铃薯处于苗期)。将接种带菌土壤的育苗马铃薯盆继续放置在温度25~28℃温室中培养,以不接菌做对照,于马铃薯成熟期取样观察块茎上的菌核形态,并记录发病情况。
(2)致病菌的再分离:利用组织分离方法从接种病土并发病的马铃薯块茎处再次分离致病菌。方法同1.2.1。鉴定PDA平板上生长的致病菌和接种菌株的培养形态特征是否一致,若一致,可确定分离的菌株为马铃薯黑痣病致病菌。
1.2.3 病原菌的鉴定
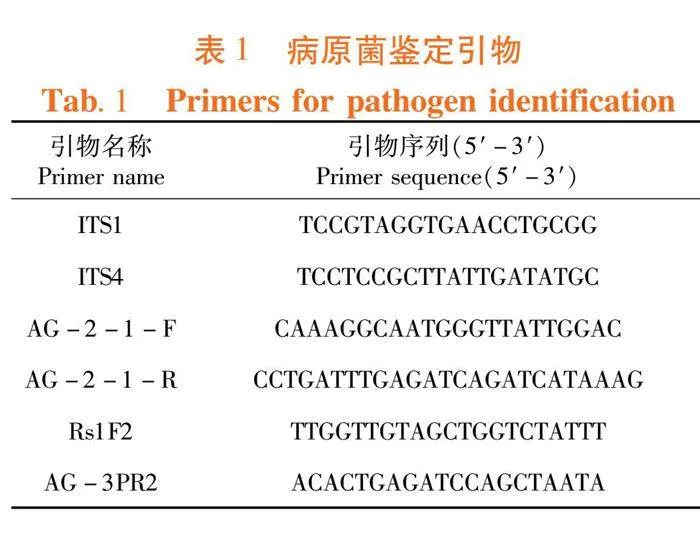
采用CTAB法提取病原菌基因组DNA。具体方法:收集菌丝到2 mL离心管中,液氮研磨,研磨后离心管中加入以混入还原剂的CTAB溶液700 μL,置于65℃水浴或金属浴30~60 min,其间每10min晃动离心管,水浴完成后冷却至室温。加入0.5 mL氯仿-异戊醇混合液,剧烈震荡混匀,10 000 r/min离心5 min,吸取上清液于新离心管中,加入等体积的异丙醇,颠倒混匀,置于-18℃沉淀30 min,12 000 r/min离心10 min,弃上清后用75%乙醇洗涤1次,12 000 r/min离心3min,沉淀自然干燥后溶于50 μL去离子水或TE中备用。以通用引物ITS1和ITS4(由生工公司合成)对rDNA进行PCR扩增参照文献[8]方法。
PCR反应体系:引物各1 μL,buffer 10 μL,dNTP 4 μL,酶1 μL,模板DNA 1 μL,以ddH2O补至50 μL。PCR扩增条件:95℃预变性5 min;95℃变性30 s,55℃退火60 s,72℃延伸60 s,循环30次;72℃补充延伸10 min。以1%琼脂糖凝胶电泳(120 V,30 min)检测PCR扩增产物。PCR产物由生工生物科技有限公司测序。用DNAMAN软件将供试菌株的核糖体DNA-ITS序列与GenBank中的相关序列ITS区进行比对。表1
1.2.4 融合群的鉴定
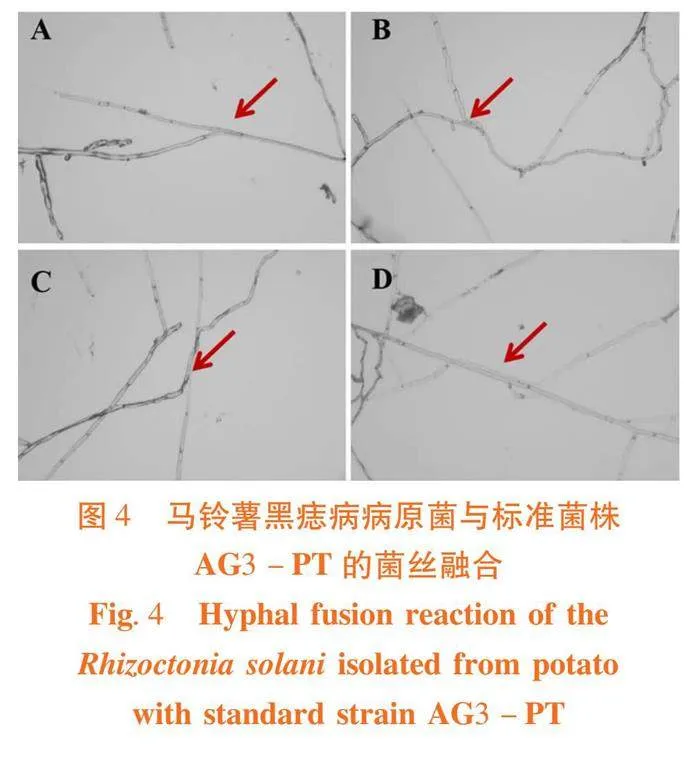
采用对峙培养法并参照文献[3, 9, 10]方法:将待测菌株在PDA平板活化培养3 d,用打孔器沿菌落边缘打孔生长速度一致的5 mm菌饼。将融合群标准菌株置于灭菌载玻片的中央,待测菌株菌饼置于距离中央2~3 cm的两端位置,接种后的培养皿在25℃恒温生化培养箱中暗培养7 d。当待测菌株菌丝与融合群标准菌株菌丝重叠时,将菌丝盘轻微移开,在20×放大倍数下观察,找到菌丝融合的位置,并在更高的放大倍数下确认(100×和400×)。所有配对重复3次,并分析至少10个融合位置。吻合反应分为C0:无相互作用;C1:菌丝接触,无融合,2个菌株不亲和,不属于同一个菌丝融合群;C2:细胞壁在吻合时融合,相邻细胞死亡;C3:细胞壁和细胞膜融合无细胞死亡。
2 结果与分析
2.1 新疆马铃薯黑痣病病薯样品中病原菌的分离
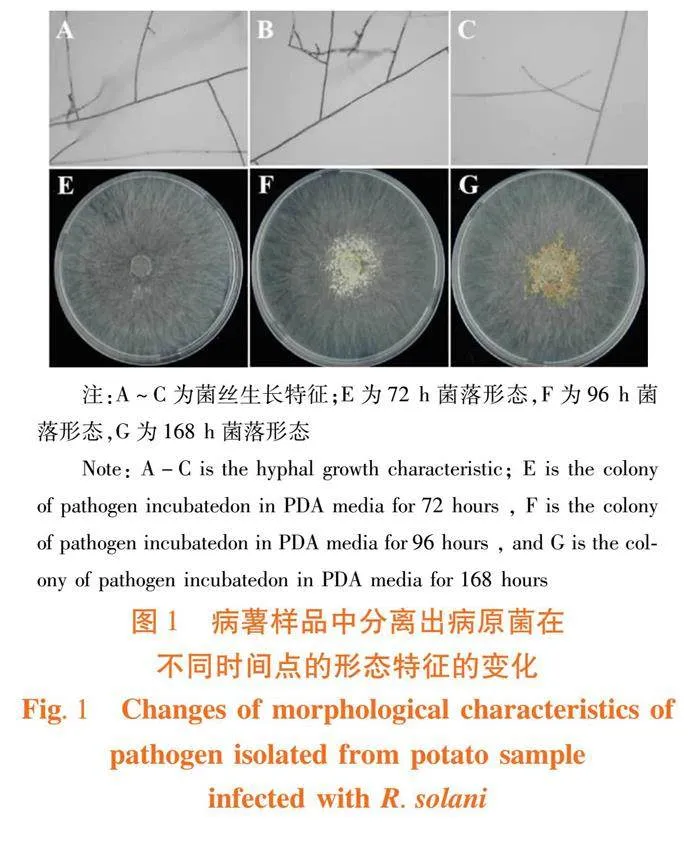
研究表明,4株分离菌株均具有立枯丝核菌特征,菌丝分枝处多呈直角或锐角,不产生分生孢子。在PDA培养基上培养72 h左右,菌落直径达到8.5 cm,菌丝体初期无色,棉絮状或丝状,气生菌丝较多,随后逐渐缩短变粗为浅褐色,老熟菌丝有明显分隔。病原菌生长96 h形成菌核,菌核椭圆形和米粒形,初期白色,老熟菌核呈褐色,内外颜色一致,表面粗糙,单个分散或多个聚集产生于培养基表面或培养皿壁上。将分离菌株采用液体石蜡保藏法保存备用。图1
2.2 病原菌致病性的鉴定
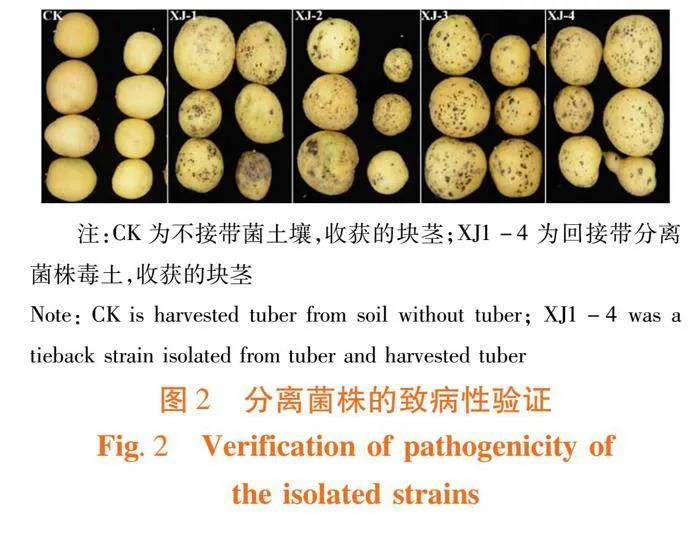
研究表明,将分离获得的4株病原菌分别转接至SM培养基培养30 d,制成带病原菌的毒土,并将制备的带菌毒土与盆栽基质(基质:毒土5∶1)混合均匀后回接到健康的中薯3号马铃薯植株,以回接无病原菌的SM培养基为对照,将马铃薯置于温室继续培养直至收获。接种病原菌的马铃薯块茎表面形成坚硬的黑褐色或暗褐色的黑色菌核,不易冲洗掉,菌核下边的组织完好,而不接种病原菌的马铃薯块茎表面无菌核,分离的4株病原菌均能引起马铃薯块茎表现出马铃薯黑痣病症状,并且回接后马铃薯块茎发病症状与从自然发病薯块表皮症状一致。
从感病马铃薯块茎的病健交界的病斑处再次分离纯化出病原菌,与初始接种菌株的形态一致,分离的4株菌株(编号XJ1-4)均是新疆马铃薯黑痣病的致病菌株。图2
2.3 病原菌种属及融合群的鉴定
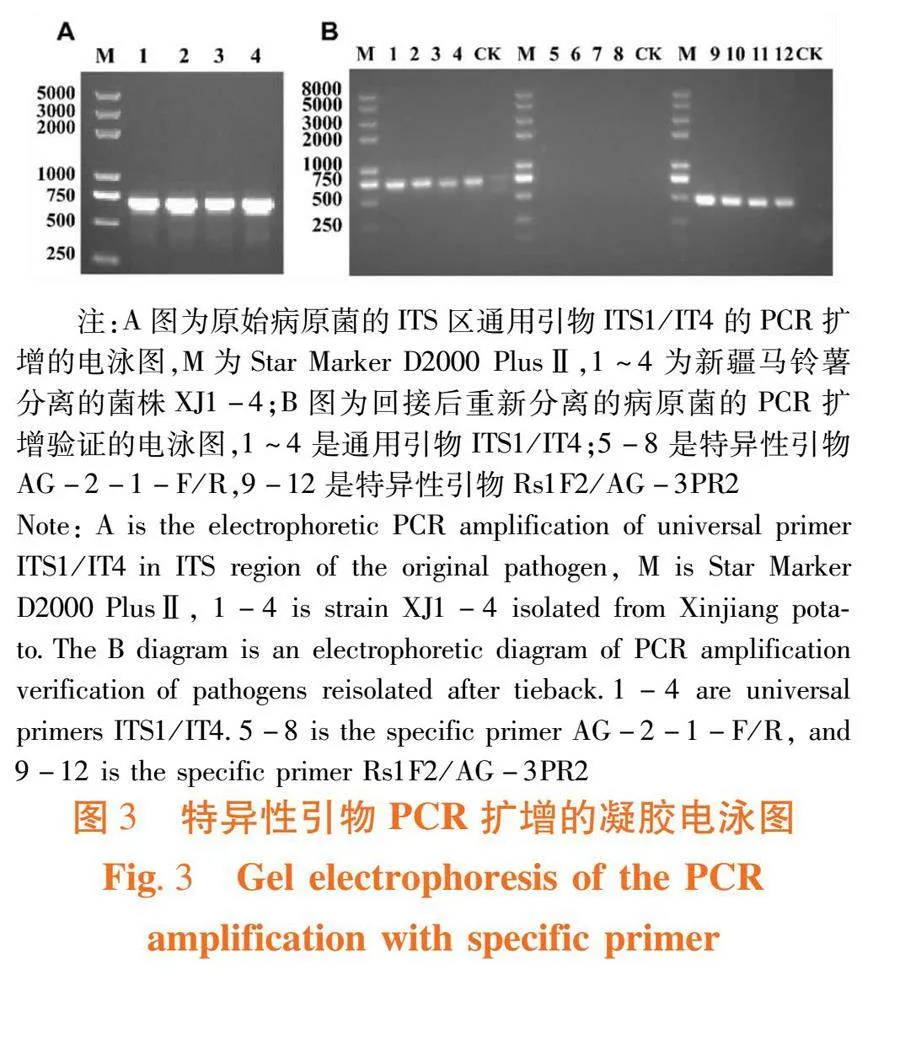
研究表明,分离的4株病原菌均能扩增出700 bp大小的条带。4个菌株ITS序列与GenBank上已知立枯丝核菌AG3的序列相似度达到99%以上。
4个分离菌株均能与AG3标准菌产生点融合或面融合,均属于AG3融合群。同时,利用特异性引物AG-2-1-F/R和Rs1F2/AG-3PR2进行辅助验证,不加模板及AG2融合群特异性引物AG-2-1-F/R均未扩增出条带,而AG3融合群特异性引物Rs1F2/AG-3PR2的PCR扩增均获得400~500 bp阳性目的片段。
引起新疆马铃薯黑痣病病原菌的主要融合群为AG3。图3,图4
3 讨 论
对峙培养法是测定融合群的有效方法。完全融合分为点融合或面融合,即两个菌丝之间产生连接点连接到一起或两个菌丝全部紧贴融合在一起[9]。马铃薯黑痣病是由立枯丝核菌(Rhizoctonia solani)引起的土传和种传真菌病害。黑痣病病原菌侵染幼芽导致幼芽坏死,侵害地下茎和匍匐茎形成溃疡斑,在薯块表皮形成菌核(黑色或褐色颗粒)[11],严重发病时马铃薯黑痣病可造成马铃薯的产量损失达50%以上。目前在种植中缺乏抗马铃薯黑痣病的品种,尚未发现免疫或高抗马铃薯黑痣病的品种[12]。
立枯丝核菌(Rhizoctonia solani)融合群类群的分布在不同地区间存在较大差异。研究分离到的新疆马铃薯黑痣病病原菌的菌丝生长速度快,分枝处多呈直角或锐角,不产生分生孢子,菌丝体初期白色为棉絮状或丝状,后逐渐缩短变粗为浅褐色,老熟菌丝有明显分隔,与报道的马铃薯黑痣病病原菌的形态特征一致[13]。通过对峙培养和特异性引物验证,确定了从新疆马铃薯块茎上分离的病原菌均为AG3融合群,与文献报道的马铃薯黑痣病病菌优势融合群为AG3相一致[8, 14]。Yang等[15]从新疆马铃薯块茎上分离了AG-3和AG-4-HG-1,植株上分离了AG2-1、AG-3和AG-4-HGⅠ、AG-4-HGⅡ和AG5 ,而研究中仅从块茎样本中分离到AG3融合群,是因为病样标本的来源或发生地不同,马铃薯黑痣病病原菌种类构成存在一定的差异性,且某些融合群主要侵染马铃薯的植株[14, 16]。
AG1‐IB、AG2‐1、AG‐3、AG4‐HG‐Ⅰ、AG4‐HG‐Ⅱ、AG4‐HG‐Ⅲ、AG‐5、AG‐7、AG‐9和AG11等10个融合群及其亚群均能引起马铃薯黑痣病[15,17],不同地区分布规律有差异且遗传变异性大,抗逆性强,给该病害的防治增加了难度。通过早期识别和提前防控对提高马铃薯产量具有重要的作用[20-21]。通过rDNA-ITS标记法及融合群鉴定明确不同马铃薯种植区马铃薯黑痣病病原菌融合群种类,并有针对性地开展病原菌的生物学特性研究,将有助于阐明优势致病融合群的生长条件与环境的关系,从而针对性地选择有效杀菌剂[5, 12]。
4 结 论
从新疆吉木萨尔县、奇台县、达坂城区和昭苏县等4个马铃薯种植区感染了马铃薯黑痣病的块茎上分离病原菌,分离菌株菌丝分枝处多呈直角或锐角,不产生分生孢子,菌丝体初期无色,棉絮状或丝状,生长96 h形成菌核,菌核椭圆形和米粒形,初期白色,老熟菌核呈褐色;AG3融合群为当地马铃薯主要的致病融合群。
参考文献(References)
[1]
Liu B B, Gu W Y, Yang Y, et al. Promoting potato as staple food can reduce the carbon-land-water impacts of crops in China[J]. Nature Food, 2021, 2(8): 570-577.
[2] Kíkovská B, Viktorová J, Lipov J. Approved genetically modified potatoes (Solanum tuberosum) for improved stress resistance and food safety[J]. Journal of Agricultural and Food Chemistry, 2022, 70(38): 11833-11843.
[3] 高勇刚, 高海峰, 吕卓, 等. 新疆北部沿天山主要种植区马铃薯病害分析[J]. 新疆农业科学, 2022, 59(1): 170-178.
GAO Yonggang, GAO Haifeng, LYU Zhuo, et al. Investigation into the diseases of the potato in different producing areas in Xinjiang[J]. Xinjiang Agricultural Sciences, 2022, 59(1): 170-178.
[4] 王利红, 姜华, 王艳丽, 等. 立枯丝核菌遗传多样性的研究方法[J]. 中国生物化学与分子生物学报, 2013, 29(3): 226-233.
WANG Lihong, JIANG Hua, WANG Yanli, et al. Methodology in researching of genetic variance ofRhizoctonia solani[J]. Chinese Journal of Biochemistry and Molecular Biology, 2013, 29(3): 226-233.
[5] 夏善勇, 牛志敏, 李庆全, 等. 马铃薯黑痣病立枯丝核菌及其综合防控研究进展[J]. 江苏农业科学, 2022, 50(12): 28-34.
XIA Shanyong, NIU Zhimin, LI Qingquan, et al. Research progress on Rhizoctonia solani causing potato black scurf and its comprehensive control [J]. Jiangsu Agricultural Sciences, 2022, 50(12): 28-34.
[6] Iradukunda L, Wang Y, Nkurikiyimfura O, et al. Establishment and Application of a Multiplex PCR Assay for the Rapid Detection of Rhizoctonia solani Anastomosis Group (AG)-3PT, the Pathogen Causing Potato Black Scurf and Stem Canker[J]."" 2022, 11(6): 627.
[7] 李磊, 陈利达, 黄艺烁, 等. 马铃薯黑痣病菌实时荧光定量PCR检测体系的建立及应用[J]. 农业生物技术学报, 2021, 29(7): 1417-1425.
LI Lei, CHEN Lida, HUANG Yishuo, et al. Establishment and application of real-time quantitative PCR detection system for black scurf pathogen in potato(Solanum tuberosum)[J]. Journal of Agricultural Biotechnology, 2021, 29(7): 1417-1425.
[8] 李晓妮, 徐娜娜, 于金凤. 中国北方马铃薯黑痣病立枯丝核菌的融合群鉴定[J]. 菌物学报, 2014, 33(3): 584-593.
LI Xiaoni, XU Nana, YU Jinfeng. Anastomosis groups ofRhizoctonia solanifrom black scurf of potato in Northern China[J]. Mycosystema, 2014, 33(3): 584-593.
[9] 刘霞, 冯蕊, 高达芳, 等. 云南省马铃薯黑痣病病原菌融合群鉴定及8种药剂对其的毒力[J]. 植物保护, 2016, 42(2): 165-170.
LIU Xia, FENG Rui, GAO Dafang, et al. Anastomosis groups ofRhizoctonia solani and toxicity of eight fungicides against R.solani from black scurf of potato[J]. Plant Protection, 2016, 42(2): 165-170.
[10] 杨帅, 郭梅, 王文重, 等. 黑龙江省马铃薯黑痣病菌融合群类型分析[J]. 中国马铃薯, 2022, 36(3): 228-235.
YANG Shuai, GUO Mei, WANG Wenzhong, et al. Identity of the anastomosis group of potato black scurf in Heilongjiang Province[J]. Chinese Potato Journal, 2022, 36(3): 228-235.
[11] 刘宝玉, 胡俊, 蒙美莲, 等. 马铃薯黑痣病病原菌分子鉴定及其生物学特性[J]. 植物保护学报, 2011, 38(4): 379-380.
LIU Baoyu, HU Jun, MENG Meilian, et al. Molecular identification and biological characters of the pathogen causing black scurf disease in potato[J]. Journal of Plant Protection, 2011, 38(4): 379-380.
[12] 杨帅, 闵凡祥, 高云飞, 等. 环境因子对马铃薯致病立枯丝核菌AG-3融合群生长的影响[J]. 安徽农业科学, 2016, 44(24): 151-154.
YANG Shuai, MIN Fanxiang, GAO Yunfei, et al. Influence of environmental factors on growth status of AG-3 for potato pathogenicRhizoctonia solani[J]. Journal of Anhui Agricultural Sciences, 2016, 44(24): 151-154.
[13] 戴启洲. 马铃薯黑痣病发病规律及综合防治[J]. 中国蔬菜, 2012,(15): 31-32.
DAI Qizhou. Incidence and comprehensive control of potato black scurf [J]. China Vegetables, 2012,(15): 31-32.
[14] 曹春梅,王晓娇,许飞,等. 内蒙古地区马铃薯黑痣病立枯丝核菌融合群及致病性研究[J]. 中国马铃薯. 2018, 32(5): 293-302.
CAO Chunmei, WANG Xiaojiao, XU Fei, et al. Anastomosis Groups of Rhizoctonia solani from Potato and Pathogenicities in Inner Mongolia[J]. Chinese Potato Journal," 2018, 32(5): 293-302.
[15] Yang Y G, Zhao C, Guo Z J, et al. Anastomosis group and pathogenicity ofRhizoctonia solani associated with stem canker and black scurf of potato in China[J]. European Journal of Plant Pathology, 2015, 143(1): 99-111.
[16] 田晓燕, 蒙美莲, 张笑宇, 等. 马铃薯黑痣病菌菌丝融合群的鉴定[J]. 中国马铃薯, 2011, 25(5): 298-301.
TIAN Xiaoyan, MENG Meilian, ZHANG Xiaoyu, et al. Identification of anastomosis groups ofRhizoctonia solanion potato plant[J]. Chinese Potato Journal, 2011, 25(5): 298-301.
[17] Djébali N, Elkahoui S, Taamalli W, et al. TunisianRhizoctonia solaniAG3 strains affect potato shoot macronutrients content, infect faba bean plants and showin vitroresistance to azoxystrobin[J]. Australasian Plant Pathology, 2014, 43(3): 347-358.
[18] López-Corrales R, Michereff S J, Garcia-Estrada R S, et al. First confirmed report ofRhizoctonia solani AG-7 causing potato stem canker inMexico[J]. Plant Disease, 2023.
[19] Moliszewska E, Nabrdalik M, Ziembik Z. Rhizoctonia solaniAG 11 isolated for the first time from sugar beet in Poland[J]. Saudi Journal of Biological Sciences, 2020, 27(7): 1863-1870.
[20] Chen W R, Chen J D, Zeb A, et al. Mobile convolution neural network for the recognition of potato leaf disease images[J]. Multimedia Tools and Applications," 2022, 81(15): 20797-20816.
[21] Iradukunda L, Wang Y P, Nkurikiyimfura O, et al. Establishment and application of a multiplex PCR assay for the rapid detection ofRhizoctonia solani anastomosis group (AG)-3PT, the pathogen causing potato black scurf and stem canker[J]. Pathogens, 2022, 11(6): 627.
Isolation and identification of the pathogen for
potato black scurf in Xinjiang
SHEN Hongfei1,2, JIA Fenglian1, LIU Yi2, WU Yan2, YANG Ruwei2, SUN Hui2, LI Guangyue1
(1.Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193, China; 2.Xinjiang Academy of Agricultural Sciences Comprehensive Test Farm, Urumqi 830000, China)
Abstract:【Objective】 To isolate and identify the pathogen causing potato black scurf in Xinjiang in the hope of providing a foundation for screening of control agents and establishment of control technology.
【Methods】" Potato tubers were collected from Jimsar, Qitai, Dabancheng and Zhaosu in Xinjiang, and Rhizoctonia solaniwere isolated from tubers with potato black scurf by tissue separation method. Anastomosis groups of Rhizoctonia solaniwere identified by paired culture and ITS sequence analysis.
【Results】" The four strains isolated from Jimsar, Qitai, Dabancheng and Zhaosu were all able to cause the symptoms of potato black scurf on potato tubers. The isolated strains were Anastomosis groups AG3.
【Conclusion】 Anastomosis Groups AG3 is the main pathogenic group of potato black scurf in Xinjiang.
Key words:potato black scurf; isolation and identification; anastomosis groups
Fund projects:Regional Collaborative Project of Xinjiang Uyghur Autonomous Region(S amp; T Assisting Xinjiang Project) (2021E02024); Natural Science Foundation of Xinjiang Autonomous Region (2022D01F69); China Agriculture Research System- -National Potato Industry Technology System (CARS-09-ES36); Key Ramp;D Program of Xinjiang Autonomous Region (Linkage between departments and departments) (2022B02044).
Correspondence author: LI Guangyue (1983-), male, from Cangzhou, Hebei, research fellow, doctoral supervisor,research direction: biological control of plant diseases, (E-mail)liguangyue@caas.cn
YANG Ruwei (1984-), female, from Lingwu, Ningxia, senior agronomist, research direction: plant protection, (E-mail)617950493@qq.com
收稿日期(Received):
2024-01-05
基金项目:
新疆维吾尔自治区区域协同创新专项(科技援疆计划)(2021E02024);新疆维吾尔自治区自然科学基金(地州科学基金)项目(2022D01F69);国家马铃薯产业技术体系(CARS-09-ES36);新疆维吾尔自治区重点研发计划(厅厅联动) (2022B02044)
作者简介:
沈洪飞(1989-),男,云南昆明人,助理研究员,研究方向为马铃薯育种及病害防治,(E-mail)hongfeiscience@163.com
通讯作者:
李广悦(1983-),男,河北沧州人,研究员,博士生导师,研究方向为植物病害生物防治,(E-mail)liguangyue@caas.cn
杨茹薇(1984-),女,宁夏灵武人,硕士,正高级农艺师,研究方向为植物保护,(E-mail)617950493@qq.com
