江苏1株鸡传染性贫血病毒的分离鉴定
2015-10-20杜宗沛等
杜宗沛等
摘要:利用MDCC-MSB1细胞系从江苏省泰州市发病鸡中分离获得1株病毒,通过间接荧光抗体试验(IFA)确定该病毒为鸡传染性贫血病毒(CAV)。利用PCR扩增、电泳、克隆、核酸测序得到全长2 324 bp的基因编码区序列,该序列碱基完整,无缺失和插入。经遗传学方法分析发现,该株序列与GenBank中已收录的可见CAV序列同源性为96.5%~99.8%。CAV的3个编码基因序列VP1(1 315 bp)、VP2(643 bp)、VP3(366 bp)均有不同程度变异,以VP1变异程度最大。使用电子显微镜观察到病毒粒子与鸡传染性贫血病毒一致,证实该病毒为鸡传染性贫血病毒新亚型,将其命名为CAV MY1305-30株并提交至GanBank,编号为KF318725、KF318726。
关键词: 鸡;传染性贫血病毒;分离鉴定;基因序列;编码
中图分类号: S855.3文献标志码: A文章编号:1002-1302(2015)09-0244-03
鸡传染性贫血病(Chicken infectious anemia,CIA)最早被称为贫血综合征、贫血-皮炎综合征、出血性贫血病、贫血因子病等,其病原于1979年被首次分离并确定,早期称其为鸡贫血因子(chicken anemia agent,CAA)、鸡传染性贫血病毒(chicken infectious anemia virus,CIAV),之后逐渐统一称作鸡贫血病毒(chicken anemia virus,CAV)。CAV的核酸为环状单股负链DNA,在1995年第6次国际病毒分类大会上将其与猪圆环病毒(PCV)、长尾鹦鹉啄羽病病毒(PBFDV)一起归属于圆环病毒科(Circoviridae),该科病毒是已知最小的动植物病毒,因此很少有人能通过电子显微镜观察到CAV。从CAV感染的MDCC-MSB1(鸡马立克氏病成淋巴细胞样细胞系)细胞培养液中纯化的病毒粒子,经负染后在电子显微镜下呈直径约为20 nm的球状。CAV对乙醚、三氯甲烷均有抵抗力;对酸(pH值为3)作用3 h后仍保持稳定;对56 ℃下 120 min、70 ℃下60 min、80 ℃下15 min的处理均有抵抗力。鸡传染性贫血病的特征性病理变化为骨髓黄化和胸腺萎缩。发病鸡骨髓中的红髓组织被脂肪组织替代,呈黄色;胸腺严重萎缩,其大小仅为正常鸡的1/10。鸡传染性贫血病广泛流行于世界各地,呈垂直和水平传播[1]。
1材料
1.1待检样品
1日龄雏鸡来自江苏省泰州市,用间接酶联免疫吸附(ELISA)检测其父母代种鸡群血清,CAV阳性率高达87%。
1.2试剂和细胞
exTaq DNA聚合酶、rTaq DNA聚合酶、dNTP、DL2 000 DNA Marker、酚氯仿异戊醇、蛋白酶K均购于大连宝生物工程有限公司;无水乙醇、三氯甲烷均购于天津市富宇精细化工有限公司;琼脂糖购于上海英俊生物技术有限公司;EB替代物购于北京普利莱基因技术有限公司;工程菌DH5α、单克隆抗MDCC-MSB1细胞、CAV毒株阳性对照均由笔者所在实验室保存与提供。细胞培养液配方为83% RPMI 1640、15%胎牛血清、1%双抗、1%谷氨酰胺;细胞维持液配方为93% RPMI 1640、5%胎牛血清、1%双抗、1%谷氨酰胺;细胞冻存液配方为基础培养液、30%~40%胎牛血清、10% DMSO。
2方法
2.1样品的采集与处理
于江苏省泰州市发生鸡传染性贫血病的某鸡场采集 10~50 日龄的病鸡或病死鸡,在生物安全实验室内对其进行剖检,采集雏鸡的肝、脾、胸腺等组织脏器,充分研磨后用灭菌生理盐水制成悬浊液,加入终浓度为1 000 U/mL的双抗,于37 ℃下感作60 min。将其反复冻融3次后进行超声波处理,将1 000 g离心4 min后取上清,于70 ℃水浴处理5 min,再经体积分数50%的三氯甲烷处理15 min,离心并取上清,经 0.22 μm 微孔滤膜过滤除菌后,置于-70 ℃保存待检。其中一份用于PCR的初步检测,另一份用于病毒的分离培养。
2.2回归试验
将分离毒株的第4代至第6代MSB1细胞培养物分别腹腔接种于1日龄SPF鸡0.2 mL/羽。于接种后14 d迫杀,测定HCT值,并进行病理剖检及病理组织学检查。
2.3MDCC-MSB1细胞培养分离
将含病毒样品接种MDCC-MSB1细胞,每2~3 d盲传1代,每日观察细胞病变(CPE),当70%~80%的细胞崩解或代谢停止时收毒[2],并置于-20 ℃保存备用。
2.4免疫荧光染色试验
取分离毒株细胞培养物和T K5803分别接种MDCC-MSB1细胞(3.0×105个/mL),于48 h后收集细胞培养物,以1 000 r/min离心5 min,将细胞沉淀用PBS洗3次并涂于载玻片,干燥后用冷丙酮固定10 min。接种1日龄SPF鸡的组织切片,也按同样方法固定后作为待测抗原,进行间接免疫荧光染色,并用荧光显微镜观察。
2.5分离毒株的CAV抗原检测
将1株分离毒株的细胞培养物经超声波破碎后离心,除去细胞碎片,用PEG浓缩后负染,进行电子显微镜观察。
2.6样品的PCR初步检测
2.6.1引物设计 根据已发表的CAV Cux-1、TR20等毒株的基因组序列设计并合成检测引物,用于样品的PCR检测。扩增靶基因的理论长度为582 bp,引物由北京六合华大基因科技股份有限公司合成。
2.6.2组织DNA的提取 采用蛋白酶K裂解法提取组织中的核酸,操作步骤如下:(1)取200 μL组织研磨液移至1.5 mL 的EP管中;(2)向EP管中依次加入300 μL PBS、5 μL 蛋白酶K、60 μL 10% SDS,于56 ℃水浴消化1 h后,至微波炉中高火处理1~2 min,使其透明澄清;(3)向各管加入等体积的酚氯仿异戊醇,以12 000 r/min离心10 min;(4)将上清液移至新的1.5 mL EP管中,重复步骤(3);(5)取上清液并加入等体积三氯甲烷,以12 000 r/min离心10 min;(6)取上清液并加入2倍体积的无水乙醇、1/10体积的NaAc(3 mol/L),于室温下静置1 h后,以12 000 r/min离心 10 min;(7)弃上清并加入500 μL 70%乙醇,以12 000 r/min离心 15 min;(8)弃上清,干燥5 min后加入40 μL Elution Buffer使其溶解。
2.6.3PCR检测 以病毒DNA为模板,用引物CAV-R、CAV-F 扩增所需目的基因。按反应体系(表1)配制好后混匀并置于PCR扩增仪中,运行如下程序:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,循环35次;72 ℃延伸10 min,结束后于4 ℃保存。
表1 PCR 25 μL反应体系
组分 加入体积(μL/支)10×Buffer 2.5DNTP(2.5 mmol/L) 2.0引物CAV-R(20.0 mmol/L) 1.0引物CAV-F(20.0 mmol/L) 1.0rTaq酶 0.5ddH2O 15.5DNA模板(1 μg/μL)2.0合计25.0
2.6.4PCR扩增电泳操作步骤如下:(1)称取1 g琼脂糖,与100 mL的1×TAE缓冲液配成1%琼脂糖溶液。(2)溶解后冷却5~10 min,加入14 μL EB替代物并混匀。(3)架好梳子,倒入琼脂糖溶液,静置30 min使其凝固,移去梳子。(4)将PCR扩增产物与Loading Buffer缓冲液按 5 ∶1 的比例混匀,并将混匀后的液体加至电泳槽小孔中。(5)重复步骤(4),加入其他剩余PCR扩增产物。(6)选用DL2000的Marker,加至电泳槽小孔中。(7)接通电源,红色为正极、黑色为负极,将电压调至180 V。(8)电泳条带至1/3位置时即可停止,电泳时间约为10~15 min。(9)使用凝胶成像系统进行拍摄并保存。
3结果与分析
3.1 病毒的分离鉴定
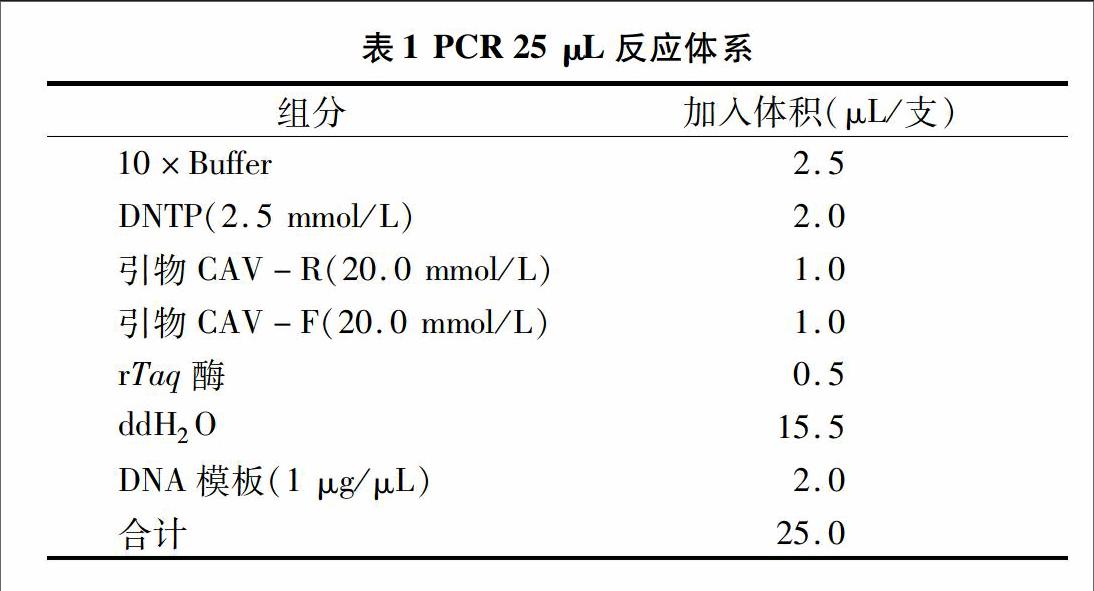
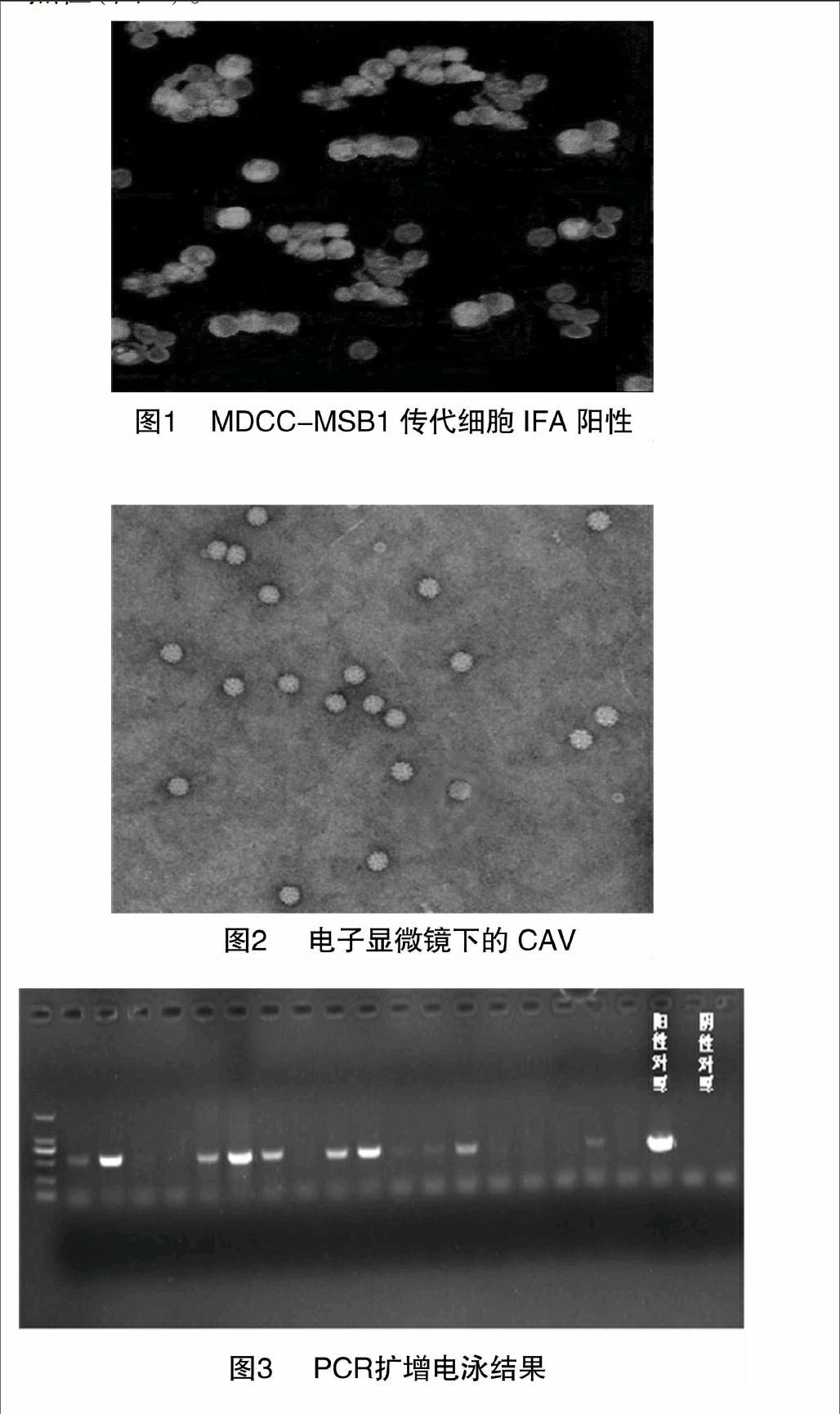
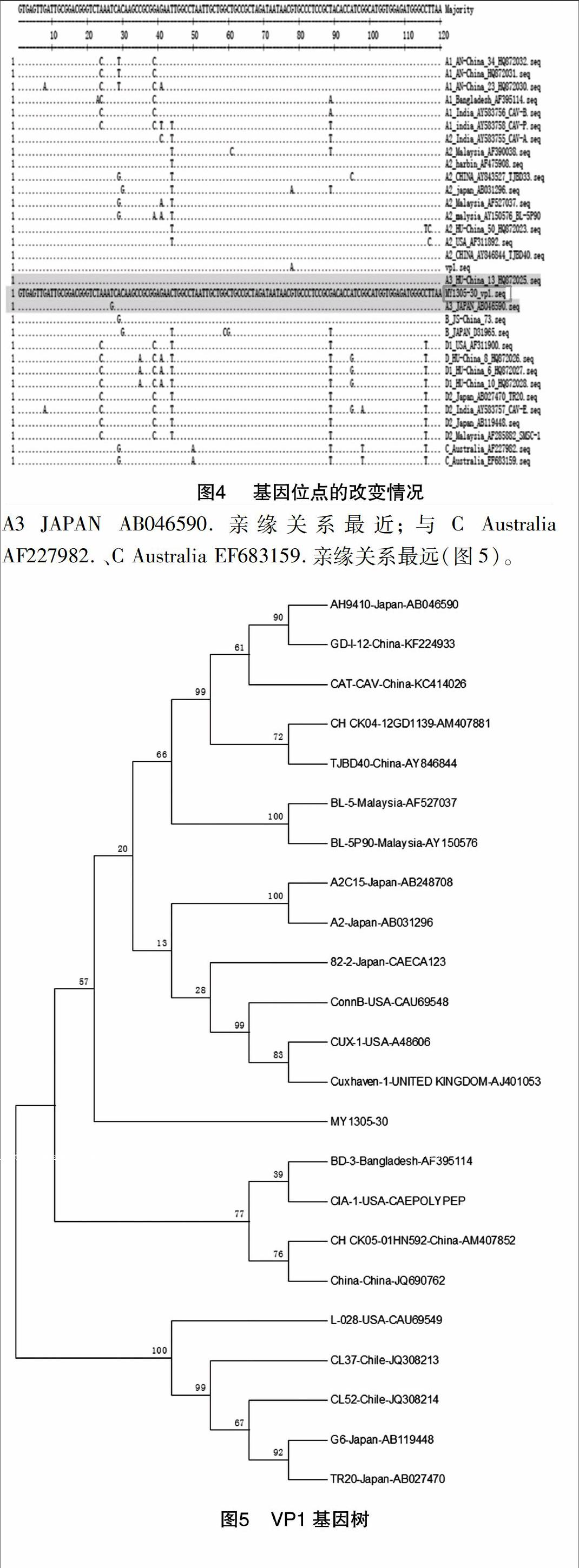
感染CAV的MDCC-MSB1传代细胞呈IFA阳性(图1)。分离株CAV经电子显微镜观察,与以往发现的CAV结构一致(图2)。分离株与CAV阳性对照的电泳条带处于同一点位(图3)。
3.2序列测定结果
CAV MY1305-30株基因编码区全长为2 324 bp,碱基完整,无缺失和插入。与国际基因库中可见CAV序列进行同源性、亲缘关系的比对分析,结果发现,其同源性为96.5%~998%。CAV的3个编码基因序列VP1(1 315 bp)、VP2(643 bp)、VP3(366 bp)均有不同程度变异,其中VP1的变异程度最大。
3.3核苷酸和氨基酸位点的改变
由VP1基因比对序列结果可知,MY1305-30属于A3亚分支。在683位核苷酸中该点为T,而JAPAN-ABO46590则为G(图4)。
3.4遗传进化关系分析
将CAV MY1305-30株基因与国际基因库中可见CAV序列进行遗传进化比对分析,绘制遗传进化树。CAV MY1305-30株VP1基因属于以Majority为代表的基因群,与
A3 JAPAN AB046590.亲缘关系最近;与C Australia AF227982.、C Australia EF683159.亲缘关系最远(图5)。
CAV MY1305-30株基因VP2序列与印度的A1 India AY583756 CAV-B亲缘关系最近,与澳大利亚的C Australia AF227982、C Australia EF683159亲缘关系最远(图6)。
4结论与讨论
基因序列分析对比表明,江苏分离株CAV MY1305-30与其他32株CAV病毒编码区的核苷酸基因同源性为96.5%~99.8%;与vp1.seq、B_JS-China_73.seq、A3 JAPAN AB046590.seq株相对比,VP1序列仅有1个碱基不同。单一比对VP1、VP2、VP3的生物开放阅读框架(ORF),CAV MY1305-30与其他32株CAV毒株的核苷酸同源性分别达95.7%、99.1%、98.7%以上,表明该分离株变异不大,且CAV病毒本身变异很小。
由进化树分析结果可见,CAV VP1所对比的32个毒株分为两大分支,各分支中均有亚洲、欧美的毒株存在,并无明显的地域区分性。CAV VP2所对比的32个毒株也没有明显的地域区分性,两大分支中各有亚洲、欧美的毒株存在。
参考文献:
[1]Yassir M,Eltahir,et al. Molecular epidemiology of chicken anemia virusin commercial farms in China[J]. Virology Journal,2011,8:145-152.
[2]刘婉思,高宏雷,秦立廷,等. 1株野鸭源鸡贫血病病毒的分离鉴定及其编码区基因序列分析[J]. 中国兽医学报,2013,33(5):654-658,679.李波,陈雪梅,李铁缘,等. 2种不同抗旱性冰草叶片解剖结构的比较[J]. 江苏农业科学,2015,43(9):247-249.
