利用流式细胞术鉴定3种李属植物基因组大小及染色体倍性检测
2024-12-31王亚铜郭婧婧杨芬芬牛莹莹章世奎樊国全王尚栋耿文娟



摘 要:【目的】研究适合不同李属资源的FCM检测体系,估测其基因组大小及倍性,为李属资源的鉴定、分类及基因组和转录组等深入研究提供依据。
【方法】利用FCM对3种常用的细胞核裂解液进行筛选与优化,选取最适宜的裂解液鉴定3种李属植物进行基因组大小和检测染色体倍性。
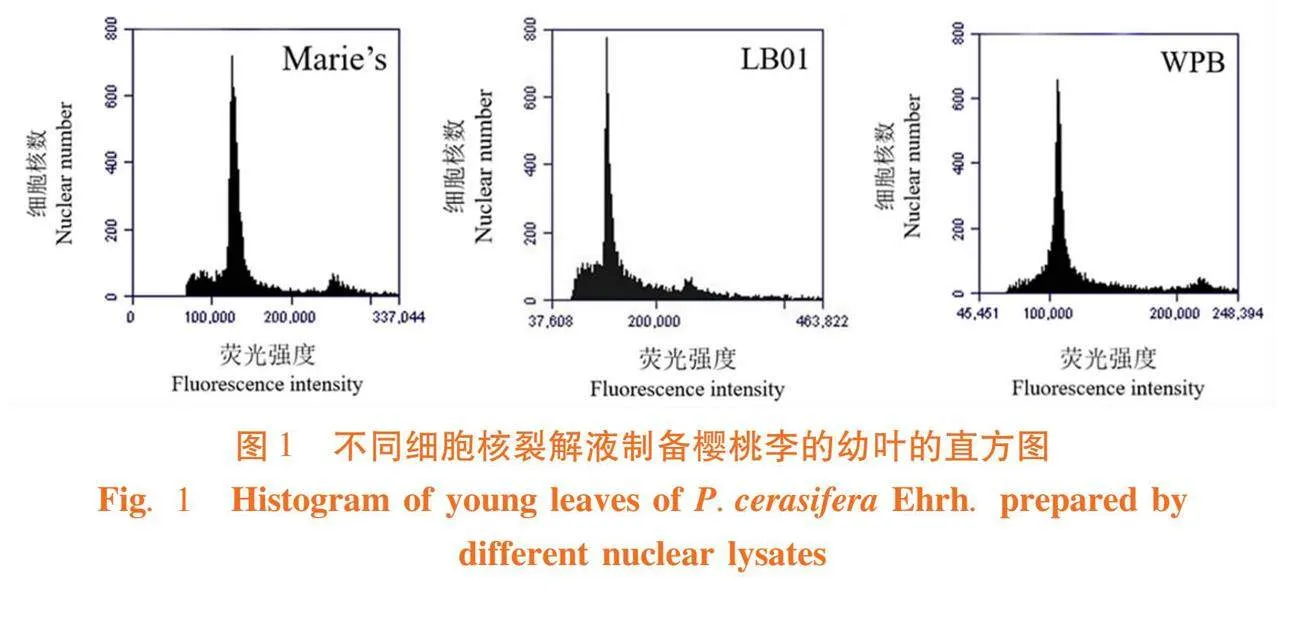
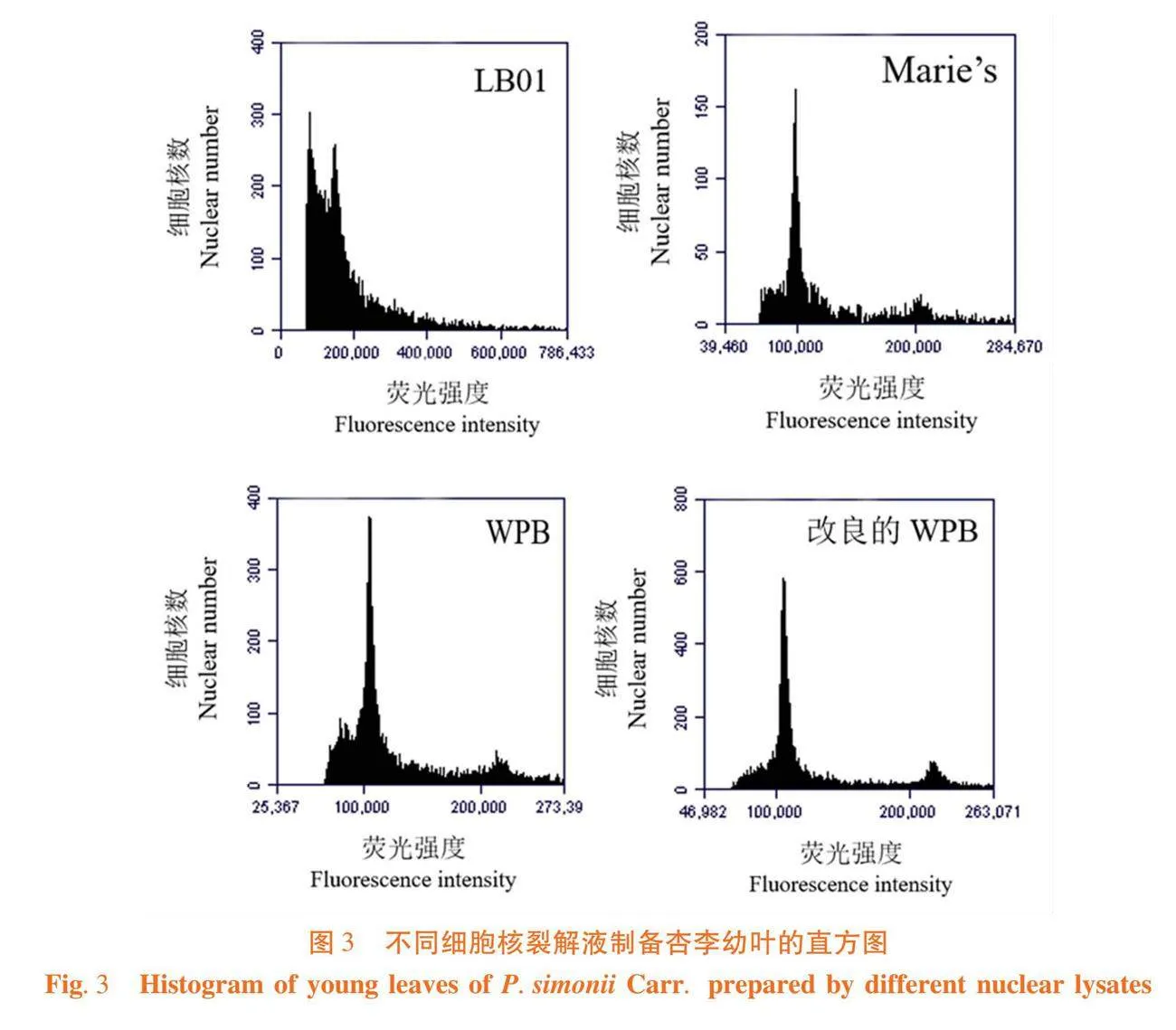
【结果】LB01、Marie’s和WPB 3种裂解液对樱桃李检测效果均较好,而WPB裂解液检测效果最佳;Marie’s和LB01裂解液与欧洲李不匹配,改良的WPB裂解液最适合欧洲李;杏李与LB01裂解液不匹配,WPB裂解液对杏李的裂解效果好于Marie’s裂解液,而改良的WPB裂解液对杏李的裂解效果均最好。樱桃李和杏李基因组大小范围分别为491.22~566.40 Mb和514.46~573.83 Mb,欧洲李资源平均基因组大小为1 678.37 Mb。
【结论】樱桃李和杏李资源均为二倍体,欧洲李资源全部为六倍体,李属植物每个种内不同品种之间的基因组大小存在一定差异。
关键词:李;流式细胞术(FCM);染色体倍性;基因组大小
中图分类号:S188"" 文献标志码:A"" 文章编号:1001-4330(2024)07-1673-09
0 引 言
【研究意义】李属(Prunus)植物在世界上约有19~40个种,其中包括一些中间杂交种[1],原产自中国和引种至中国栽培多年的主要有9个种和3个变种,其中欧洲李(P.domesitica L.)、樱桃李(P.cerasifera Ehrh.)和杏李(P.simonii Carr.)是新疆主要栽培种。欧洲李系列优良品种在新疆广泛栽培,截至2021年栽培面积达4.25×104 hm2[2]。目前,新疆杏李主要分布在阿克苏地区,樱桃李主要分布在伊犁哈萨克自治州,其果实多用于加工果酱。新疆李资源种类较多,不同种类在形态特征和生物学特性等具有丰富的多样性,同一种内的不同品种在部分性状上表现差异显著。因此,鉴定李属不同植物基因组大小和染色体倍性,对李属植物进化、分类及构建高通量测序文库等基因组相关的研究提供基础资料有实际意义。【前人研究进展】测定植物基因组大小的常用方法有孚尔根微显影法[3]、流式细胞术(Flow Cytometry, FCM)[4]和高通量测序法[5],植物染色体倍性鉴定多采用染色体观察法和形态观察法。FCM可以检测植物染色体倍性和基因组大小,且检测成本低而效率高,其主要通过检测悬浮在液体流中单细胞标记的荧光信号,可以快速而准确的获取植物基因组大小和染色体倍性,通常以变异系数(Coefficient of Variation,CV)值来评判细胞核裂解效果。目前,该技术已在多种果树中得到了广泛应用[6,7]。Ben等[8]检测了45份野生型和栽培型中国李的基因组大小,并以建立的李的分类地位研究其遗传变异。孙琪[9]通过染色体核型分析明确了供试的30株欧洲李均为六倍体。杨丽等[10]利用FCM对2份欧洲李和3份杏李资源进行了检测,确定了其DNA相对含量和染色体倍性。【本研究切入点】有文献研究显示,虽然对中国李和部分欧洲李、杏李品种进行了鉴定,但关于利用FCM鉴定新疆樱桃李、欧洲李和杏李资源的检测体系仍不完整,其基因组大小和倍性相关的基础数据库也不完备。需建立李属植物的FCM检测体系。【拟解决的关键问题】建立李属植物的FCM检测体系,并鉴定42份樱桃李、欧洲李和杏李资源的基因组大小和染色体倍性,为李属资源的鉴定、分类及基因组和转录组等深入研究提供理论依据。
1 材料与方法
1.1 材 料
供试的42份李属种质资源采自新疆农业科学院轮台果树资源圃(84°22′E、41°78′N,海拔906 m),树龄8~10年生,株行距2 m×4 m,水肥管理良好,园相整齐,植株生长健壮。于2023年6月剪取新梢带回实验室水培,摘取幼嫩叶片用于流式细胞试验,外标选用已完成基因组测序的二倍体砀山梨,其基因组大小为527 Mb[6]。表1
1.2 方 法
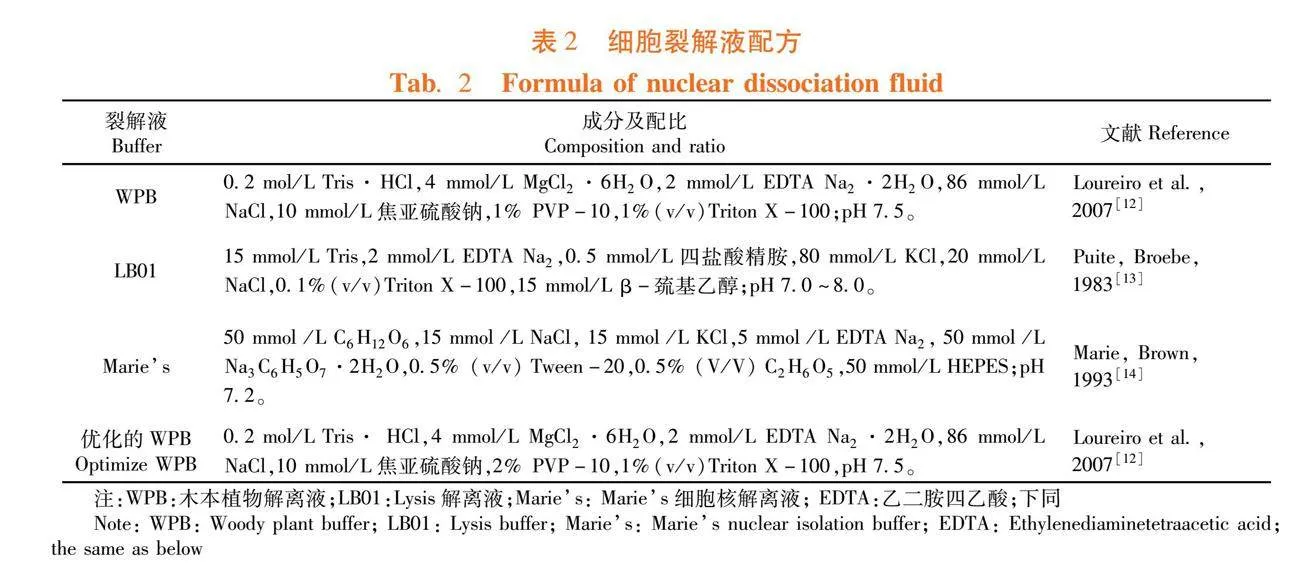
1.2.1 裂解液及DNA荧光染料的配制
配置好的裂解液用0.22 μm滤膜的真空泵进行抽滤,并置于4℃条件下保存。PI染液配制参照田新民等[11]的配制方法,在PI染液中加入500 μg/mL RNA酶,排除双链RNA对检测核DNA含量时的干扰,并选用非特异性标记碘化丙啶(PI)作荧光探针。表2
1.2.2 细胞核悬浮液的制备及上机检测
参照牛莹莹等[6]制备细胞悬浮液流程,称取0.1 g幼嫩叶片,依次用蒸馏水、去离子水冲洗2~3遍,擦干水,去除叶片主脉后置于预冷的培养皿中,加入2.0 mL预冷的裂解液,在冰浴条件下用刀片垂直向下快速切碎,4℃冷藏条件下放置2 min后,使用500目滤膜一次性过滤至1.5 mL的离心管中, 4℃冷藏条件下孵育5 min。在4℃条件下,1 000 r/min离心5 min。弃上清液至0.1 mL刻度处,分别加入200 μL预冷裂解液和预冷PI染液,轻轻混匀后置于4℃黑暗条件下染色10 min。最后将染色的细胞核悬浮液移至流式细胞仪(BD,美国,Accuri C6)上样处,设置参数为低流速、FL2荧光通道、收集5 000个细胞核颗粒后,检测其荧光强度。
1.2.3 细胞核裂解液的优化
选取3种常用的细胞核裂解液分别对樱桃李、欧洲李和杏李资源进行裂解,比对裂解效果,对WPB裂解液进行优化。参考赵孟良等[15]方法,即在配WPB裂解液过程中,加入2%的PVP-10药剂,其它步骤不变。
1.2.4 基因组大小及倍性计算
利用参照样本和待测样本G0/G1峰的荧光强度值,计算基因组大小和染色体倍性。绝对核DNA含量通常pg为单位,基因组大小多用bp为单位,二者转换关系为1pgDNA=0.978×103Mp[16]。待测样本基因组大小和染色体倍性的计算方法[17]。
待测样基因组大小=参照样本基因组大小×(待测样本G0/G1峰平均荧光强度/参照样本G0/G1峰平均荧光强度)。
待测样本倍性值(DI)=待测样本G0/G1峰荧光强度/二倍体参照材料荧光强度。
若DI接近1时,为二倍体;当DI接近2时,为四倍体;当DI接近3时,为六倍体。
1.3 数据处理
使用Cytometer software workspace软件收集基因组大小和倍性的数据,并用SPSS25.0软件进行数据统计分析。
2 结果与分析
2.1 樱桃李裂解液的筛选
研究表明,LB01、Marie’s和WPB三种裂解液对樱桃李制备的样本主峰窄,收集的粒子数量多而速度快,整体效果较好,但LB01和Marie’s裂解液所制备的样本普遍存在主峰左侧带有较少背景碎片的现象,LB01制备样品的背景碎片整体多于Marie’s,WPB裂解液相对而言制备樱桃李样品的效果最好。图1
2.2 "欧洲李裂解液的筛选及优化
研究表明,LB01和Marie’s裂解液制备的欧洲李样品悬浮液均呈现单侧峰,即碎片峰,LB01产生的主峰不明显,而Marie’s产生的主峰值较低,LB01的裂解效果较Marie’s差,上述裂解液与欧洲李材料不匹配。WPB裂解液制备的欧洲李样品悬浮液虽然呈现单侧峰,但其主峰窄而峰值较高,CV值多在5%以内。改良的WPB对大多数欧洲李样品的悬浮液并未产生单侧峰,仅在主峰左侧呈现较少背景碎片,裂解过程中收集的粒子速度快而数量多,裂解效果最好。图2
2.3 杏李裂解液的筛选及优化
研究表明,LB01裂解液制备的杏李样品悬浮液产生的信号峰均为单侧峰,主峰不明显,裂解效果差,该裂解液不适合杏李材料。Marie’s和WPB制备的悬浮液产生的主峰效果较好,CV值均在5%范围内,但二者制备的悬浮液中掺杂有较少杂质,并且Marie’s收集的粒子数量较少。改良的WPB裂解液制备的悬浮液出峰效果最好,收集的粒子数量多而速度快,可以检测出绝大多数杏李品种的基因组大小和倍性关系。图3
2.4 不同李属植物的基因组大小和倍性的检测
研究表明,42份李属种质资源平均峰值的CV值均低于5%,结果可信;19份樱桃李资源的基因组大小为491.22~566.40 Mb,荧光通导值与参照样本的比值为0.93~1.08,全部为二倍体;17份欧洲李资源的基因组大小为1 616.50~1 737.97 Mb,荧光通导值与参照样本的比值为3.07~3.30,均为六倍体;6份杏李资源的基因组大小为514.46~573.83 Mb,荧光通导值与参照样本的比值为0.97~1.09,全部为二倍体。樱桃李、欧洲李和杏李每个种内不同品种之间的基因组大小存在一定差异,其中吉欧2红樱桃李和吉欧58早熟红樱桃李在樱桃李资源中差异最显著,欧洲李资源中极早熟1号、MY-O2013-2分别与总统差异最显著,杏李中风味皇后和味厚差异最显著。表3
3 讨 论
3.1
植物幼嫩叶片相比于植物的根尖[18]、花粉[19]、成熟叶片[20]等材料,幼嫩叶片的检测效果最好。研究选用3种李属资源植物的幼嫩叶片进行了检测,其变异系数CV值均低于5%,符合木本植物CV值的合格范围[21],检测效果较好。此外,过多的叶片用量由于自身天然荧光物(叶绿素)的影响也可造成试验结果误差[22]。
3.2
王利虎等[22]对6种常用裂解液的主要配方及所适用于不同植物的范围进行了归纳整理,认为WPB裂解液为欧洲李的最佳解离液[23]。研究发现,WPB、LB01和Marie’s 3种不同裂解液对樱桃李大部分样本的裂解效果均较好,同时也发现同一种裂解液可能也适用于多种不同的植物,此类现象与王利虎等[22]归纳整理的结果相一致,而WPB裂解液对樱桃李的裂解效果更好。Marie’s和LB01 2种裂解液与欧洲李不匹配,而WPB裂解液在解离欧洲李样品时主峰效果较好,但单侧峰较大;LB01裂解液与之不匹配,WPB裂解液对杏李的裂解效果好于Marie’s裂解液。改良的WPB裂解液对欧洲李和杏李的裂解效果均最好,因为欧洲李、杏李幼嫩叶片中富含酚类和多糖等粘性物质,而增加PVP的含量对消除酚类和多糖等物质起到了较好的作用。赵孟良等[15]对比添加PVP含量对菊芋的检测效果时,发现增加PVP的用量后对3种不同电压下的菊芋杂峰均减少。此外,李雯雯等[20]研究发现,单一的裂解液种类对新疆野杏的解离效果较差,改良的MgSO4-LB01混合裂解液最适合新疆野杏,是否混合裂解液在欧洲李和杏李等李属植物中也同等适用,有待进一步研究。
3.3
FCM的鉴定效率高于染色体计数法[24-26]。试验研究利用FCM检测结果表明,19份樱桃李资源均为二倍体,与前人研究结果一致[27],17份欧洲李资源均为六倍体,6份杏李资源均为二倍体,与吴丽萍等[28]研究结果一致,但研究的欧洲李资源的基因组大小与吴丽萍等[28]研究结果存在一定差异,原因是与欧洲李不同品种间的差异有关。研究还发现,同一品种的基因组大小存在一定差异,此类现象张俊环等[29]也有过报道,其原因主要与所选择的仪器设备、外标植物和测定方法等不同有关[28]。
4 结 论
欧洲李和杏李最适宜的解离液为改良的WPB裂解液;利用FCM鉴定的樱桃李和杏李资源均为二倍体,其基因组大小范围分别为491.22~566.40 Mb和514.46~573.83 Mb,而欧洲李资源全部为六倍体,平均基因组大小为1 678.37 Mb。鉴定3种李属资源基因组大小和染色体倍性。
参考文献(References)
[1]
Topp B L, Russel D M, Neumuller M, et al. Plum[M]. Badenes M L, Byrne D H. Fruit Breeding. Media: Springer Science Business, 2012: 571-621.
[2] 易首全, 李慧民. 喀什地区新梅发展历程[J]. 新疆农业科技, 2022, (2): 40-41.
YI Shouquan, LI Huimin. Development course of Xinmei in Kashi Area[J]. Xinjiang Agricultural Science and Technology, 2022, (2): 40-41.
[3] Levine R F, Bunn P A Jr, Hazzard K C, et al. Flow cytometric analysis of megakaryocyte ploidy. Comparison with Feulgen microdensitometry and discovery that 8N is the predominant ploidy class in guinea pig and monkey marrow[J]. Blood, 1980, 56(2): 210-217.
[4] Baumgarth N, Roederer M. A practical approach to multicolor flow cytometry for immunophenotyping[J]. Journal of Immunological Methods, 2000, 243(1/2): 77-97.
[5] Ferrarini M, Moretto M, Ward J A, et al. An evaluation of the PacBio RS platform for sequencing and de novo assembly of a chloroplast genome[J]. BMC Genomics, 2013, 14: 670.
[6] 牛莹莹, 周伟权, 陈湘颖, 等. 新疆本地梨品种基因组大小及倍性的流式细胞术检测优化[J]. 农业生物技术学报, 2020, 28(5): 933-944.
NIU Yingying, ZHOU Weiquan, CHEN Xiangying, et al. Optimization of flow cytometry for the determination of genome size and ploidy of local pear(Pyrus) varieties in Xinjiang[J]. Journal of Agricultural Biotechnology, 2020, 28(5): 933-944.
[7] 赖彪, 吴传龙, 秦永华, 等. 流式细胞仪测定荔枝倍性和基因组大小的细胞核提取液筛选与应用[J]. 果树学报, 2019, 36(7): 939-946.
LAI Biao, WU Chuanlong, QIN Yonghua, et al. Nuclear isolation buffer optimization and the determination of ploidy level and genome size of litchi using flow cytometry[J]. Journal of Fruit Science, 2019, 36(7): 939-946.
[8] Ben Tamarzizt H, Walker D, Ben Mustapha S, et al. DNA variation and polymorphism in Tunisian plum species (Prunus spp): contribution of flow cytometry and molecular markers[J]. Genetics and Molecular Research: GMR, 2015, 14(4): 18034-18046.
[9] 孙琪. 新疆欧洲李种质资源亲缘关系研究[D]. 乌鲁木齐: 新疆农业大学, 2015.
SUN Qi. Study on Genetic Relationship of European Plum(prunus Domestica L.) Germplasm Resources in Xinjiang[D]. Urumqi: Xinjiang Agricultural University, 2015.
[10] 杨丽, 孙浩元, 张俊环, 等. 利用流式细胞术鉴定杏及其部分近缘植物的倍性[J]. 西北农业学报, 2021, 30(10): 1504-1513.
YANG Li, SUN Haoyuan, ZHANG Junhuan, et al. Ploidy identification of germplasm resources of apricot and its wild relatives by flow cytometry[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2021, 30(10): 1504-1513.
[11] 田新民, 周香艳, 弓娜. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.
TIAN Xinmin, ZHOU Xiangyan, GONG Na. Applications of flow cytometry in plant research—analysis of nuclear DNA content and ploidy level in plant cells[J]. Chinese Agricultural Science Bulletin, 2011, 27(9): 21-27.
[12] Loureiro J, Rodriguez E, Dolezel J, et al. Two new nuclear isolation buffers for plant DNA flow cytometry: a test with 37 species[J]. Annals of Botany, 2007, 100(4): 875-888.
[13] Puite K J, Ten Broeke W R R. DNA staining of fixed and non-fixed plant protoplasts for flow cytometry with hoechst 33342[J]. Plant Science Letters, 1983, 32(1/2): 79-88.
[14] Marie D, Brown S C. A cytometric exercise in plant DNA histograms, with 2C values for 70 species[J]. Biology of the Cell, 1993, 78(1/2): 41-51.
[15] 赵孟良, 任延靖, 田闵玉, 等. 基于流式细胞仪鉴定菊芋倍性方法的建立及应用[J]. 西北农林科技大学学报(自然科学版), 2021, 49(3): 138-146.
ZHAO Mengliang, REN Yanjing, TIAN Minyu, et al. Establishment and application of aploidy method for identification of Helianthus tuberosus L. by flow cytometry[J]. Journal of Northwest A amp; F University (Natural Science Edition), 2021, 49(3): 138-146.
[16] Cires E, Cuesta C, Peredo E L, et al. Genome size variation and morphological differentiation within Ranunculus parnassifolius group (Ranunculaceae) from calcareous screes in the Northwest of Spain[J]. Plant Systematics and Evolution, 2009, 281(1): 193-208.
[17] 董中源. 美洲黑杨自然多倍体筛选与鉴定及群体遗传多样性分析[D]. 南京: 南京林业大学, 2017.
DONG Zhongyuan. Large-scale Screening and Identification of Natural Polyploids in Populus Deltoids and Analysis of Population Genetic Diversity[D]. Nanjing: Nanjing Forestry University, 2017.
[18] 沈捷, 徐进, 刘光欣, 等. 不同分离缓冲液对杉木根尖细胞核悬液DNA分辨率的影响[J]. 分子植物育种, 2015, 13(1): 190-196.
SHEN Jie, XU Jin, LIU Guangxin, et al. Effects of different isolation buffers on DNA resolution in nucleus suspension of root tip cell of Cunninghamia lanceolata(lamb.) hook[J]. Molecular Plant Breeding, 2015, 13(1): 190-196.
[19] Kron P, Husband B C. Using flow cytometry to estimate pollen DNA content: improved methodology and applications[J]. Annals of Botany, 2012, 110(5): 1067-1078.
[20] 李雯雯, 刘立强, 帕米尔·艾尼, 等. 利用流式细胞术鉴定新疆野杏染色体倍性和DNA含量[J]. 农业生物技术学报, 2019, 27(3): 542-550.
LI Wenwen, LIU Liqiang, Pamier Aini, et al. Identification of chromosomal ploidy and DNA content in Xinjiang Armeniaca vulgaris by flow cytometry[J]. Journal of Agricultural Biotechnology," 2019, 27(3): 542-550.
[21] Dolezel J, Greilhuber J, Suda J. Estimation of nuclear DNA content in plants using flow cytometry[J]. Nature Protocols, 2007, 2(9): 2233-2244.
[22] 王利虎, 张琼, 陈凯, 等. 流式细胞术在植物倍性鉴定及基因组大小估测中的应用策略[J]. 分子植物育种, 2021, 19(17): 5833-5841.
WANG Lihu, ZHANG Qiong, CHEN Kai, et al. Application strategy of flow cytometry in plant ploidy identification and genome size estimation[J]. Molecular Plant Breeding, 2021, 19(17): 5833-5841.
[23] 王利虎, 吕晔, 罗智, 等. 流式细胞术估测枣染色体倍性和基因组大小方法的建立及应用[J]. 农业生物技术学报, 2018, 26(3): 511-520.
WANG Lihu, LYU Ye, LUO Zhi, et al. Establishment and application of a method for chromosome ploidy identification and genome size estimation using flow cytometry in Ziziphus jujuba[J]. Journal of Agricultural Biotechnology," 2018, 26(3): 511-520.
[24] 韩莎, 李四军, 许晓东, 等. 利用流式细胞仪快速鉴定桑树细胞的染色体倍数性[J]. 蚕业科学, 2013, 39(6): 1042-1048.
HAN Sha, LI Sijun, XU Xiaodong, et al. Quick identification of chromosomal ploidy of mulberry cells by flow cytometry[J]. Acta Sericologica Sinica, 2013, 39(6): 1042-1048.
[25] 李贇, 石荫坪, 束怀瑞, 等. 利用流式细胞光度术鉴定苹果倍性的研究[J]. 西北植物学报, 1998, 18(4): 40-41.
LI Yun, SHI Yinping, SHU Huairui, et al. Study on identification of apple ploidy by flow cytometry[J]. Acta Botanica Boreali-Occidentalia Sinica, 1998, 18(4): 40-41.
[26] 吴雅琴, 周锡明, 陈龙, 等. 利用流式细胞术鉴定甜樱桃砧木细胞核DNA含量和染色体倍性[J]. 果树学报, 2014, 31(S1): 48-52.
WU Yaqin, ZHOU Ximing, CHEN Long, et al. Identification of nuclear DNA content and chromosome ploidy of sweet cherry rootstocks by flow cytometry[J]. Journal of Fruit Science, 2014, 31(S1): 48-52.
[27] 蒲富慎, 林盛华, 张加延, 等. 李属杏属植物的染色体数目观察[J]. 中国果树, 1987,(4): 10-12.
PU Fushen, LIN Shenghua, ZHANG Jiayan, et al. Observation on chromosome number of Prunus and Apricot[J]. China Fruits, 1987,(4): 10-12.
[28] 吴丽萍, 唐岩, 李颖岳, 等. 枣和酸枣基因组大小测定[J]. 北京林业大学学报, 2013, 35(3): 77-83.
WU Liping, TANG Yan, LI Yingyue, et al. Estimation of genome size of Ziziphus jujuba and Z. acdiojujuba[J]. Journal of Beijing Forestry University, 2013, 35(3): 77-83.
[29] 张俊环, 杨丽, 姜凤超, 等. 基于流式细胞仪对杏属植物基因组大小的测定[J]. 华北农学报, 2020, 35(5): 32-38.
ZHANG Junhuan, YANG Li, JIANG Fengchao, et al. Estimation of genome size of apricots based on flow cytometry[J]. Acta Agriculturae Boreali-Sinica, 2020, 35(5): 32-38.
Identification of genome size and chromosomal ploidy of
three prunus species by flow cytometry
WANG Yatong1, GUO Jingjing1, YANG Fenfen1, NIU Yingying1, ZHANG Shikui2,
FAN Guoquan2, WANG Shangdong2, GENG Wenjuan1
(1. College of Horticulture, Xinjiang Agricultural University, Urumqi 830052, China; 2. Luntai Fruit Tree Germplasm Resource Nursery, Xinjiang Academy of Agricultural Sciences, Luntai Xinjiang 841600, China)
Abstract:【Objective】 To explore FCM detection system suitable for different Prunus resources, estimate their genome size and ploidy, and provide basis for the identification, classification, genome and transcriptome of Prunus resources.
【Methods】" Three commonly used nuclear lysates were screened and optimized by FCM, and the most suitable lysates were selected to detect the genome size and chromosome ploidy of three plum plants.
【Results】 LB01, Marie's and WPB lysates were all effective in the detection of P.simonii Carr., and WPB lysates was the best. The two lysates Marie's and LB01 did not match with P.domestica L., and the improved WPB lysate was the most suitable for P.simonii Carr. and LB01 lysate did not match, WPB lysate had better cracking effect on P.simonii Carr. than Marie's lysate, and the improved WPB lysate had the best cracking effect on P.simonii Carr. The two lysates Marie's and LB01 did not match with P.domestica L., and the improved WPB lysate was the most suitable for P.domestica L.. The P.simonii Carr. and LB01 lysate did not match, WPB lysate had better cracking effect on P.simonii Carr. .than Marie's lysate, and the improved WPB lysate had the best cracking effect on P.simonii Carr. With genome sizes ranging from 491.22 to 566.40 Mb and 514.46 to 573.83" Mb, respectively, with an average genome size of 1,678.37 Mb.
【Conclusion】" The identified germplasm resources of P.cerasifera Ehrh. and P.simonii Carr. were all diploid, while the P.domestica L. germplasm resources were all hexaploid, the genome size of different varieties in each species of Prunus genus is different.
Key words:plum; flow cytometry(FCM); chromosomal ploidy; genome size
Fund project:Basic Scientific Research Project for Colleges and Universities of Xinjiang Uygur Autonomous Region (XJEDU2022Z005)
Correspondence author:GENG Wenjuan (1983-), female, from Altay, Xinjiang,Ph. D., professor, research direction: fruit germplasm resources and cultivation physiology, (E-mail) gwj0526@163.com
收稿日期(Received):
2024-01-13
基金项目:
新疆维吾尔自治区高校基本科研业务费科研项目(XJEDU2022Z005)
作者简介:
王亚铜(1993-),男,宁夏隆德人,博士研究生,研究方向为果树种质资源与分子育种,(E-mail)wyt012129@163.com
通讯作者:
耿文娟(1983-),女,新疆阿勒泰人,教授,博士,硕士生/博士生导师,研究方向为果树种质资源与栽培生理,(E-mail)gwj0526@163.com
