免疫性血小板减少症患者外周血淋巴细胞亚群变化的研究
2015-09-11王志强
王志强

[摘要] 目的 研究免疫性血小板减少症(ITP)患者外周血淋巴细胞亚群的变化,探讨其在疾病诊断、治疗与预后方面的作用。 方法 以2012年1月~2014年1月鄂尔多斯市中心医院血液科收治的78例ITP患者作为ITP组,同时选择30例健康体检者作为对照组。检测两组外周血淋巴细胞亚群绝对值和血小板计数,采用SPSS 13.0统计学软件进行统计学分析。 结果 ITP组与对照组比较,CD3+ T细胞、CD3+CD4+ T细胞、CD4+/CD8+ T细胞比值、CD16+56+ NK细胞绝对值降低,CD3+CD8+ T细胞、CD19+ B细胞绝对值升高,差异有统计学意义(P<0.05);ITP组治疗后淋巴细胞亚群的变化早于血小板的变化。 结论 淋巴细胞亚群检测对ITP的辅助诊断及治疗效果的评估有较好的应用价值。
[关键词] 免疫性血小板减少症;淋巴细胞亚群;流式细胞术
[中图分类号] R446.1 [文献标识码] A [文章编号] 1674-4721(2015)08(c)-0120-03
[Abstract] Objective To study the changes of peripheral blood lymphocyte subsets in patients with immune thrombocytopenia and to discuss the role in the diagnosis,treatments and prognostic. Methods 78 patients with immune thrombocytopenia reduction who were treated in the department of hematology of erdos central hospital from January 2012 to January 2014 were selected as ITP group.At the same time,30 healthy subjects were chosen as control group.The absolute value of peripheral blood lymphocyte subsets and the platelet counts between two groups was detected respectively.The statistical analysis was performed by SPSS 13.0 statistical software. Results Compared with ITP group and the control group,the number of CD3+ T cells,CD3+CD4+ T cells,CD4+/CD8+ T cells and CD16+56+ NK cells was decreased respectively,while the number of CD3+CD8+ T cells and CD19+ B cells was increased respectively,with statistical difference(P<0.05).The changes in ITP group after treatment was earlier in lymphocyte subsets than platelet. Conclusion The detection of lymphocyte subsets has good application values for diagnosis and evaluation of the effect on the treatment to immune thrombocytopenia.
[Key words] Immune thrombocytopenia;Lymphocyte subsets;Flow cytometry
免疫性血小板减少症(immune thrombocytopenia,ITP)是以外周血血小板计数减少、骨髓巨核细胞数目正常或增多、血块收缩不良、出血时间延长为主要特点的一种疾病。年发病率为0.25万~0.50万,高发年龄约为5岁[1],一年四季均可发病,性别无明显差异。关于ITP的病因,国内外学者大多认为其与发病前期的感染和(或)疫苗接种密切相关。Cines等[2]研究认为,ITP患儿发病前1~4周,通常有病毒感染史,如流行性腮腺炎、水痘、风疹、麻疹等。虽然诱发ITP发生的病因至今尚未明确,近年越来越多的研究表明,ITP患者除了体液免疫异常外,还存在细胞免疫的异常,尤其与T淋巴细胞亚群、细胞因子表达及功能改变有密切联系[3]。本研究通过对免疫性血小板减少患者外周血淋巴细胞亚群的变化进行分析,探讨其在疾病诊断、治疗效果评估方面的临床应用价值。
1 资料与方法
1.1 一般资料
ITP组:选择2012年1月~2014年1月鄂尔多斯市中心医院血液科收治的78例免疫性血小板减少患者,其中男50例,女28例,年龄2~74岁,均为初次发病,诊断依据为张之南第3版《血液病诊断及疗效标准》。对照组:选择30例鄂尔多斯中心医院体检中心无任何过敏史的健康者作为对照组,其中男19例,女11例,年龄19~80岁。
1.2 仪器与试剂
淋巴细胞亚群绝对值测定用单克隆四色抗体(MultiTEST CD3/CD8/CD45/CD4,CD3/CD16+56/CD45/CD19,美国BD);溶血素(FACS Lysing Solution,美国BD);低速离心机(KD640,科大创新股份有限公司);螺旋震荡器(TW3,姜堰市新康医疗器械有限公司);流式细胞仪(FACS Calibur,美国BD);微量移液器(20 μl;200 μl;1000 μl,德国VITLAB);绝对值计数管(美国BD);5分类全自动血液分析仪(Sysmex XE5000,日本希森美康)。
1.3 标本采集
ITP组和对照组的检测标本均在空腹状态下无菌采集外周静脉血,EDTA抗凝,无凝血、溶血,每管2 ml(2管),室温存放(20~25℃),分别用作血小板计数和淋巴细胞亚群绝对值的检测,在4 h内完成检测。
1.4 方法
1.4.1 治疗前两组淋巴细胞亚群的检测 诊断为ITP的78例患者治疗前空腹采集2 ml EDTA抗凝静脉血检测淋巴细胞亚群绝对值计数。取2支淋巴细胞亚群绝对值计数专用试管,编号为1、2号。用反向加样的方式用微量移样器在1、2号管加入抗凝全血各50 μl,然后在1号管中加入20 μl MultiTEST CD3/CD8/CD45/CD4,2号管中加入20 μl MultiTEST CD3/CD16+56/CD45/CD19,螺旋震荡仪上充分混匀,室温下避光孵育15 min。然后在1、2号管各加入溶血素450 μl,充分混匀,避光裂解10 min红细胞。最后上机检测。对照组的淋巴细胞亚群的检测方法同ITP组。
1.4.2 治疗后ITP组血小板与淋巴细胞亚群的检测 ITP组的78例患者治疗后10 d、20 d、1个月分别采集2管EDTA抗凝静脉血。一管用流式细胞仪检测淋巴细胞亚群绝对值,另一管用五分类全自动血液分析仪检测血小板计数。按照治疗标准选出治疗有效的患者进行研究。
1.5 统计学方法
采用SPSS 13.0统计软件对数据进行分析和处理,正态分布的测得值均以均数±标准差(x±s)表示,符合正态分布的两组间数据比较采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 治疗前两组淋巴细胞亚群绝对值的比较
ITP组与正常对照组之间淋巴细胞亚群绝对值比较,CD3+ T细胞、CD3+CD4+ T细胞、CD16+56+ NK细胞减少,CD4+/CD8+ T细胞比值降低、CD3+CD8+ T细胞、CD19+ B细胞增多,差异有统计学意义(P<0.05)(表1)。
2.2 治疗后ITP组血小板与淋巴细胞亚群绝对值计数的比较
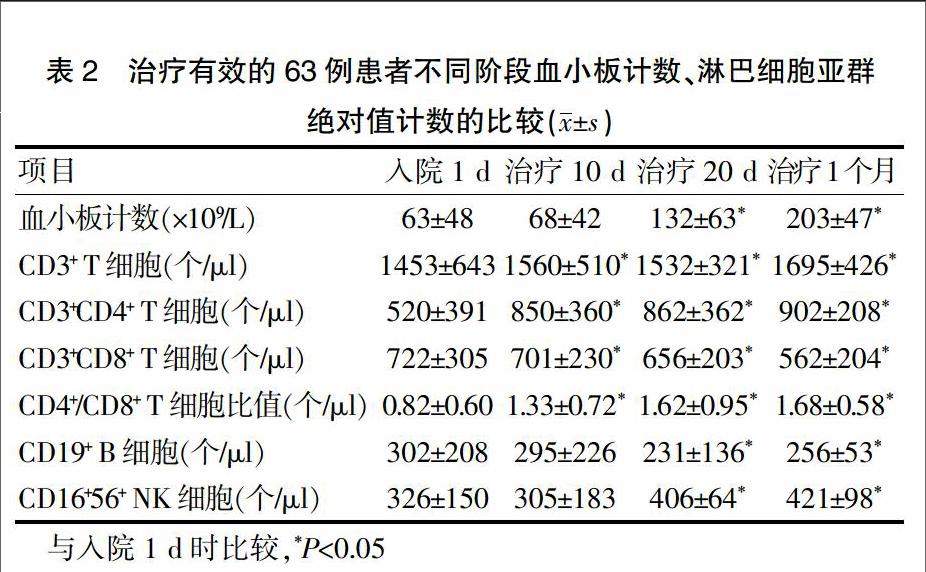
根据临床诊断与疗效标准,78例ITP患者1个月后治疗有效的为63例。63例患者治疗10 d时,血小板计数与入院时比较,差异无统计学意义(P>0.05);淋巴细胞亚群绝对值计数中CD3+ T细胞、CD3+CD4+ T细胞、CD4+/CD8+ T细胞比值升高,CD3+CD8+ T细胞降低,与入院时比较差异有统计学意义(P<0.05)(表2)。
3 讨论
ITP是一种获得性免疫紊乱所导致的以单纯性血小板减少为特征的疾病,外周血小板计数<100×109/L[4],关于ITP的病因及发病机制至今尚未明确,但近年来随着免疫学的发展、各种抗体的发现,更多的淋巴细胞表面标记检测越来越方便。长期以来,国内外学者认为单核-吞噬细胞系统中体液免疫介导的血小板破坏增加、骨髓巨核细胞功能异常使血小板降低[5-8]。Roark JH等[9-12]研究表明,抗血小板抗体是通过抗原驱动诱导和体细胞突变导致有限数量的B细胞克隆增值而产生。
流式细胞术(FCM)因其具有采血量少、灵敏、快速及重复性好等特点,使国内外大量研究采用此种方式检测免疫性血小板抗体减少并应用于临床。随着研究深入,发现除体液免疫外,细胞免疫在ITP的发病机制中的作用也不容忽视,一系列研究证实,B细胞产生抗血小板抗体的免疫过程需要抗原特异性CD4+ T细胞的协助,因此T细胞可能也参与了ITP疾病的发生。Kuwana等[13]通过实验研究证实,在一些ITP患者中,T细胞在GPⅡb/Ⅲa受体碎片暴露的情况下可刺激抗体的合成,而对于天然蛋白质并不会出现此现象。BORNE等[14]研究认为,CD4+ T细胞的降低也可促进自身反应性B细胞的增值,产生血小板抗体,破坏血小板,提示ITP的发病机制可能既存在淋巴细胞表型的异常,又存在着淋巴细胞功能的异常。CD4+ T细胞具有辅助、诱导细胞及体液免疫的作用,CD8+ T细胞对细胞及体液免疫起抑制作用,因此CD4+/CD8+ T细胞比值是免疫功能状态重要的检测指标,李美玲等[15]认为,其比值的降低与免疫系统损伤的程度相关。在本实验中,ITP组与对照组比较,CD4+/CD8+ T细胞比值下降,同时CD4+ T细胞绝对值数也有不同程度的降低,与研究报道较符合。研究表明NK细胞对B细胞有抑制分化的作用,还能调理抗体依赖细胞介导的细胞毒作用和吞噬作用。本实验中ITP组较对照组NK细胞绝对值数下降,提示其对B细胞的抑制分化作用能力下降,从而使B细胞异常活化发生过强的免疫反应。在本实验中,ITP组的淋巴细胞亚群绝对值计数与对照组比较差异有统计学意义,淋巴细胞亚群绝对值计数可以辅助诊断ITP。同时治疗有效的ITP患者外周血淋巴细胞亚群中CD3+ T细胞、CD3+CD4+ T细胞、CD3+CD8+ T细胞、CD4+/CD8+ T细胞比值的改变均早于血小板计数,在临床上对于ITP的预后判断优于血小板计数。
综上所述,细胞免疫与体液免疫紊乱在ITP发病中发挥重要作用,淋巴细胞亚群绝对值计数对ITP的辅助诊断和预后优于血小板计数。血小板计数和淋巴细胞亚群绝对值检测的联合应用对ITP的诊断及疗效评估有较好的实用价值,在治疗上应注意纠正免疫失衡,运用免疫调节手段治疗ITP。
[参考文献]
[1] Bennett J.Acquired platelet function defects[M].Cambridge:J Vermylen Cambridge University Press,2002:689-706.
[2] Cines DB,Blanchetie VS.Immune thrombocytopenic purpura[J].N Engl J Med,2002,346(13):995-1008.
[3] Blair A,Baker CL,Pamphilon DH,et al.Ex vivo expansion of megakaryocyte progenitor cells from normal bone marrow and peripheral blood and from patients with haematological malignancies[J].Br J Haematol,2002,116(4):912-919.
[4] Provan D,Stasi R,Newland AC,et al.International consensus report on the investigation and management of primary immune thrombocytopenia[J].Blood,2010,115(2):168-186.
[5] Stasi R,Del Poeta G,Stipa E,et al.Response to B-cell depleting therapy with rituximab reverts the abnormalities of T cell subsets in patients with idiopathic thrombocytopenic purpura[J].Blood,2007,110(8):2924-2930.
[6] 杨毓,黄兵,郭景慧.肝硬化患者外周血血小板参数和单核细胞参数的变化及临床意义[J].中国当代医药,2015, 22(15):106-108.
[7] Rodeghero F,Stasi R,Gernsheimer T,et al.Standardization of terminology,definitions and outcome criteria in immune thrombocytopenic purpura of adults and children:report from an international working group[J].Blood,2009,113(11):2386-2393.
[8] Neunert CE,Bright BC,Buchanan GR.Severe chronic refractory immune thrombocytopenic purpura during childhood:a survey of physician management[J].Pediatr Blood Cancer,2008,51(4):513-516.
[9] Roark JH,Bussel JB,Cines DB,et al.Genetic analysis of autoantibodies in idiopathic thrombocytopenic purpura reveals evidence of clonal expansion and somatic mutation[J].Blood,2002,100(4):1388-1398.
[10] Coopamah MD,Garvey MB,Freedman J,et al.Cellular immune mechanisms in autoimmune thrombocytopenic purpura:An update[J].Transfus Med Rev,2003,17(1):69-80.
[11] Kumar S,Khadwal A,Verma S,et al.Immune thrombocytopenic purpura due to mixed viral infections[J].Indian J Pediatr,2013,80(5):421-422.
[12] Imbach P,Khne T,Mlier D,et al.Childhood ITP:12 months follow‐up data from the prospective registry I of the Intercontinental Childhood ITP Study Group(ICIS)[J].Pediatr Blood Cancer,2006,46(3):351-356.
[13] Kuwana M,Kaburaki J,Kitasato H,et al.Immunodominant epitopes on glycoprotein IIb-IIIa recognized by autoreactive T cells in patients with immune thrombocytopenic purpura[J].Blood,2001,98(1):130-139.
[14] von dem Borne AE,Helmerhorst FM,van Leeuwen EF,et al.Autoimmune thrombocytopenia:detection of platelet autoantibodies with the suspension immunofluorescence test[J].Br J Haematol,1980,45(2):319-327.
[15] 李美玲,杨林花,朱镭,等.流式细胞术研究特发性血小板减少性紫癜患者血小板相关抗体[J].临床血液学杂志,2007,20(4):210-212.
(收稿日期:2015-03-12 本文编辑:王红双)
