CT影像组学可辅助诊断慢性乙型肝炎肝纤维化
2024-11-01赫晓磊王俊王艳
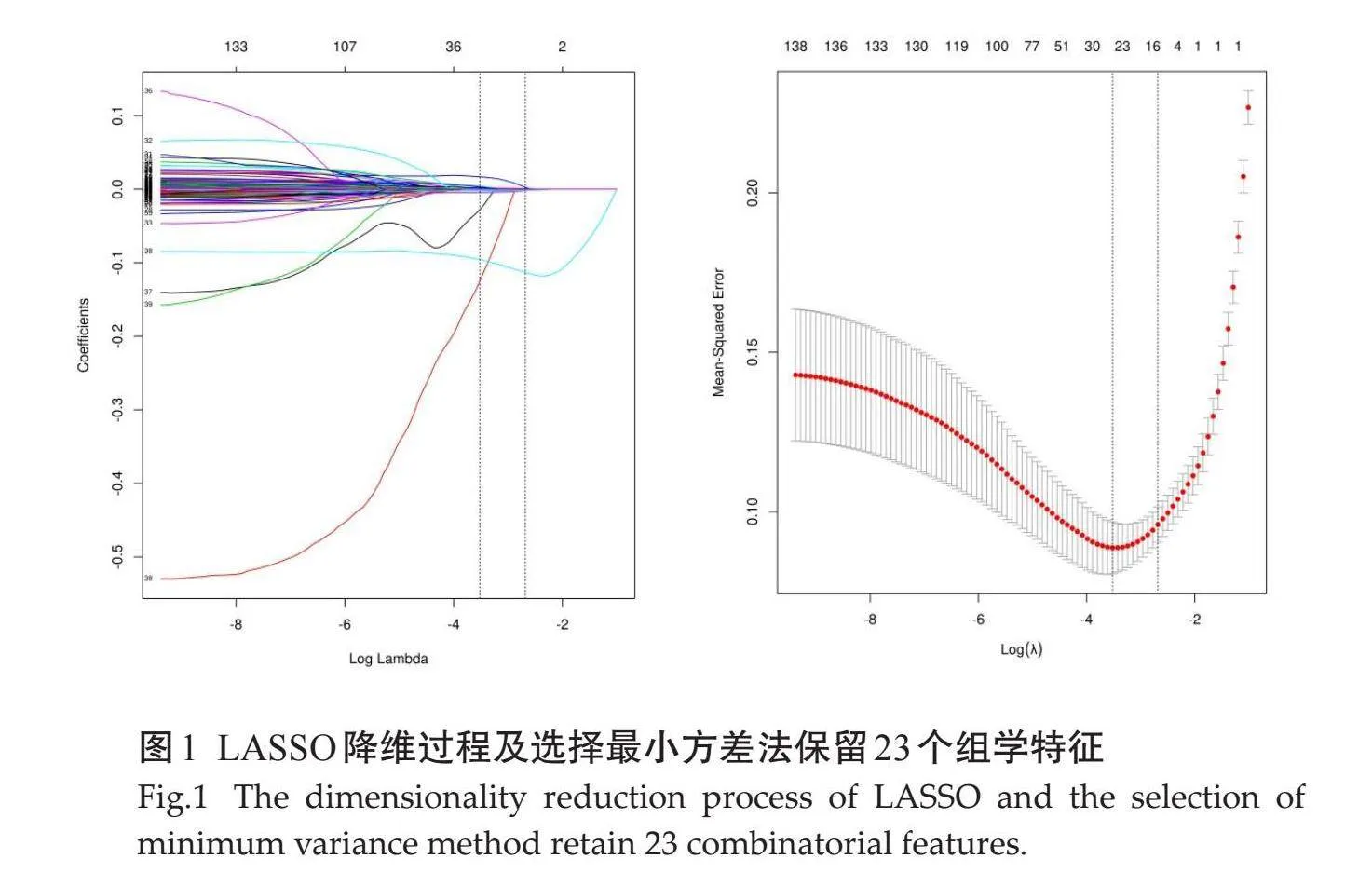

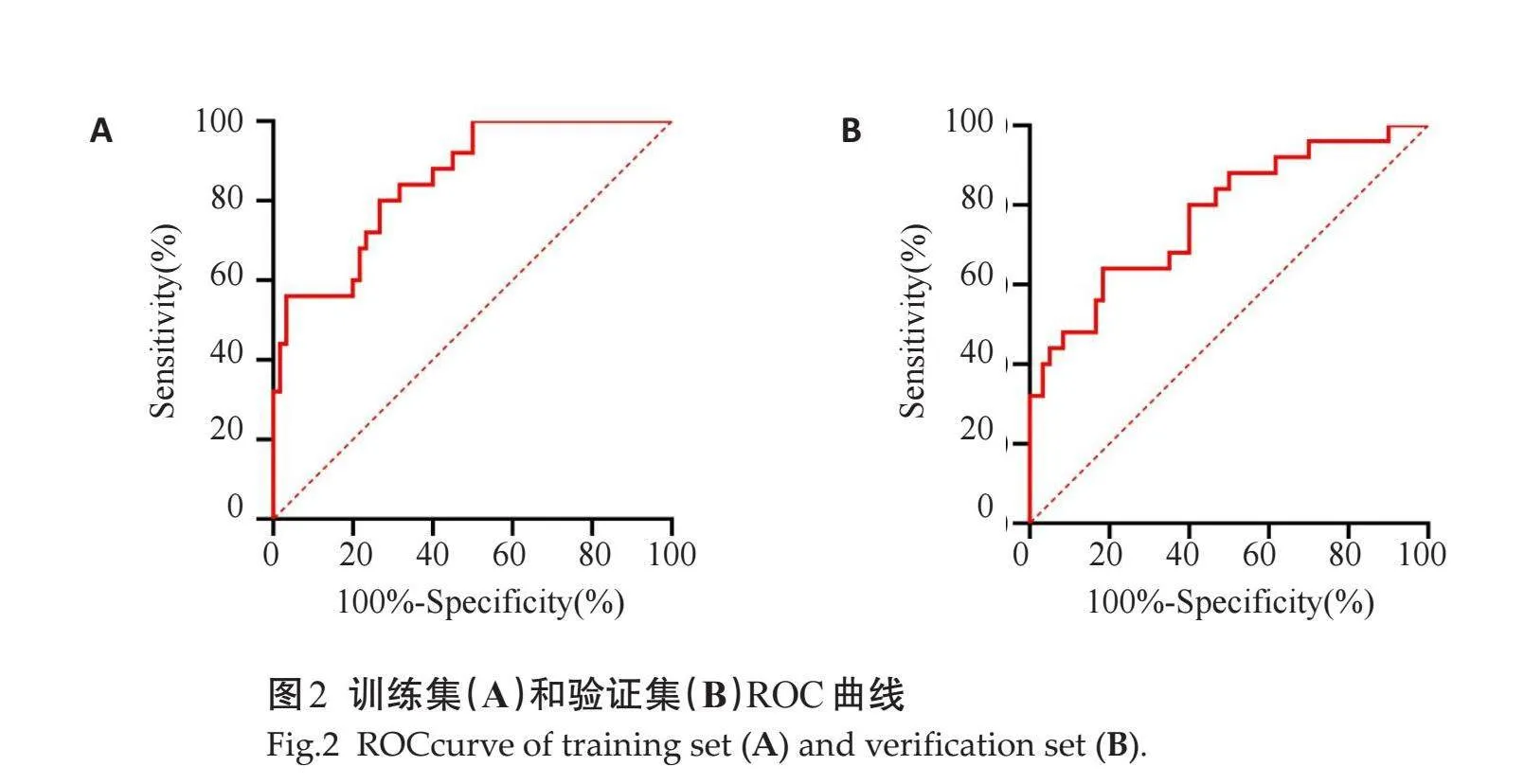
摘要:目的" 探讨CT影像组学对慢性乙型肝炎(CHB)肝纤维化的诊断价值。方法" 选取新疆维吾尔自治区人民医院于2023年1~10月收治的210例CHB患者为研究对象。根据患者是否发生肝纤维划分为无纤维化组(n=137)和合并纤维化组(n=73)。所有患者均接受CT平扫+增强扫描,应用Shukun Radiomics V94软件自每张CT图像的感兴趣区域内提取不同的CT影像组学特征。将入组患者划分为训练集(n=147)和验证集(n=63),通过LASSO及Logistic回归分析筛选并建立CHB患者肝纤维化的诊断模型;采用ROC曲线评价模型性能。结果" 提取的1227个定量影像特征参数通过LASSO降维筛选后共保留了23个具有预测性能的组学特征用于构建CHB患者肝纤维化诊断模型,训练集的曲线下面积、准确性、敏感度和特异度分别为0.851、0.789、0.792、0.735;验证集的曲线下面积、准确性、敏感度和特异度分别为0.774、0.733、0.751、0.703。结论" 通过CT影像组学特征辅助诊断CHB患者发生肝纤维化具有一定临床价值。
关键词:慢性乙型肝炎;肝纤维化;CT影像组学
Diagnostic value of CT imaging in hepatic fibrosis of chronic hepatitis B patients
HE Xiaolei, WANG Jun, WANG Yan
Radiological Imaging Center, Xinjiang Uygur Autonomous Region People's Hospital, Urumqi 830001, China
Abstract: Objective To evaluate the diagnostic value of CT imagomics in hepatic fibrosis in patients with chronic hepatitis B (CHB). Methods A total of 210 patients with CHB admitted to Xinjiang Uygur Autonomous Region People's Hospital from January to October in 2023 were selected as the study subjects. Patients were divided into non-fibrosis group (n=137) and fibrosis group (n=73). All patients underwent CT plain scan + enhanced scan. Shukun Radiomics V 94 software was used to extract different CT imagomics features from the region of interest of each CT image, including texture feature, shape feature, filter feature, density feature, etc. The enrolled patients were divided into training set (n=147) and validation set (n=63), and the diagnostic model of liver fibrosis in CHB patients was screened and established by LASSO and Logistic regression analysis. The performance of the model was evaluated using the ROC curve. Results After LASSO screening, 23 of the 1227 extracted quantitative image features were retained to construct the diagnostic model of liver fibrosis in CHB patients. The AUC, accuracy, sensitivity, and specificity of the training set were 0.851, 0.789, 0.792, and 0.735, respectively; The AUC, accuracy, sensitivity, and specificity of the validation set were 0.774, 0.733, 0.751, and 0.703, respectively. Conclusion The CT image-omics features show clinical significance in the assessment of liver fibrosis in patients with CHB.
Keywords: chronic hepatitis B; hepatic fibrosis; CT imagomics
慢性乙型肝炎(CHB)患者大多存在不同程度的肝纤维化,严重者可进展为肝硬化。广泛早期准确评估CHB患者肝纤维化状况有利于临床制定针对性干预措施控制肝纤维化进程,延缓疾病恶化[1] 。肝病理活检对于肝纤维化水平的诊断最准确,但因其侵入性限制了临床应用推广。近年来,无创影像学检查在多系统疾病的辅助诊断、病程评估中的作用逐渐凸显[2] 。CT是CHB的常用检查手段,常规CT的平扫及增强扫描可对肝脏形态的改变进行清晰观察,但对早期纤维化的评估意义不大[3, 4] 。而CT影像组学通过从CT不同模态影像图像中高通量提取大量疾病特征,挖掘病灶组织位置、大小、形态、局部血供、细胞外弥散等方面信息,并将其转化为定量数据,利于临床对相关疾病作出准确诊断[5] 。既往关于CT影像组学应用于辅助评估肝纤维化的研究较少,且既往研究纳入的病例数较少,可能对CT影像组学参数筛选产生一定偏移[6] 。同时,既往研究中对于筛选出的影像组学标签较局限,因此仍有待通过较大样本量临床研究对其诊断效能进行内外部验证[7, 8] 。基于此,本研究将CT影像组学用于CHB肝纤维化的诊断中,进一步探讨其诊断价值并筛选具有高预测效能的影像组学标签,旨在为提高CHB肝纤维化的无创诊断准确性提供参考。
1" 资料与方法
1.1" 一般资料
选取新疆维吾尔自治区人民医院于2023年1~10月收治210例CHB患者为研究对象。纳入标准:符合我国指南中CHB的诊断标准[9];年龄gt;18岁;CHB病程≥6月;入组前进行过肝穿刺活检;患者及家属均知情同意。排除标准:由于寄生虫感染或流行性出血热所致的肝炎、药物或酒精所致的肝损伤、自身免疫性肝炎等;伴有恶性肿瘤;合并结缔组织疾病。剔除标准:CT检查期间因患者紧张、咳嗽或仪器出现故障等各种原因导致检查中断,未获得完整的CT影像学图片;拒绝肝穿刺活检。本研究已通过本院伦理委员会审批(审批号:KY20221220426)。
入组的210例患者中无纤维化患者137例,合并纤维化患者73例(轻度纤维化42例、中重度纤维化31例),所有患者按照7:3比例随机分为训练集(n=147)与验证集(n=63),两数据集患者间性别、年龄、BMI、饮酒史、吸烟史、CHB家族史、CHB病程等一般临床资料的差异无统计学意义(Pgt;0.05)。其中,训练集中无纤维化患者97例,合并纤维化患者50例(轻度纤维化29例、中重度纤维化21例),无纤维化组患者和合并纤维化患者间性别、年龄、BMI、饮酒史、吸烟史、CHB家族史、CHB病程等一般临床资料的差异无统计学意义(Pgt;0.05)。验证集中无纤维化患者40例,合并纤维化患者23例(轻度纤维化13例、中重度纤维化10例),无纤维化组患者和合并纤维化患者间性别、年龄、BMI、饮酒史、吸烟史、CHB家族史、CHB病程等一般临床资料的差异无统计学意义(Pgt;0.05)。
1.2" 方法
1.2.1" 肝纤维化程度判定及分组" "所有患者均行超声引导下肝活检术,通过Ishak评分系统评价患者是否发生肝纤维化,划分为无纤维化组(即0期,患者肝内无纤维化或假小叶形成)和合并纤维化组。合并纤维化组进一步根据纤维化严重程度进行相应分组:轻度纤维化组:即1~3期,患者肝内存在汇管区纤维化,伴随纤维间隔≤3条;中重度纤维化组:即4~6期,患者肝内汇管区纤维化、桥接纤维化,伴或不伴假小叶形成。
1.2.2" CT影像组学特征" 所有患者行超声引导下肝活检术前均采用西门子SOMATOM 64层螺旋CT扫描仪进行检查。患者取仰卧位,深吸气后屏气进行平扫,扫描范围为膈顶至髂前上棘。设置扫描参数:管电流150~375 mA,管电压120 kV,层厚5 mm,层距5 mm,螺距1。平扫结束后,经周静脉注射造影剂碘海醇注射液[通用电气药业(上海)有限公司,国药准字H20000599,规格:100 mL:35g(I)],350 mg/kg,注射速度为3.5 mL/s,注射完毕后25~30 s、60~70 s、120~180 s分别进行动脉期、门静脉期及延迟期扫描。将CT扫描图像上传至Shukun Radiomics V94影像组学软件中,选择门静脉坐支层面,由2位工作经验10年以上的放射科医师分别对动脉期、门静脉期、延迟期图像中肝脏区域沿肝脏边缘进行单层二维手动勾画感兴趣区域(ROI),ROI距离肝脏边缘1~2 mm,尽可能避开大血管、胆管及病灶,避免容积效应的影响,并剔除层面内存在的局灶性小病变。应用Shukun Radiomics V94软件自每张CT图像的ROI内提取不同的CT影像组学特征,包括纹理特征、形状特征、滤波特征、密度特征等。所有提取的特征均采用最小-最大缩放算法进行归一化处理,公式为lt;d:\fit\202404030_赫晓磊-LL-2-2462\image1.pdfgt;,并使用主成分分析法对特征进行降维。
1.3" 统计学分析
影像组学特征的选择、建模及性能评估使用R3.5.3软件进行,采用SPSS25.0软件进行临床资料统计分析。正态分布的计量资料以均数±标准差表示,组间比较采用t检验;计数资料以n(%)表示,组间比较采用χ2检验。使用Logistic回归分析建立CT影像组学模型,使用ROC及AUC评价模型对CHB患者肝纤维化的诊断价值。使用Logistic回归分析将经过降维后的影像组学特征共同建立影像组学模型;绘制ROC及AUC评价训练集模型的性能,再使用验证集患者数据进行模型验证。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" CT影像组学模型构建
所有患者均提取1227个定量影像特征参数,经最大相关最小冗余去除冗余和不相关特征后保留了39个特征,通过LASSO将为分析后应用最小方差法保留了23个具有预测性能的组学特征(图1)。获取具有非零系数的特征及对应权重系数构建CT影像组学模型:Rad-score(x) = -0.0078 (wavelet-LHL_ngtdm_Coarseness) + 0.0675 (wavelet-LHH_glszm_SizeZoneNonUniformity) -0.0872 (lbp-3D-k_firstorder_Variance) -0.1009 (wavelet-LHL_gldm_SmallDependenceLowGrayLevelEmphasis) -0.0495 (lbp-3D-m1_firstorder_Variance) -0.0858 (wavelet-LLL_firstorderEntropy) -0.1002 (lbp-3D-m2_firstorder_Skewness) + 0.0723 (wavelet-LLH_glszm_GrayLevelNonUniformity Normalized) + 0.0304 (wavelet-LHH_glszm_Smal AreaEmphasis) -0.0808 (logarithm_ngtdm_Contrast) + 0.0373 (lbp-2D_firstorder_Median) + 0.0869 (wavelet-LHL glszm SmallAreaEmphasis) + 0.0453 (wavelet-LLL_firstorder_Minimum) -0.0986 (wavelet-HHL_glszm_GrayLevelNonUniformityNormalized) -0.062 (wavelet-LLL_glszm_ZoneEntropy) -0.1026 (wavelet-LLL_glcm_Correlation) + 0.1101 (wavelet-LHL_ngtdm_Strength) + 0.7081 (original_firstorder_Minimum) - 0.0135 (wavelet_LHH_glcm_ClusterShade) - 0.0312 (wavelet_HHH_glcm_Imc2) - 1.1038 (wavelet_LHH_firstorder_Skewness) + 0.1155 (wavelet_HHL_glszm_LargeAreaLowGrayLevelEmphasis) + 0.0161 (log_sigma_5_0_mm_3D_firstorder_RootMeanSquared) + 0.1021。
2.2" 训练集和验证集ROC-AUC曲线比较结果
用上述23个影像组学特征建立的CT影像组学预测模型,通过ROC曲线评价其在训练集和验证集中的效能,AUC分别为0.851和0.774,其中训练集准确性、敏感度和特异度分别为0.789、0.792、0.735,验证集准确性、敏感度和特异度分别为0.733、0.751、0.703(图2)。
3" 讨论
CHB患者发生肝纤维化虽然一定程度上可修复肝脏内慢性损伤,但也是患者向肝硬化及其他严重肝脏病变发展的关键步骤[10]。有研究认为肝脏组织具有较强的再生能力,当肝脏损伤因素消失时及肝细胞外基质降解时,肝纤维化程度会有所消退甚至回复正常结构[11]。肝活检组织病理学检查虽是肝纤维化诊断的“金标准”,但其安全性有待商榷[12];且该方法检查费用较高,检查时间较长,可重复操作性较低,难以作为常规检查项目在临床进行推广。影像学检查是CHB诊疗过程中不可或缺的一部分,其中CT检查因其客观可靠、定位准确、检查禁忌少、可重复性好等优点应用较多,可快速采集组织器官的连续图像,且所得图像的影响因素相对较少,能在最大限度上降低呼吸及运动伪影发生情况,准确获得病灶组织位置、性质、与周围组织关系等信息,增加检查结果的准确性,其在CHB诊断中的价值已被国内外诸多研究证实[13, 14]。但有研究指出CT成像对病毒感染性肝炎肝纤维化的阴性预测值仅为69.8%,预测价值较低[15]。因此,如何在传统CT检查基础上进一步挖掘图像特征以评估CHB患者肝纤维化发生与发展状况,对于临床精准医疗的开展、逆转肝纤维化进程并改善患者预后具有重要意义。
随着计算机硬件及软件技术的快速发展,影像组学逐渐成为临床研究的热点,可通过高通量挖掘定量图像特征更准确的描述疾病特点。其中CT影像组学能利用大数据分析的手段从现有的CT影像图像中快速、有效地提取大量无法被肉眼所识别的与疾病相关的微小定量特征,把目前的数字图像转换为可挖掘的高维数据,并通过不同的图像处理方法,从不同角度反映机体潜在的病理生理方面的信息,有利于临床更加精准地评估个体各方面的状况,并及时对疾病作出准确诊断[16]。同时,在CT影像组学信息基础上应用自动化、高通量的算法提取关键特征,将影像学特征转化为定量数据,在提高疾病诊断、治疗及预后评估中均具有巨大潜力[17]。本研究通过CT影像学提取了1227个定量影像特征参数,进一步通过LASSO降维筛选后共保留了23个具有预测性能的组学特征用于构建CHB患者肝纤维化诊断模型,训练集的AUC、准确性、敏感度和特异度分别为0.851、0.789、0.792、0.735,验证集的AUC、准确性、敏感度和特异度分别为0.774、0.733、0.751、0.703。分析原因,肝脏作为一种实质性器官,纤维化会使其内部发生实质性改变,CT影像组学的纹理特征可以揭示肝脏内部组织的结构和分布情况[18, 19]。通过选择适当的纹理特征分析方法并进行加权组合,可以有效评估和诊断CHB患者的肝纤维化程度,但选取的指标可能存在一定偏移或无法全面描述肝纹理特点[20, 21]。与本研究结果类似,有研究利用CT影像组学方法对肝细胞癌患者微血管侵犯情况进行预测,发现结合了大规模的影像学特征的CT影像组学预测肝细胞癌患者微血管侵犯方面表现出了良好的性能[22],本研究则是针对CHB的肝纤维化患者进行CT影像组学分析,拓展了影像组学的应用范围。另有研究则发现,基于PET-CT的影像组学模型相较于单纯临床数据更更好地预测可以准确预测肝内胆管癌手术切除后的预后情况[23]。以上结果均表明CT影像组学在肝细胞疾病中的重要预测价值。此外,CT影像组学是从常规CT影像图中筛选所需的定量特征,并通过特定软件处理得到的结果,无需进行额外的检查,不会增加患者检查费用,且不会较大地增加医师工作量,便于患者接受,易于临床推广[24]。
综上所述,基于CHB患者CT图像的影像组学方法对CHB肝纤维化程度具有一定诊断与评估价值。通过影像组学实现无创、准确评估CHB肝纤维化程度,可避免肝穿刺有创检查带来的不良影响,指导精准医疗的开展,为促进患者疾病转归提供帮助。本研究仅在单中心纳入符合纳入标准的CHB患者,最终入组样本量及各数据集患者病例数偏少,后期将通过样本量扩大进一步验证本研究结论的准确性和外延性。
参考文献:
[1]" "Stalla F, Armandi A, Marinoni C, et al. Chronic hepatitis B virus infection and fibrosis: novel non‑invasive approaches for diagnosis and risk stratification[J]. Minerva Gastroenterol, 2022, 68(3): 306-18.
[2]" " 崔" 凌, 郝敬军, 庄伟雄. 64排螺旋CT肝脏增强扫描对乙型肝炎肝硬化再生结节的诊断价值[J]. 中西医结合肝病杂志, 2021, 31(6): 548-51.
[3]" " 彭" 敏. 动态增强CT诊断肝细胞癌的影像表现及应用价值[J]. 现代诊断与治疗, 2021, 32(20): 3311-2.
[4]" " Zheng YL, Zhou D, Liu H, et al. CT-based radiomics analysis of different machine learning models for differentiating benign and malignant parotid tumors[J]. Eur Radiol, 2022, 32(10): 6953-64.
[5]" " 邢" 莉, 杜倩影, 姜艳丽, 等. 分段注射对比剂CT增强扫描提高乙型肝炎肝硬化患者肝静脉显影效果研究[J]. 实用肝脏病杂志, 2021, 24(6): 871-4.
[6]" "潘丽雅, 宋侨伟. 基于CT的全肝影像组学模型评价乙型肝炎肝纤维化分期的价值[J]. 浙江临床医学, 2023, 25(7): 975-7.
[7]" "Chen YQ, Gong J, Zhou WY, et al. A novel prediction model for significant liver fibrosis in patients with chronic hepatitis B[J]. Biomed Res Int, 2020, 2020: 6839137.
[8]" " 周" 莹, 陈" 娇, 叶" 龙, 等. CT测量肝外基质体积分数评估慢性乙型肝炎患者肝纤维化临床应用研究[J]. 实用肝脏病杂志, 2020, 23(4): 492-5.
[9]" " 中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 等. 慢性乙型肝炎基层诊疗指南(2020年)[J]. 中华全科医师杂志, 2021, 20(2): 137-49.
[10] Khanam A, Saleeb PG, Kottilil S. Pathophysiology and treatment options for hepatic fibrosis: can it be completely cured?[J]. Cells, 2021, 10(5): 1097.
[11]" Yang FW, Liu YJ, Zeng BM, et al. Noninvasive assessment of liver fibrosis for predicting acute‑on‑chronic liver failure in patients with chronic hepatitis B[J]. Hepatol Int, 2021, 15(3): 593-601.
[12] Demirtas CO, Brunetto MR. Surveillance for hepatocellular carcinoma in chronic viral hepatitis: is it time to personalize it?[J]. World J Gastroenterol, 2021, 27(33): 5536-54.
[13] Bourebaba N, Marycz K. Hepatic stellate cells role in the course of metabolic disorders development ‑A molecular overview[J]. Pharmacol Res, 2021, 170: 105739.
[14] Caligiuri A, Gentilini A, Pastore M, et al. Cellular and molecular mechanisms underlying liver fibrosis regression[J]. Cells, 2021, 10(10): 2759.
[15]" 任卫华, 李" 新, 雷一鸣, 等. 超声瞬时弹性成像技术与MSCT灌注成像对慢性乙肝肝纤维化的诊断价值[J]. 中国CT和MRI杂志, 2021, 19(12): 99-102.
[16]" Bütikofer S, Greutmann-Yantiri M, Gubler C, et al. Determinants of advanced liver fibrosis in adult patients after fontan palliation: usefulness of ultrasound transient elastography[J]. Can J Cardiol, 2023, 39(10): 1338-45.
[17]" 刘显旺, 刘" 宏, 邓靓娜, 等. 能谱CT基物质分离技术定量评估乙肝肝纤维化分期的价值[J]. 中国医学物理学杂志, 2022, 39(6): 701-4.
[18] Zhan J, Wang J, Zhang ZY, et al. Noninvasive diagnosis of significant liver inflammation in patients with chronic hepatitis B in the indeterminate phase[J]. Virulence, 2023, 14(1): 2268497.
[19]" 洪" 莹. 肝脏瞬时弹性成像技术联合血清无创诊断模型预判乙型肝炎患者肝纤维化程度的价值分析[J]. 现代实用医学, 2022, 34(12): 1562-4, 1681.
[20]" Gheorghe G, Bungău S, Ceobanu G, et al. The non-invasive assessment of hepatic fibrosis[J]. J Formos Med Assoc, 2021, 120(2): 794-803.
[21]" Wang F, Chen QQ, Zhang YY, et al. CT-based radiomics for the recurrence prediction of hepatocellular carcinoma after surgical resection[J]. J Hepatocell Carcinoma, 2022, 9: 453-65.
[22]" 韦武鹏, 覃云英, 廖" 海, 等. 术前CT影像组学预测肝细胞癌微血管侵犯[J]. 临床放射学杂志, 2021, 40(12): 2378-85.
[23]" Fiz F, Masci C, Costa G, et al. PET/CT-based radiomics of mass-forming intrahepatic cholangiocarcinoma improves prediction of pathology data and survival[J]. Eur J Nucl Med Mol Imaging, 2022, 49(10): 3387-400.
[24]" Hu P, Chen LY, Zhong YY, et al. Effects of slice thickness on CT radiomics features and models for staging liver fibrosis caused by chronic liver disease[J]. Jpn J Radiol, 2022, 40(10): 1061-8.
(编辑:林" 萍 )
