胃肠间质瘤根治术后5年的预后因素
2024-11-01何昌银李传明刘芸

摘要:目的" 分析胃肠间质瘤根治术后5年的预后因素,并建立生存预测模型以指导临床实践。方法" 回顾性分析2010年1月5日~2018年6月20日本院行根治术治疗的297例胃肠间质瘤患者的临床病理及CT资料,以5年为观察截止点,将患者分为无复发生存组(n=232)和死亡(或复发转移)组(n=65),联合有统计学意义的临床病理及CT特征,建立Logistic回归模型,并评价模型效能。结果" 临床病理特征与患者5年预后的关系:未辅助伊马替尼治疗、核分裂计数较高、高Ki-67指数的患者预后不佳的几率大,差异有统计学意义(Plt;0.05);而性别、年龄、消化道出血的差异无统计学意义(Pgt;0.05)。CT特征与5年预后的关系:两组患者部位、大小、破裂、是否有粗大的供血动脉或引流静脉等的差异有统计学意义(Plt;0.05);而生长方式、溃疡、钙化、上覆黏膜的一过性强化等的差异无统计学意义(Pgt;0.05);联合临床病理及CT特征的Logistic回归模型显示:部位、形态、大小、肿瘤破裂、肿瘤囊腔与肠管相通、核分裂像是5年预后的独立预测因素五,AUC为0.916,敏感度0.877,特异度0.802,正确率0.818。结论" 本研究建立了影响胃肠间质瘤根治术后5年预后的预测模型,该模型的预测性能好,为临床预后判断和评估提供了重要的依据。
关键词:胃肠间质瘤;无复发生存;预测模型
Prognostic factors for gastrointestinal stromal tumors after radical surgery for 5 years
HE Changyin, LI Chuanming, LIU Yun
Department of Imaging, Chongqing University Affiliated Central Hospital(The Fourth People's Hospital of Chongqing), Chongqing 400014, China
Abstract: Objective To analyze the prognostic factors of gastrointestinal stromal tumors after radical surgery for 5 years and establish a survival prediction model to guide clinical practice. Methods A retrospective analysis was conducted on the clinical, pathological, and CT data of 297 patients with gastrointestinal stromal tumors who underwent radical surgery at our Hospital from January 5, 2010 to June 20, 2018. With a 5-year observation cut-off point, they were divided into non recurrence survival group (n=232) and death or recurrence metastasis group (n=65). A Logistic regression model was established by combining statistically significant clinical, pathological, and CT features, and the model efficacy was evaluated. Results The relationship between clinical pathological characteristics and 5-year prognosis of patients: Patients without adjuvant imatinib treatment, with high mitotic count, and high Ki-67 index have a higher probability of poor prognosis within 5 years, and the difference was statistically significant (Plt;0.05); However, gender, age, and gastrointestinal bleeding had no statistically significant difference in 5-year prognosis (Pgt;0.05). The relationship between CT features and 5-year prognosis: There were statistically significant differences between the two groups in terms of location, shape, size, cystic change or necrosis, rupture, bleeding, tumor with cystic lumen communicating with the intestinal canal, is there a large blood supply artery or drainage vein, venous phase and delayed phase enhancement methods (Plt;0.05); However, there was no statistically significant difference in growth mode, ulcer, calcification and transient enhancement of the overlying mucosal line (Pgt;0.05); Logistic regression combining clinical pathology and CT features: Tumor location, morphology, size, tumor rupture, tumor sac to intestinal communication, and mitotic imaging were independent predictors of 5-year prognosis. The AUC was 0.916, sensitivity was 0.877, specificity was 0.802, and accuracy was 0.818, all of which were higher than the subjective predictions of two radiologists. Conclusion This study established a predictive model that affects the 5-year prognosis of gastrointestinal stromal tumors after radical surgery. The predictive performance of this model is good, providing important basis for accurate judgment and evaluation of the 5-year prognosis of gastrointestinal stromal tumors in clinical practice.
Keywords: gastrointestinal stromal tumor; recurrence-free survival; prediction model
胃肠间质瘤(GIST)是胃肠道最常见的间叶源性肿瘤,起源于Cajal间质细胞[1],最常见的好发部位是胃,其次是小肠、结肠和直肠。GIST具有恶性潜能,完整的手术切除是治疗非转移性GIST的最佳方法[1],然而术后30%~40%的中高风险GIST患者仍会出现肿瘤复发或死亡[2]。肿瘤大小、核分裂像、肿瘤部位以及肿瘤破裂等因素与患者预后有关[3],也有文献报道肿瘤的形态学CT征象以及伊马替尼的辅助治疗能影响患者的无复发生存期[4-6]。既往关于GIST预后的研究大多集中在中高风险,有学者通过肿瘤大小、MC和Radscore建立Nomogram图预测中高危GIST的预后[7],有研究开发了一个基于动脉CT成像深度学习的预后模型,取得了较好的效果[8];但关于低风险GIST的预后研究均为个案报道,有研究报道了1例低危十二指肠间质瘤术后发生了肝转移[9],有研究发现1例空肠低危间质瘤切除术后复发并转移[10]。实际临床工作中即使肿瘤缺乏经典病理学恶性性质的形态学特征,也不存在绝对良性的GIST[11]。所以,低估复发风险可能会对无复发生存产生负面影响;低风险的患者可能通过手术治愈,减少毒副作用和不必要的辅助治疗[12]。本研究搜集不同危险等级的GIST,通过分析患者的临床病理和CT资料,旨在分析根治术后5年的预后因素,建立术后5年预后的预测模型,并将该模型与不同工作经验的放射科医生的主观预测进行比较,为临床对GIST根治术后5年生存情况及预后评估提供依据。
1" 资料与方法
1.1" 一般资料
回顾性纳入2010年1月~2018年6月重庆大学附属中心医院(重庆市第四人民医院)行根治性手术治疗的297例胃肠间质瘤患者的临床病理及CT资料,分成无复发生存组(n=232)和死亡/复发转移组(n=65)。纳入标准:经病理证实的GIST患者,接受根治性手术;临床、病理及影像学资料完整;均为原发GIST,且术前未接受其他方式治疗。排除标准:术前及CT检查前接受过抗肿瘤治疗;合并其他恶性肿瘤;病理、免疫组化或影像学资料不完整。368例GIST患者中成功随访297例,失访71例,随访率80.7%,随访时间2~135月。297例患者中,男性139例,女性158例,发病年龄57.57±13.07岁。本研究为回顾性研究,经重庆大学附属中心医院(重庆市第四人民医院)伦理委员会批准。
1.2" 观察指标及随访
观察指标包括临床资料(年龄、性别、消化道出血、术后伊马替尼治疗等)、病理免疫学资料(核分裂象计数:≤5、6~10、gt;10)[3]、Ki-67指数(≤8%、gt;8)[13]、CT资料[部位、形态、大小、生长方式、囊变或坏死、溃疡、钙化、破裂、出血、是否有囊腔与肠管相通、是否有粗大的供血动脉或引流静脉(EVFDM)、上覆黏膜的一过性强化(HYOM)、静脉期或延迟期强化方式等]、预后情况(5年复发生存情况),CT征象观察由2位经验丰富的高年资主治医生完成,意见不统一时由另一位主任医师确认。
随访资料通过门诊就诊及电话获取,观察时间以首次在本院行手术治疗为起点,以5年为观察截止时间点,转归包括无复发生存和死亡(或复发转移)。
1.3" 放射科医生参与预测
由2位分别具有5年、20年胃肠肿瘤放射诊断经验的医生根据CT征象对GIST 5年预后进行预测。放射科医生参与观察的原因:放射科医生通常是发现GIST的第一人,大部分GIST(尤其是小肠)往往是通过CT检查发现;许多GIST患者术后通过CT检查进行随访,放射科医生经过长期动态观察,积累了丰富的经验,对疾病的发展有客观的判断。
1.4" 统计学分析
采用R4.2.2对数据进行处理与分析。服从正态分布的计量资料以均数±标准差表示,组间比较采用t检验,不服从正态分布时以中位数及四分位数表示,组间比较采用秩和检验;计数资料以n(%)表示,组间比较采用卡方检验或Fisher确切概率法。
基于预后独立危险因素研究:首先基于单因素Logistic回归分析,以预后为因变量,筛选出结局事件的可能预测因子(Plt;0.05);进一步针对筛选出的变量,进行多因素Logistic回归(逐步法,双向)探索独立预测因子,以多因素Logistic回归结果为最佳模型;基于该最佳模型通过ROC曲线分析,计算曲线下面积(AUC)、敏感度、特异度等指标,评估其鉴别效能。以模型为参考组,比较2位放射科医生的预测表现。以Plt;0.05为差异有统计学意义。
2" 结果
2.1" 一般情况及临床病理资料比较
单因素分析显示伊马替尼辅助治疗、核分裂像、Ki-67指数的差异有统计学意义(Plt;0.001),其他指标的差异无统计学意义(Pgt;0.05,表1)。
2.2" 两组GIST患者的CT表现与预后的关系
两组CT特征单因素对比结果显示,两组患者在部位、形态、大小、囊变或坏死、破裂、出血、肿瘤有囊腔与肠管相通、EVFDM、静脉期及延迟期强化方式的差异有统计学意义(Plt;0.05);而生长方式、溃疡、钙化、HYOM的差异无统计学意义(Pgt;0.05,表2)。
2.3" 结合临床病理和CT特征的Logistic回归分析
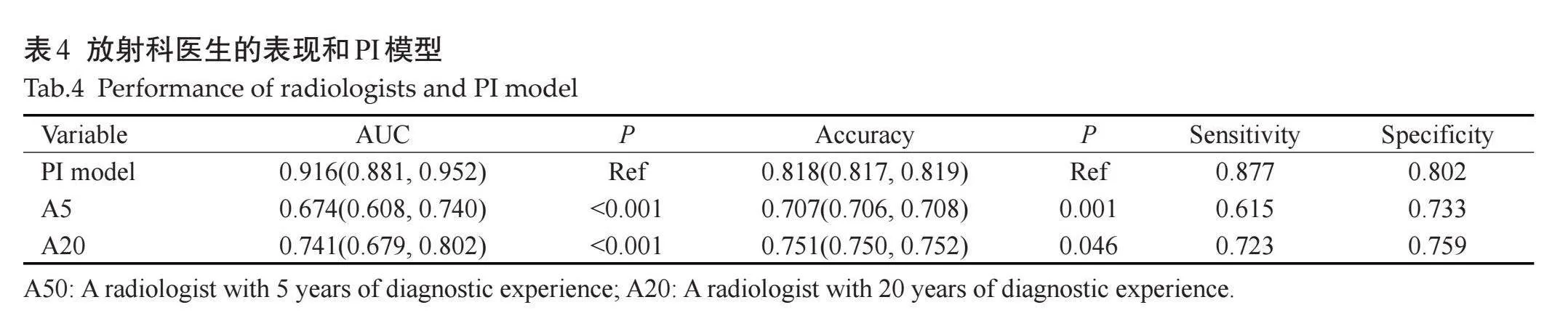
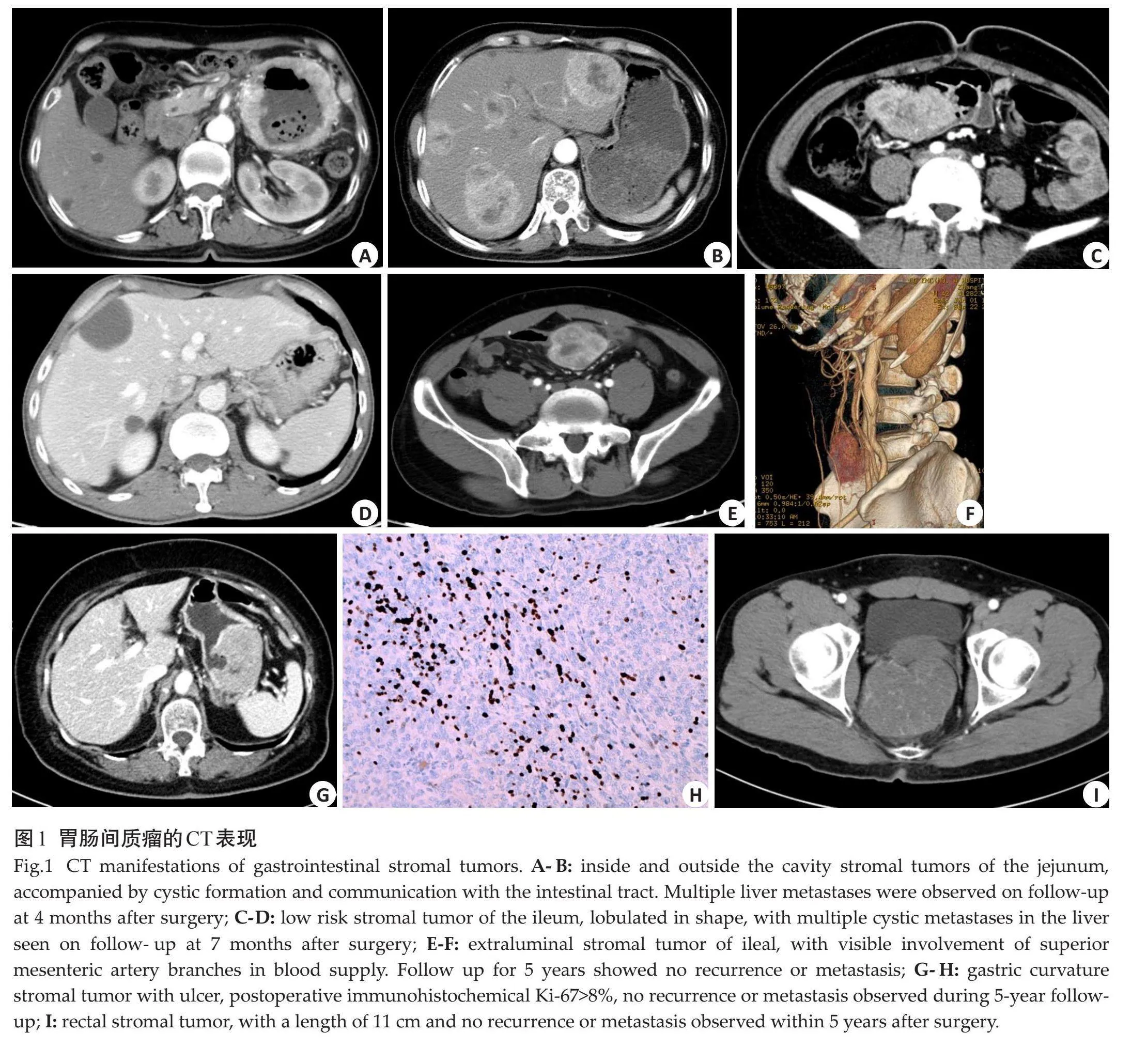
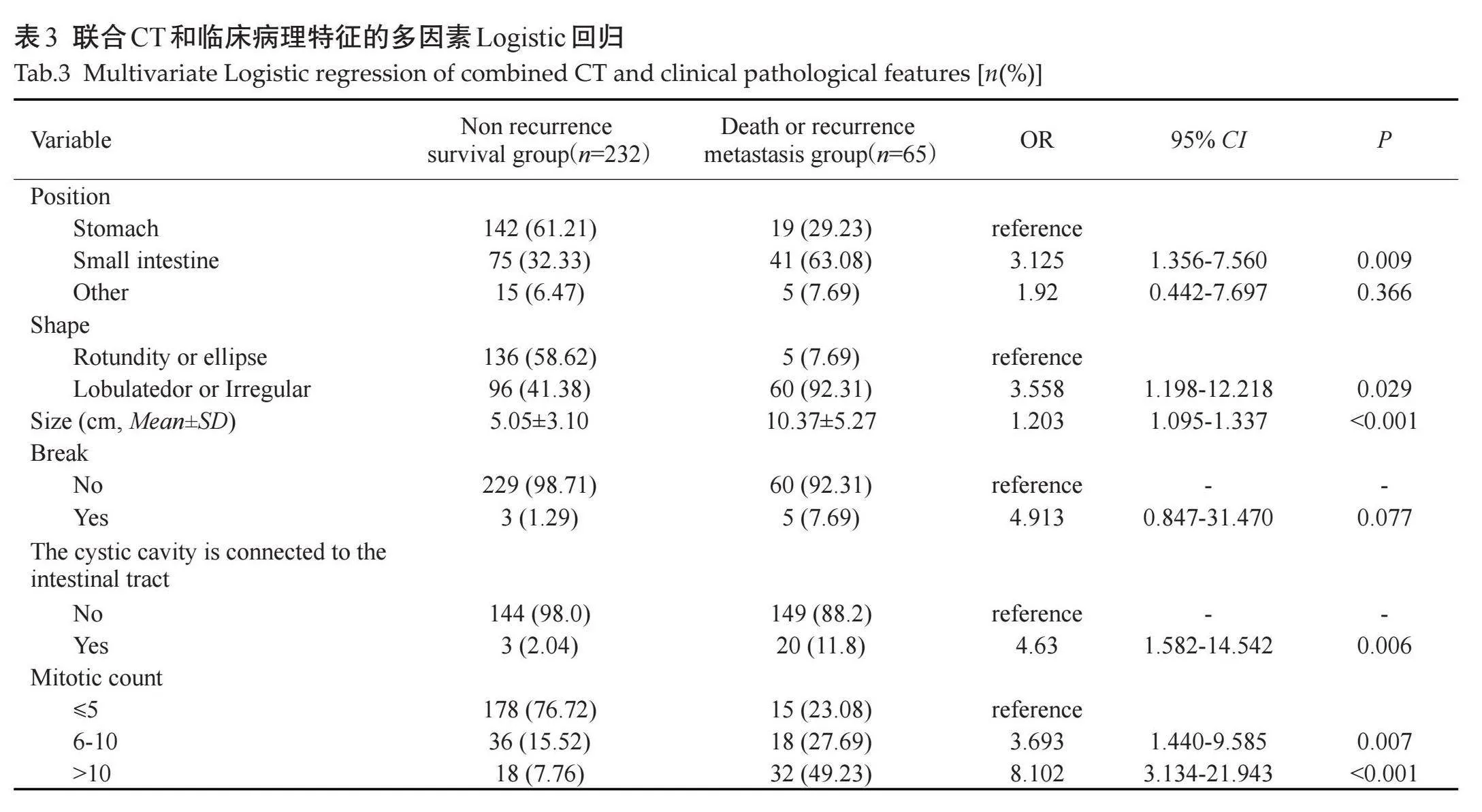
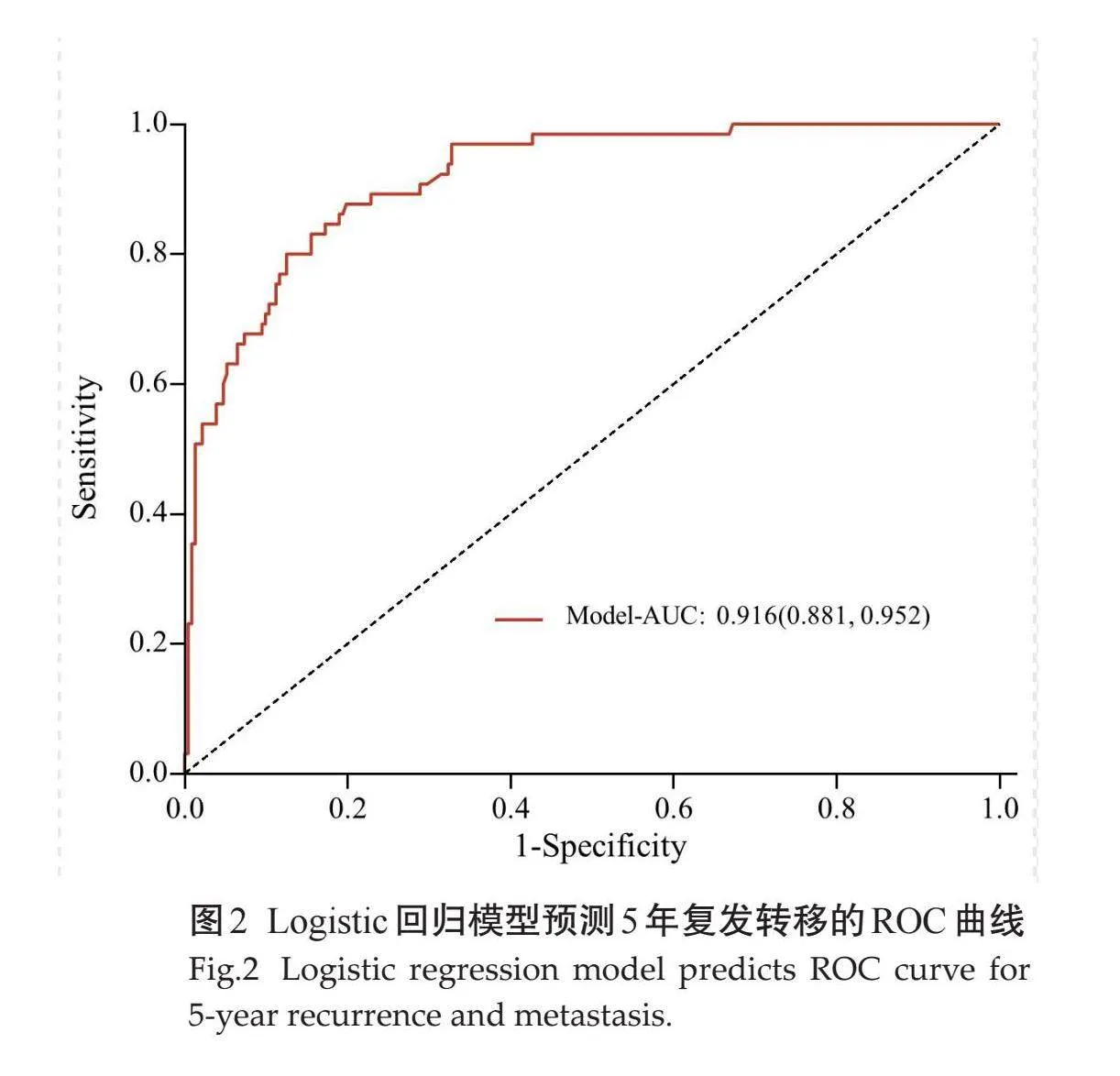
通过单因素分析比较差异有统计学意义的变量(伊马替尼、核分裂像、Ki-67指数、部位、形态、大小、囊变或坏死、破裂、出血、肿瘤有囊腔与肠管相通、EVFDM、静脉期及延迟期强化方式)纳入多因素Logistic回归,最终纳入6个因素,部位、形态、大小、肿瘤破裂、肿瘤囊腔与肠管相通、核分裂像(图1)是影响预后的独立预测因素(表3)。构建ROC曲线,Logistic回归预测模型的ROC曲线AUC为0.916(95% CI:0.881~0.952),模型预测价值较高,敏感度为0.877,特异度为0.802,准确率为0.818(图2)。
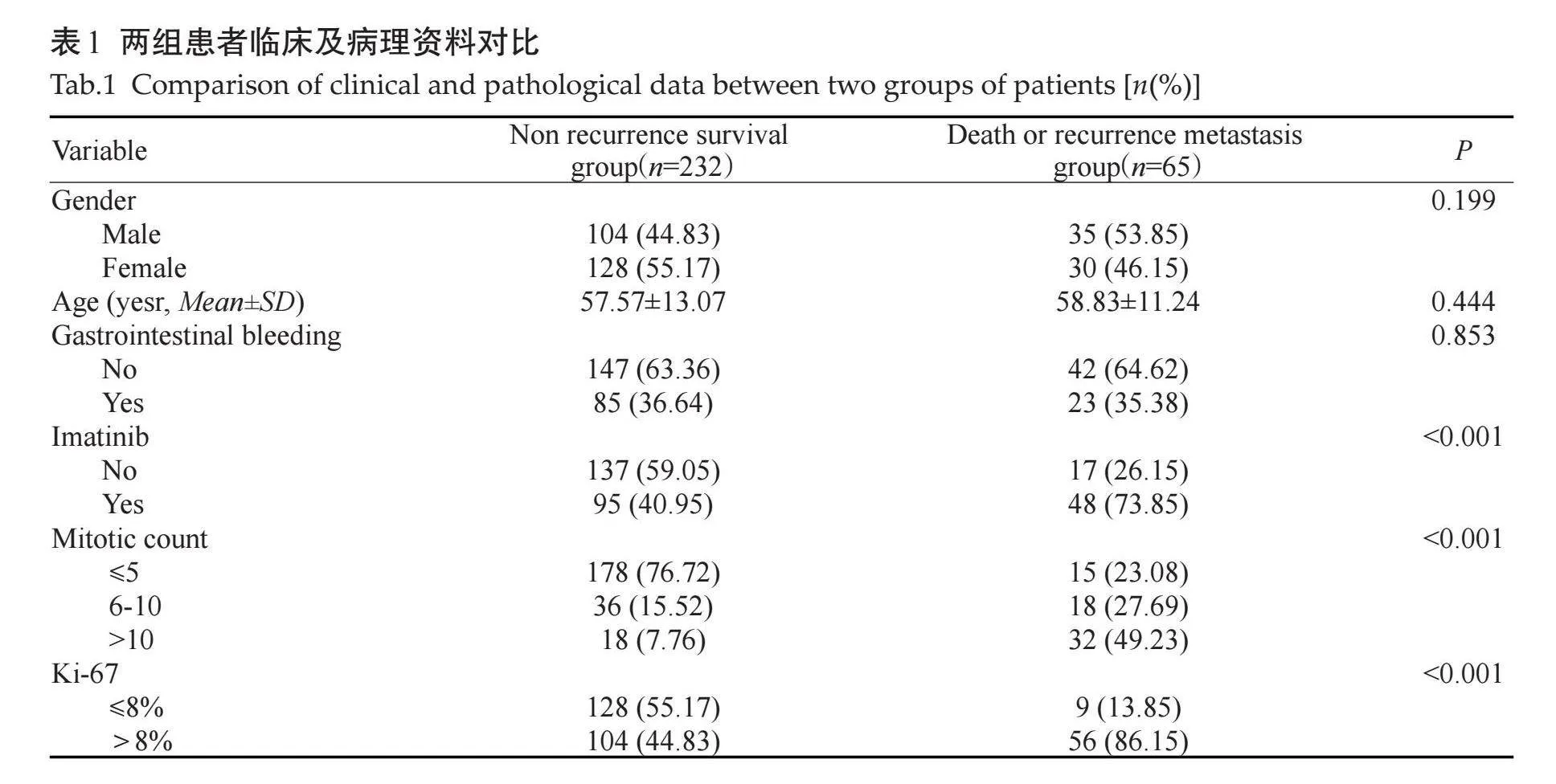
2.4" 放射科医生预测5年复发生存率
有20年诊断经验的放射科医生在预测复发转移方面的表现比5年经验的放射医生表现好,准确率更高,但低于PI模型(表4)。
3" 讨论
GIST是潜在恶性肿瘤,术后易复发转移且死亡率较高,所以无复发生存情况受到临床关注[14-15],既往有部分研究预测中高危GIST术后复发转移情况[9],本研究纳入所有风险级别GIST,通过整合临床病理资料及个体化CT特征,得出预测因子、建立PI 模型,同时将本研究的模型与不同年资的放射医生的主观预测进行对比,本研究的预测模型诊断准确率显著高于人为预测。
目前关于GIST的研究大多还是集中在危险分级及核分裂像上[11, 12, 16-19],近几年有学者开始关注Ki-67阳性表达的预测[13, 20-24]、对比增强CT图像与KIT外显子11基因突变的关联[25],然而关于GIST预后的研究较少。有研究将肿瘤大小、部位、有丝分裂计数、肿瘤破裂和Ki-67指数纳入Cox模型构建Nomogram,5年预测概率的AUC为0.778[26]。有研究通过肿瘤大小、有丝分裂计数、性别、DOG-1和伊马替尼辅助治疗建立Nomogram,5年预测概率的AUC为0.869[27];也有研究通过肿瘤大小、MC和Radscore建立Nomogram图,5年预测概率的AUC为0.80[9]。本研究通过筛选临床病理特征、CT征象建立的模型,AUC达0.916,高于目前已知的其他模型。
临床上认为GIST根治术后5年没有出现复发转移,即为临床治愈[28-29],所以本研究将时间截点选定为5年。在实际随访中,最长时间为135月;其中有1例患者1.5月出现肝脏转移,有3例患者超过5年出现肝脏或腹膜转移,时间分别是66、73、103月。在本研究的临床病理因素分析中,年龄、性别对5年预后没有影响。既往文献报道消化道出血是肿瘤破裂的另一种形式,即由黏膜浸润引起的局部黏膜缺血性坏死或肿瘤挤压引起的胃肠道出血[30],从而影响预后,本研究显示消化道出血对5年预后没有影响。伊马替尼是现代GIST靶向治疗的典范[5-6],在单因素分析中,伊马替尼能直接影响肿瘤预后,但在多因素分析中并未被纳入独立预测因素,分析可能是纳入样本中即使低风险间质瘤没有接受伊马替尼,术后预后也良好。核分裂像在GIST风险性分级中有举足轻重的作用[3],在本研究中也作为GIST预后的独立预测因素。Ki-67在许多研究中被认为是一个比核分裂像更能准确预测肿瘤增殖的指标[13, 21-24],但在本研究中重要性低于核分裂像。
本研究分析了CT征象与患者5年预后的关系,发现影响肿瘤预后的因素有肿瘤部位、形态、大小、囊变或坏死、破裂、出血、肿瘤有囊腔与肠管相通、EVFDM、静脉期及延迟期强化方式,其中肿瘤部位、形态、大小、肿瘤破裂、肿瘤囊腔与肠管相通是影响预后的独立预测因素。肿瘤部位是影响GIST危险分级的直接因素,位于胃的间质瘤危险性低于其他部位[3],本研究显示,位于小肠和胃肠道外的GIST比其他部位更容易发生复发转移,7例患者肿瘤位于结肠、直肠,即使肿瘤较大,5年内也没有发生复发转移。有学者发现形状可能是肿瘤的变异来源[31],不规则肿瘤形状是影响预后的负面因素,有研究量化了肿瘤形态[16],证实了这一点。肿瘤大小直接提示肿瘤细胞的生长,肿瘤越大、危险程度越高,说明肿瘤的侵袭行为更重,本研究提示肿瘤越大,患者的5年无复发生存率越低,与既往研究一致[9, 13, 22, 23]。肿瘤破裂后肿瘤细胞容易播散至邻近器官或者整个腹腔[3],影响预后。肿瘤囊腔与肠管相通,并容易形成气-液平,肿瘤可以直接侵犯相通的肠管,同时这种现象可能是巨大溃疡的另一种表现形式,容易发生肿瘤的播散,与前期研究[32]一致。
本研究将PI模型与放射科医生的人为预测进行比较,模型的准确性最高,低年资主治医师的准确性最低,这反映了专家做出准确预测的难度,同时体现了本研究模型的价值,为制定临床决策和预后评估提供了重要的依据。
但本研究有一定的局限性:本研究是回顾性研究,选择偏倚不可避免,需要一项前瞻性的、大样本量的多中心临床试验来证实本研究的结果;由于部分基因检测结果缺乏数据,本研究无法进一步研究5年预后与GIST基因表达的关系。
综上所述,本研究回顾性分析了GIST的临床病理资料、CT征象及其预后情况,根据肿瘤部位、形态、大小、肿瘤破裂、肿瘤囊腔与肠管相通、核分裂像建立预测模型,并对该模型进行评价,其预测水平及预测价值高于放射科医生的定性诊断,具有前瞻性,对于那些被模型判断为术后5年预后不佳的高危患者,为其在提高生存率和改善预后的治疗方法的选择与改进上提供新思路。
参考文献:
[1]" "Mantese G. Gastrointestinal stromal tumor: epidemiology, diagnosis, and treatment[J]. Curr Opin Gastroenterol, 2019, 35(6): 555-9.
[2]" "赵" 敏, 罗和生. 基于国内外指南和专家共识的胃肠道间质瘤的治疗进展[J]. 胃肠病学和肝病学杂志, 2022, 31(12): 1326-30.
[3] Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008, 39(10): 1411-9.
[4]" "Wei SC, Xu L, Li WH, et al. Risk stratification in GIST: shape quantification with CT is a predictive factor[J]. Eur Radiol, 2020, 30(4): 1856-65.
[5]" "Joensuu H, Eriksson M, Sundby Hall K, et al. Survival outcomes associated with 3 years vs 1 year of adjuvant imatinib for patients with high‑risk gastrointestinal stromal tumors: an analysis of a randomized clinical trial after 10-year follow-up[J]. JAMA Oncol, 2020, 6(8): 1241-6.
[6]" "Raut CP, Espat NJ, Maki RG, et al. Efficacy and tolerability of 5-year adjuvant imatinib treatment for patients with resected intermediate‑or high‑risk primary gastrointestinal stromal tumor[J]. JAMA Oncol, 2018, 4(12): e184060.
[7]" "Wang FH, Zheng HL, Li JT, et al. Prediction of recurrence-free survival and adjuvant therapy benefit in patients with gastrointestinal stromal tumors based on radiomics features[J]. La Radiol Med, 2022, 127(10): 1085-97.
[8]" "Chen T, Liu SQ, Li Y, et al. Developed and validated a prognostic nomogram for recurrence-free survival after complete surgical resection of local primary gastrointestinal stromal tumors based on deep learning[J]. EBioMedicine, 2019, 39: 272-9.
[9]" "Inoue M, Shishida M, Watanabe A, et al. A liver metastasis 7 years after resection of a low-risk duodenal gastrointestinal stromal tumor[J]. Clin J Gastroenterol, 2021, 14(5): 1464-9.
[10] Kanda T, Naito T, Wakai A, et al. Late recurrence of low-risk gastrointestinal stromal tumor of jejunum diagnosed 30 years after tumor resection: a case report and literature review[J]. Oncol Lett, 2022, 25(2): 50.
[11] Wang MH, Feng Z, Zhou LX, et al. Computed-tomography-based radiomics model for predicting the malignant potential of gastrointestinal stromal tumors preoperatively: a multi-classifier and multicenter study[J]. Front Oncol, 2021, 11: 582847.
[12] Chen ZH, Xu LY, Zhang CM, et al. CT radiomics model for discriminating the risk stratification of gastrointestinal stromal tumors: a multi-class classification and multi-center study[J]. Front Oncol, 2021, 11: 654114.
[13] Zhao YL, Feng MB, Wang MH, et al. CT radiomics for the preoperative prediction of Ki67 index in gastrointestinal stromal tumors: a multi-center study[J]. Front Oncol, 2021, 11: 689136.
[14] Wu X, Li J, Xu W, et al. Postoperative imatinib in patients with intermediate risk gastrointestinal stromal tumor[J]. Future Oncol, 2018, 14(17): 1721-9.
[15] Lin Y, Wang M, Jia J, et al. Development and validation of a prognostic nomogram to predict recurrence in high‑risk gastrointestinal stromal tumour: a retrospective analysis of two independent cohorts[J]. EBioMedicine, 2020, 60: 103016.
[16] Li HL, Ren G, Cai R, et al. A correlation research of Ki67 index, CT features, and risk stratification in gastrointestinal stromal tumor[J]. Cancer Med, 2018, 7(9): 4467-74.
[17] Liu MJ, Bian J. Radiomics signatures based on contrast-enhanced CT for preoperative prediction of the Ki-67 proliferation state in gastrointestinal stromal tumors[J]. Jpn J Radiol, 2023, 41(7): 741-51.
[18]" 董婷宇, 刘" 峰, 汤林梦, 等. 增强CT影像组学术前预测胃肠道间质瘤危险度分级的价值[J]. 中国医学影像学杂志, 2022, 30(1): 66-71.
[19]" Jia XX, Wan LJ, Chen XS, et al. Risk stratification for 1‑to 2-cm gastric gastrointestinal stromal tumors: visual assessment of CT and EUS high-risk features versus CT radiomics analysis[J]. Eur Radiol, 2023, 33(4): 2768-78.
[20]" 王学东, 刘爱连, 田士峰, 等. 单源双能CT能谱分析定量参数预测胃间质瘤Ki-67表达的可行性研究[J]. 放射学实践, 2020, 35(7): 893-9.
[21]" Li J, Wang AR, Chen XD, et al. Ki67 for evaluating the prognosis of gastrointestinal stromal tumors: a systematic review and meta-analysis[J]. Oncol Lett, 2022, 23(6): 189.
[22] Yang CW, Liu XJ, Zhao L, et al. Preoperative prediction of gastrointestinal stromal tumors with high Ki-67 proliferation index based on CT features[J]. Ann Transl Med, 2021, 9(20): 1556.
[23] Zhang QW, Gao YJ, Zhang RY, et al. Personalized CT‑based radiomics nomogram preoperative predicting Ki-67 expression in gastrointestinal stromal tumors: a multicenter development and validation cohort[J]. Clin Transl Med, 2020, 9(1): 12.
[24] Liu Y, He CY, Fang WD, et al. Prediction of Ki-67 expression in gastrointestinal stromal tumors using radiomics of plain and multiphase contrast-enhanced CT[J]. Eur Radiol, 2023, 33(11): 7609-17.
[25] Palatresi D, Fedeli F, Danti G, et al. Correlation of CT radiomic features for GISTs with pathological classification and molecular subtypes: preliminary and monocentric experience[J]. Radiol Med, 2022, 127(2): 117-28.
[26] Chen T, Xu LL, Ye LY, et al. A new nomogram for recurrence-free survival prediction of gastrointestinal stromal tumors: comparison with current risk classification methods[J]. Eur J Surg Oncol, 2019, 45(6): 1109-14.
[27] Ran P, Tan T, Zhou H, et al. Nomogram for predicting recurrence-free survival of primary localized gastrointestinal stromal tumor[J]. J Pers Med, 2023, 13(3): 498.
[28] Ettinger DS, Wood DE, Aisner DL, et al. Non-small cell lung cancer, version 3.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(5): 497-530.
[29] Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040[J]. J Hepatol, 2022, 77(6): 1598-606.
[30] Huang YQ, Zhao R, Cui YP, et al. Effect of gastrointestinal bleeding on gastrointestinal stromal tumor patients: a retrospective cohort study[J]. Med Sci Monit, 2018, 24: 363-9.
[31] Zanoni M, Piccinini F, Arienti C, et al. 3D tumor spheroid models for in vitro therapeutic screening: a systematic approach to enhance the biological relevance of data obtained[J]. Sci Rep, 2016, 6: 19103.
[32]" 何昌银, 李传明, 方维东, 等. 胃肠间质瘤临床及CT特征在预测Ki-67表达中的价值[J]. 放射学实践, 2023, 38(7): 920-4.
(编辑:郎" 朗)
