乳杆菌在胆盐 MRS 培养基中的传代稳定性
2024-05-16徐凡张臣臣潘丽娜康文丽汪家琦李威黄玉军
徐凡,张臣臣,潘丽娜,康文丽,汪家琦,李威,黄玉军*
(1.扬州大学食品科学与工程学院,江苏省乳品生物技术与安全控制重点实验室,江苏扬州 225127)(2.澳优乳业(中国)有限公司,人体微生态制品湖南省工程研究中心,湖南长沙 410017)
乳酸菌是利用糖类发酵且主要产物为乳酸的一类革兰氏阳性、无芽孢、厌氧生长的细菌总称,人类一直食用利用乳酸菌发酵的食品,而关于乳酸菌的研究大大促进了发酵乳制品行业的发展。乳酸菌是人体常驻菌种,能够调整肠道菌群、免疫调节、预防和治疗胃肠道疾病和呼吸道疾病[1-3]。Li 等[4]发现一株分离自人乳的鼠李糖乳杆菌SHA113 具有治疗多耐药大肠杆菌感染和调节肠道菌群平衡的潜力。Shin 等[5]从婴儿粪便中分离出一株干酪乳杆菌IDCC 3451,并对其基因组特性和安全性进行相关表征,发现其作为一种安全的益生菌菌株可用于食品。
微生物在经过连续传代后容易发生退化,遗传稳定性也会发生改变,引起生理生化方面的改变,从而使菌株的质量发生变化,不能保证。乳杆菌作为连续使用的产业化菌种应该具有优秀的益生功能同时具有良好的遗传稳定性,保证菌株在连续生产过程中保持初始的优良品质,所以对乳杆菌的稳定性研究是有必要[6]。乳酸菌要发挥益生作用,必须能够在人体胃肠道中胃酸和胆汁等不良环境中保证存活[7-10],正常人体的小肠胆盐含量在0.03%~0.3%之间[11],菌株进入小肠后能够耐受一定的胆盐浓度是能否成功定植和代谢活动的前提[12]。
植物乳杆菌属于乳杆菌属,厌氧或兼性厌氧,该菌与其他乳酸菌的不同之处在于植物乳杆菌的活菌数比较高,能大量产酸,而且产出的酸性物质能够降解重金属[13]。研究发现植物乳杆菌ATCC202195 联合低聚果糖可预防婴儿败血症[14]。戊型乳杆菌素多具耐热性高、分子质量小、在酸性或弱碱性条件下稳定的特点[15],具有广泛的抑菌谱并且对一些食品致病菌具有较强的抑制作用[16],对于食品和制药工业都具有重要意义。
植物乳杆菌M547、M621、M748、戊型乳杆菌M750 是扬州大学品生物技术与安全控制重点实验室筛选来自于母乳和婴儿粪便的4 株乳杆菌。婴儿肠道内的菌群与母体的菌群具有垂直联系,相比其他来源的益生菌,母婴来源的益生菌更加安全,且具有更好的益生功能[17,18]。目前市面上常见的低温乳制品的保质期通常在15~30 d 左右。本文以胆盐耐受能力为核心,研究胆盐添加对其30 代遗传稳定性的影响,为新型菌株的开发提供重要依据。
1 材料和方法
1.1 材料与试剂
植物乳杆菌M547(Lactiplantibacillus plantarunM547)、植物乳杆菌M621(Lactiplantibacillus plantarunM621)、植物乳杆菌M748(Lactiplantibacillus plantarunM748)、戊型乳杆菌M750(Lactiplantibacillus pentosus M750),由江苏省乳品生物技术与安全控制重点实验室分离自湖南地区健康女性的母乳。
胃蛋白酶(1:10 000),生工生物工程(上海)股份有限公司;牛胆盐,北京索莱宝科技有限公司;MRS 肉汤,海博生物技术有限公司。
人工胃液:0.5%(质量分数)NaCl,0.3%(质量分数)胃蛋白酶(1:10 000),用1 mol/L 的HCl溶液调节pH 值至2.5。
MRS 培养基(g/L):蛋白胨10,牛肉浸粉8,酵母浸粉4,葡萄糖20,磷酸氢二甲2,柠檬酸氢二铵2,乙酸钠5,硫酸镁0.2,硫酸锰0.01,吐温-80。
0.02%胆盐MRS:MRS 培养基添加0.02%(质量分数)胆盐;0.04%胆盐MRS:MRS 培养基添加0.04%(质量分数)胆盐;0.06%胆盐MRS:MRS培养基添加0.06%(质量分数)胆盐。
1.2 仪器设备
BXP-16 恒温培养箱,上海力辰邦仪器科技有限该公司;SW-CJ-1FD 型超净台,苏州净化设备有限公司;FP-110-C 型全自动生长曲线分析仪,芬兰Bioscreen 公司;JF-SX-500 全自动灭菌锅,日本TOMY 公司;FE20 pH 计,梅特勒-托利多仪器有限公司;SPX-150BSH 型生化箱,上海新苗医疗器械制造有限公司。
1.3 实验方法
1.3.1 菌株的活化、纯化和培养
将M547、M621、M748、M750 的第一代菌株活化后在MRS 固体培养基上划线培养,37 ℃培养48 h 后挑取单菌落,并接种于MRS 液体培养基中37 ℃培养24 h。
1.3.2 菌株的传代
将0 代菌株按体积分数为3%接种量进行长期连续传代培养至30 代,每代的传代周期为24 h。
1.3.3 耐胆盐能力传代稳定性的测定
离心收集菌体,用灭菌的PBS 缓冲液将菌体洗涤2 次后悬浮,取1.0 mL 的菌悬液接种至9.0 mL的0.1%胆盐的MRS 培养基中,37 ℃培养3 h,分别在0 h 和3 h 用平板计数法测定活菌数,存活率公式如公式(1)所示。每组重复3 次。每5 代进行一次测定。
式中:
α——耐胆盐能力(存活率),%;
N0——0 h 时的活菌数,CFU;
N1——胆盐中培养3 h 后的活菌数,CFU。
1.3.4 生长曲线绘制
将菌株按3%的接种量分别接种到MRS 培养基、0.02%胆盐培养基、0.04%胆盐培养基、0.06%胆盐培养基中,并采用微生物自动生长曲线分析仪测定24 h 生长情况。
1.3.5 菌株胆盐培养的耐胆盐能力测定
离心收集菌体,用灭菌的PBS 缓冲液将菌体洗涤2 次后悬浮,取1.0 mL 的菌悬液接种至9.0 mL接种至0.1%胆盐的MRS 培养基中,37 ℃培养3 h,分别在0 h 和3 h 用平板计数法测定活菌数,存活率公式如公式(1)所示。每组重复3 次。每5 代进行一次测定。
1.3.6 培养液pH 值传代稳定性的测定
在菌株培养到5、10、15、20、25、30 代时,使用pH 计测定24 h 培养液的pH 值。
1.3.7 耐酸能力传代稳定性的测定
离心收集菌体,用灭菌的PBS 缓冲液将菌体洗涤2 次后悬浮,取1.0 mL 的菌悬液接种至9.0 mL的pH 值2.5 人工胃液中,37 ℃培养3 h,分别在0 和3 h 利用平板计数法测定活菌数,存活率计算公式如公式所示。每组重复3 次。每5 代进行一次测定。
式中:
β——耐酸能力(存活率),%;
N0——0 时的活菌数,CFU;
N2——人工胃液中培养3 h 后的活菌数。
1.3.8 数据分析
试验所得数据为3 次重复试验结果的平均值并利用SPSS 进行显著性分析,利用Origin 进行绘图。
2 结果与分析
2.1 菌株的耐胆盐传代稳定性
由图1 可知,菌株M547、M621、M748、M750在0.1 wt.%胆盐下的耐胆盐稳定性存在差异,总体呈下降趋势。其中M748 和M750 的下降更为明显。胆盐对菌株的细胞具有毒害作用,作用于细胞膜和DNA,影响细胞的正常代谢和遗传。菌株的耐胆盐机制主要分为胆盐水解酶的作用、应激蛋白作用和细胞膜的作用[19]。母婴源乳酸菌具有对高浓度胆盐耐受能力差的特点,高浓度的胆盐改变了细胞膜的通透性,分解膜蛋白,导致细胞破裂和死亡,抑制菌株的正常生长[20]。在胆盐中时,菌株产生的胆盐水解酶不能够完全消除胆盐的毒性,而胆盐水解酶在pH 值6.0 时的解毒能力最强,菌株本身产酸也会降低胆盐水解酶的效率,菌株的耐酸和耐胆盐能力时一种交叉的作用机制。毕洁[21]研究胆盐水解酶提高乳酸菌胆盐耐受能力的生理机制发现菌株在受到胆盐胁迫,菌株细胞的胞质变得的稀疏,而添加胆盐水解酶的菌株细胞质不会下降,胞质内出现类似囊泡的微粒组分附着在细胞膜上,形成一层不规则的生物膜,提高了菌株的耐胆盐能力。4 株菌株的胆盐耐受稳定性差可能由菌株的转录变化差异引起。乌日娜[22]利用胆盐胁迫培养L.caseiZhang,发现其蛋白质组的发生变化,最终导致菌株功能的变化。由此推断在传代过程中维持胆盐刺激,是提高其胆盐耐受传代稳定性的一种可行方案。

图1 M547、M621、M748、M750在0.1%胆盐中存活率的变化Fig.1 Change in survival rate of M547,M621,M748,M750 in 0.1% bile salt
2.2 胆盐浓度对菌株生长能力的影响
。
由图2 可知,添加0.02%胆盐培养对菌株的生长影响不明显,添加0.04%胆盐培养对菌株生长产生了一定的抑制作用,菌株生长缓慢但能接近正常水平,0.06%胆盐浓度培养的菌株几乎停止生长。菌株进入胃肠道后,定植发挥益生功能必须保证到达肠道时活菌数达到106CFU/g 以上,要保证菌株的正常生长,同时过低的浓度无法体现胆盐培养的作用,所以选择0.04%胆盐浓度作为最终的培养浓度。

图2 菌株M547、M621、M748、M750在不同胆盐浓度下的生长能力Fig.2 Growth capacity of strains M547,M621,M748 and M750 at different bile salt concentrations
2.3 传代过程中菌株耐胆盐能力的稳定性
由表1 和表2 可知,经过独立样本t检验,胆盐培养的菌株的在0.075%和0.1%胆盐的耐受能力的影响上存在显著性差异。由图3 和表3 可知,植物乳杆菌M547、植物乳杆菌M621、植物乳杆菌M748、戊糖乳杆菌M750 在0.075 %胆盐的耐受能力随着传代过程变化较小。由图4 和表4 可知,4 株菌株对0.075%胆盐耐受能力较强,菌株对于0.1%胆盐耐受能力本身较差,但在添加0.04%胆盐的MRS 液体培养基中培养的菌株耐胆盐能力有明显提高,M547 的0.1%胆盐耐受能力为50.99%~75.52%变为63.42%~88.55%,M621 的0.1%胆盐耐受能力为49.67%~66.34% 变为60.94%~83.36%,M748 的0.1% 胆盐耐受能力为28.73%~67.69%变为53.29%~86.31%,M750 的0.1%胆盐耐受能力为21.36%~55.34%变为49.50%~67.05%。菌株对0.1%胆盐的耐受能力随着传代过程变化,整体呈现下降趋势。卢晓[23]通过添加乳化剂的方法提高KPGG 菌粉的耐胆盐能力,可以提高4 h 后1.98个活菌数对数值。植物乳杆菌M547、植物乳杆菌M621、植物乳杆菌M748、戊糖乳杆菌M750 对0.1%胆盐浓度的耐受能力稳定性差,在添加0.04%胆盐的MRS 液体培养基中的菌株耐胆盐能力有明显提高,菌株传代过程中的耐胆盐能力随着传代过程变化,整体呈下降趋势,但下降幅度明显减小,菌株的耐胆盐能力更稳定。一方面在添加胆盐的培养基中,培养液的pH 相应的提高,有利于胆盐水解酶发挥更强的解毒作用,另一方面长期在0.04%胆盐培养基中生长,刺激了细胞分泌更多的胆盐水解酶,保证菌株正常的生长代谢,也有可能刺激了应激蛋白的产生,原本没有表达的蛋白质得到了表达,而0.04%胆盐培养的菌株的生长曲线最终接近正常MRS 可间接的证明这一点。

表1 胆盐培养后的0.075%胆盐耐受能力的独立样本t检验Table 1 Independent sample t-test for 0.075% bile salt tolerance after bile salt culture

表2 胆盐培养后的0.1%胆盐耐受能力的独立样本t检验Table 2 Independent sample t-test for 0.1% bile salt tolerance after bile salt culture

表3 菌株在胆盐培养后0.075%胆盐耐受存活提高率Table 3 The survival rate of strains tolerated by 0.075% bile salt after bile salt culture increased

表4 菌株在胆盐培养后0.1%胆盐耐受存活提高率Table 4 The survival rate of strains tolerated by 0.1% bile salt after bile salt culture increased

图3 菌株在MRS与0.04%胆盐培养基中传代后在0.075%胆盐存活率变化Fig.3 Variation of 0.075% bile salt survival rate after passage of strain in MRS and 0.04% bile salt medium

图4 菌株在MRS培养基中与0.04%胆盐培养基中传代后在0.1%胆盐存活率变化Fig.4 Variation in survival rate of 0.1% bile salt after passage between MRS medium and 0.04% bile salt medium
2.4 传代过程中菌株产酸能力的稳定性
由表5 可知,经过独立样本t检验,胆盐培养对菌株的产酸能力的影响不存在显著性差异。由图5可知,菌株M547、M621、M748、M750 培养液的pH 值在传代过程中的没有明显变化趋势,稳定性好,说明M547、M621、M748、M750 经过多次传代后仍可以保持筛选之初的产酸能力。添加胆盐刺激培养对M547、M621、M748、M750 的pH 值没有明显的影响,产酸能力稳定性几乎没有变化,菌株培养液的pH 值仍在3.60~4.0 之间。菌株的产酸能力是菌株的活力的重要指标,结果表明胆盐培养的菌株的活性没有明显变化。产酸能力是反应菌群整体活力的一个重要指标,同时也是乳酸菌发酵能力的表现,两种培养方法培养的菌株的产酸能力变化曲线类似,说明添加胆盐培养后菌株的发酵正常使用不产生影响。杨行等[24]在研究新疆酸奶中的乳酸菌发现乳杆菌的产酸能力较强,pH 值一般在4.00 以下。

表5 胆盐培养后产酸能力的独立样本t检验Table 5 Independent sample t-test for acid production capacity after bile salt culture

图5 菌株在MRS培养基中与0.04%胆盐培养基中的培养液的pH值Fig.5 pH value of culture medium in MRS medium versus 0.04% bile salt medium
2.5 传代过程中菌株耐酸能力的稳定性
由表6 可知,经过独立样本t检验,胆盐培养对菌株的耐酸能力的影响不存在显著性差异。由图6 可知,耐酸能力同样是菌株耐受人体环境的重要指标。由图6 可以看出,M547、M621、M748、M750 在传代过程中的耐酸能力无明显变化,没有明显的简单递增或简单递减趋势,呈波动趋势,波动幅度较小。植物乳杆菌M547、植物乳杆菌M621、植物乳杆菌M748、戊糖乳杆菌M750 的耐酸能力具有一定的稳定性,植物乳杆菌的耐酸能力普遍较强。添加0.04%胆盐培养的菌株的在传代过程中的耐酸能力没有明显规律,但胆盐刺激培养后的菌株耐酸能力变化范围减小,M547 的最大值和最小值差距从21%变为10%左右,M621 的最大值和最小值差距从15%变为12%左右,M748 的最大值和最小值差距从22%变化11%左右。乳杆菌的耐酸机制与内外pH 稳定性、蛋白质修复、细胞膜的改变等有关[25]。由于胆盐的添加的导致培养环境的pH 改变,而质子动力酶、产碱酶的活力随着pH 的改变而改变,促进在最终的传代中,菌株对环境的突然的改变表现不适应性,但随着长期的传代过程逐渐适应,且菌株产酸的影响下,最终达到菌株细胞内外pH 的动态平衡,表现为最终0.04%胆盐培养和MRS 培养的菌株有相似的耐酸能力。由图4 和图6,耐酸能力和耐胆盐能力变化的曲线可以在一定程度上猜测,菌株受影响的代谢途径对于耐酸和耐胆盐存在交互的可能性很小。
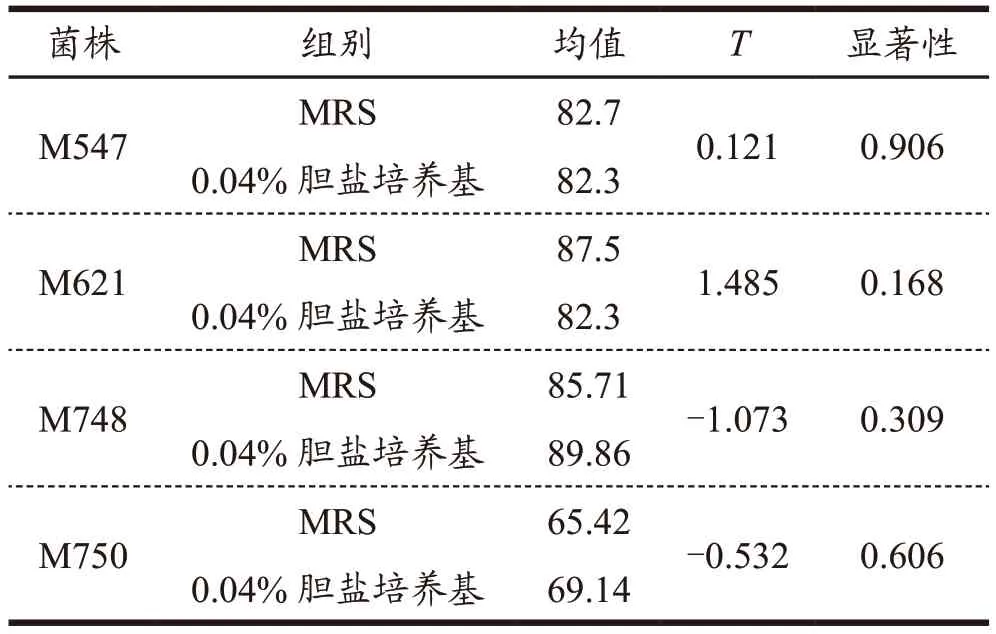
表6 胆盐培养后耐酸能力的独立样本t检验Table 6 Independent sample t-test for acid tolerance after bile salt culture

图6 菌株在MRS与0.04%胆盐培养基中传代后pH值2.5的存活率Fig.6 Survival rate of pH value 2.5 after passage of MRS and 0.04% bile salt medium
3 结论
本研究通过对不同胆盐质量分数对菌株M547、M621、M748 和M750 生长规律的影响确定了选用0.04%胆盐作为培养浓度,改变菌株的培养环境。0.04%胆盐培养对菌株的产酸能力和耐酸能力有一定的影响,但作用效果不明显,而对菌株胆盐的耐受能力有明显的提高作用,在传代过程中,菌株对0.075%胆盐的耐受能力提高了11%~18%左右,对0.1%胆盐的耐受能力提高了20%~34%左右。菌株在传代过程中,对0.1%胆盐的耐受能力逐渐降低,而胆盐培养可以改变这种现象,说明在连续传代过程中菌株的转录情况发生了变化,而胆盐培养可以作为回调部分转录组的一种方法,部分耐胆盐相关的表达发生改变,胆盐培养可以作为菌株胆盐耐受能力提高的手段。本研究为乳杆菌耐受能力机理的研究提供了新方向,也探讨了一种提高菌株遗传稳定性的方法,通过改善外部环境改变菌株的生长情况,这种方法相对操作简单,但胆盐培养对菌株的影响转录机制需要进一步的研究。
